1 . 周期表中VIA族元素及其化合物应用广泛。H2S(燃烧热为562.2kJ•mol-1)是一种易燃的有毒气体,可制取各种硫化物;硫酸、硫酸盐是重要化工原料;硫酰氯(SO2Cl2)是重要的化工试剂,常作氯化剂或氯磺化剂。唒(34Se)(和碲(52Te)的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收Se,以电解强碱性Na2TeO3溶液制备Te。下列有关物质的性质与用途具有对应关系的是
| A.硫化钠具有还原性,可用作Hg2+沉淀剂 |
| B.浓硫酸具有吸水性,可用于干燥二氧化硫 |
| C.硫黄为淡黄色固体,可用作制硫磺皂 |
| D.二氧化硫具有氧化性,可用于漂白纸浆 |
您最近一年使用:0次
名校
2 . 在温热气候条件下,浅海地区有厚层的石灰石沉积,而深海地区却很少。下列解析不正确的是
| A.与深海地区相比,浅海地区水温较高,有利于游离的CO2增多、石灰石沉积 |
| B.与浅海地区相比,深海地区压强大,石灰石岩层易被CO2溶解,沉积少 |
| C.深海地区石灰石岩层的溶解反应为CaCO3(s)+H2O(l)+CO2(aq)=Ca(HCO3)2(aq) |
D.海水呈弱碱性,大气中CO2浓度增加,会导致海水中 浓度增大 浓度增大 |
您最近一年使用:0次
2023-10-22更新
|
397次组卷
|
6卷引用:河北省衡水市桃城区第十四中学2019-2020学年高二下学期期末考试化学试题
河北省衡水市桃城区第十四中学2019-2020学年高二下学期期末考试化学试题河南省洛阳市 洛宁县第一高级中学2022-2023学年高二下学期5月质量检测化学试题第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 第1课时 沉淀溶解平衡与溶度积(已下线)第5讲 难溶电解质的溶解平衡(已下线)寒假作业07 沉淀溶解平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)题型15 沉淀溶解平衡及图像分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
3 . 要使工业废水中的Pb2+沉淀,可用硫酸盐、碳酸盐等作沉淀剂。已知某温度时,Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-21,p(Pb)=-lgc(Pb2+),p(B)=-lgc( )或-lgc(
)或-lgc( )。为研究沉淀效果,在物质的量浓度相同的Na2SO4和Na2CO3的混合溶液中滴加PbCl2溶液产生两种沉淀(温度升高,PbSO4、PbCO3的Ksp均增大),上述反应过程溶液中离子浓度的负对数关系如图所示。下列说法错误的是
)。为研究沉淀效果,在物质的量浓度相同的Na2SO4和Na2CO3的混合溶液中滴加PbCl2溶液产生两种沉淀(温度升高,PbSO4、PbCO3的Ksp均增大),上述反应过程溶液中离子浓度的负对数关系如图所示。下列说法错误的是

 )或-lgc(
)或-lgc( )。为研究沉淀效果,在物质的量浓度相同的Na2SO4和Na2CO3的混合溶液中滴加PbCl2溶液产生两种沉淀(温度升高,PbSO4、PbCO3的Ksp均增大),上述反应过程溶液中离子浓度的负对数关系如图所示。下列说法错误的是
)。为研究沉淀效果,在物质的量浓度相同的Na2SO4和Na2CO3的混合溶液中滴加PbCl2溶液产生两种沉淀(温度升高,PbSO4、PbCO3的Ksp均增大),上述反应过程溶液中离子浓度的负对数关系如图所示。下列说法错误的是
| A.常温下PbSO4的溶解度大于PbCO3的溶解度 |
| B.向d点对应的溶液中加入对应阴离子的钠盐,溶液组成由d点向b点方向移动 |
C.e约为4且对应的阴离子是 |
| D.对于曲线Ⅰ,对b点的溶液加热(忽略水分蒸发),溶液组成由b点向c点移动 |
您最近一年使用:0次
名校
解题方法
4 . 我国每年产生的废旧铅蓄电池约330万吨。从含铅废料(PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。一种回收铅的工作流程如下:

过程Ⅰ: 已知:PbSO4、PbCO3的溶解度(20℃)见图1;Na₂SO4、Na2CO3的溶解度见图2。

(1)根据图1写出过程Ⅰ的离子方程式:___________
(2)生产过程中的温度应保持在40 ℃,若温度降低,PbSO4的转化速率下降。根据图2,解释可能原因:
Ⅰ.温度降低,反应速率降低;
Ⅱ.___________ (请你提出一种合理解释)。
(3)过程Ⅱ,发生反应 2PbO2+H2C2O4=2PbO+H2O2+2CO2↑ 。实验中检测到有大量 O2放出,推测PbO2氧化了H2O2。可通过实验证实这一推测,实验方案是:___________ (已知:PbO2为棕黑色固体; PbO为橙黄色固体)

过程Ⅰ: 已知:PbSO4、PbCO3的溶解度(20℃)见图1;Na₂SO4、Na2CO3的溶解度见图2。

(1)根据图1写出过程Ⅰ的离子方程式:
(2)生产过程中的温度应保持在40 ℃,若温度降低,PbSO4的转化速率下降。根据图2,解释可能原因:
Ⅰ.温度降低,反应速率降低;
Ⅱ.
(3)过程Ⅱ,发生反应 2PbO2+H2C2O4=2PbO+H2O2+2CO2↑ 。实验中检测到有大量 O2放出,推测PbO2氧化了H2O2。可通过实验证实这一推测,实验方案是:
您最近一年使用:0次
名校
解题方法
5 . 下列反应的离子方程式书写正确的是
| A.用Na2S除去废水中的Hg2+:S2-+Hg2+=HgS↓ |
| B.用FeCl3溶液刻蚀电路板上的铜:Fe3++Cu=Cu2++Fe2+ |
C.用过量NaOH溶液脱除烟气中的SO2:OH-+SO2=HSO |
| D.海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O |
您最近一年使用:0次
6 . 用沉淀法除杂能否将杂质离子全部通过沉淀除去________ ?
您最近一年使用:0次
7 . 水垢的主要成分为什么是 和
和 ,而不是
,而不是 和
和
______ ?
 和
和 ,而不是
,而不是 和
和
您最近一年使用:0次
名校
8 . 下列有关化学用语的说法错误的是
A.用碳酸钠溶液浸泡锅炉水垢的原理: |
B. 溶液水解离子方程式: 溶液水解离子方程式: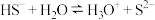 |
C.碳酸氢钠在水中的电离方程式为: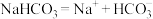 |
D.防蛀剂 微溶于水,其溶解平衡表达式为: 微溶于水,其溶解平衡表达式为: |
您最近一年使用:0次
9 . 某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料,制备碱式碳酸铜[Cu2(OH)2CO3]的工艺流程如图所示,下列说法不正确的是


| A.滤渣Ⅰ中的主要成分是MnO2、S、SiO2 |
| B.“除铁”时加入的试剂a可为CuO、Cu、Cu(OH)2等 |
C.“沉锰”(除Mn2+)过程中反应的离子方程式为Mn2++HCO +NH3=MnCO3↓+NH +NH3=MnCO3↓+NH |
| D.对滤液Ⅱ进行蒸发结晶,可以得到硫酸铵晶体 |
您最近一年使用:0次
解题方法
10 . 下列说法中正确的是
| A.只有难溶电解质在溶液中才存在沉淀溶解平衡 |
| B.难溶电解质在溶液中只存在沉淀溶解平衡,不存在电离平衡 |
| C.沉淀溶解平衡只能通过电解质溶于水时建立 |
| D.达到沉淀溶解平衡时,电解质表面上的离子或分子脱离电解质的速率与溶液中的离子或分子回到电解质表面的速率相等 |
您最近一年使用:0次



