1 . 对金属制品进行抗腐蚀处理可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:

以铝材为阳极,在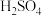 溶液中电解,铝材表面形成氧化膜,阳极电极反应式为
溶液中电解,铝材表面形成氧化膜,阳极电极反应式为_______ 。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是_______ 。
(3)利用下图装置可以模拟铁的两种电化学防护的方法:若X为碳棒,为减缓铁的腐蚀,开关K应置于_______ (填“M”或“N”)处。若X为锌,开关K置于_______ (同上)处,该电化学保护法称为_______ 。

(1)以下为铝材表面处理的一种方法:

以铝材为阳极,在
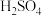 溶液中电解,铝材表面形成氧化膜,阳极电极反应式为
溶液中电解,铝材表面形成氧化膜,阳极电极反应式为(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是
(3)利用下图装置可以模拟铁的两种电化学防护的方法:若X为碳棒,为减缓铁的腐蚀,开关K应置于

您最近一年使用:0次
2 . 下列实验装置符合实验目的是
| 选项 | A | B |
| 目的 | 验证铁的析氢腐蚀 | 构成原电池 |
| 装置 |  |  |
| 选项 | C | D |
| 目的 | 在铁制品上镀铜 | 减缓锌的锈蚀 |
| 装置 | 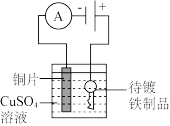 | 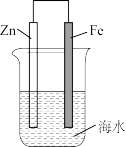 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 化学与生产、生活和社会发展密切相关,下列叙述不正确的是
| A.电热水器用镁棒防止金属内胆腐蚀,原理是运用电化学的保护方法 |
| B.针对新冠肺炎疫情,可用医用酒精、84消毒液等对场所进行杀菌消毒 |
| C.我国西周时期发明的“酒曲”酿酒工艺,是利用了催化剂使平衡正向移动的原理 |
| D.免洗洗手液的有效成分之一活性银离子能使病毒蛋白质变性 |
您最近一年使用:0次
2022-10-11更新
|
152次组卷
|
2卷引用:福建省泉州第一中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
4 . 电化学在科技、生产、社会和生活的各个发面都发挥着重要的作用。
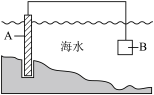
(1)图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择_______ (填字母)。这种防止金属材料腐蚀的方法叫做_______。
a.金块 b.锌板 c.铜板 d.钠块
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺,节能超过30%,在此工艺中,物料传输和转化关系如图。(电极均为石墨电极)
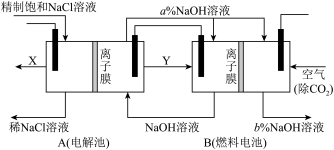
(2)写出A装置中发生反应的离子反应方程式:_______,分析比较图示中a%与b%的大小:a%_______b%(填“>”“<”或“=”)。
(3)写出燃料电池B中的负极的电极反应:_______。
通过NO传感器可监测汽车尾气中NO的含量,工作原理如图所示:
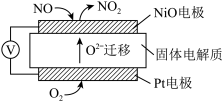
(4)NiO电极上发生的是反应_______(填“氧化”或“还原”)。Pt电极上的电极反应式为_______。
(1)图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择_______ (填字母)。这种防止金属材料腐蚀的方法叫做_______。

a.金块 b.锌板 c.铜板 d.钠块
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺,节能超过30%,在此工艺中,物料传输和转化关系如图。(电极均为石墨电极)

(2)写出A装置中发生反应的离子反应方程式:_______,分析比较图示中a%与b%的大小:a%_______b%(填“>”“<”或“=”)。
(3)写出燃料电池B中的负极的电极反应:_______。
通过NO传感器可监测汽车尾气中NO的含量,工作原理如图所示:

(4)NiO电极上发生的是反应_______(填“氧化”或“还原”)。Pt电极上的电极反应式为_______。
您最近一年使用:0次
2022-10-11更新
|
300次组卷
|
2卷引用:福建省泉州第一中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
5 . 医用外科一次性口罩的结构如图所示,下列说法不正确 的是
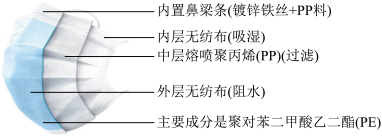

| A.外层具有阻隔飞沫进入口鼻的作用,中间层具有阻隔部分病毒和细菌的作用 |
| B.聚丙烯(PP)与聚对苯二甲酸乙二酯(PE)属于有机高分子材料,都是通过加聚反应合成的 |
| C.镀锌铁丝不易腐蚀,因为除在金属表面覆盖了聚丙烯塑料保护层外,还用了电化学保护法——牺性阳极法 |
| D.医疗机构、发热门诊等场所使用过的口罩须投入专用垃圾桶;健康人群使用过的口罩投入干垃圾桶中,不可回收使用 |
您最近一年使用:0次
2022-10-08更新
|
728次组卷
|
7卷引用:福建省三明市2022-2023学年高三上学期期末考试化学试题
6 . 如图表示的是钢铁在海水中的锈蚀过程,有关金属的腐蚀和防护说法正确的是
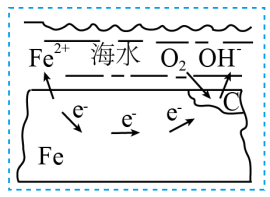

| A.铁主要发生的是析氢腐蚀,酸性条件下发生的是吸氧腐蚀 |
| B.正极为C,电极反应为:O2+2H2O+4e-=4OH- |
| C.可在轮船上焊金属锌的方法对铁加以保护,此法为外加电源的阴极保护法 |
| D.镀锌白铁的保护层破损,金属铁很快就会被腐蚀 |
您最近一年使用:0次
名校
解题方法
7 . 下列有关金属腐蚀与防护的说法正确的是
| A.纯银器表面在空气中因电化学腐蚀渐渐变暗 |
| B.当有镀层的铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
您最近一年使用:0次
2022-09-18更新
|
416次组卷
|
42卷引用:2015-2016学年福建省莆田二十五中高二上学期期中测试化学试卷
2015-2016学年福建省莆田二十五中高二上学期期中测试化学试卷2015-2016学年福建省大田一中高二上学期期中考试化学试卷2015-2016学年福建省厦门市六中高二下学期期中考试化学试卷【全国百强校】福建省厦门第一中学2017-2018学年高二下学期期中考试化学试题(已下线)2011-2012学年广东省汕头金山中学高一第一学期期末考试化学(理)试卷(已下线)2012-2013学年山东省临沂市重点高中高二上学期期末考试化学试卷(已下线)2014年高中化学苏教版选修四模块综合检测练习卷2014-2015广东省汕头市东厦中学等三校高二上学期期末化学试卷2014-2015学年广东省深圳市明珠学校高二上学期期中化学试卷2015-2016学年浙江余姚中学高二上学期期中考试化学试卷2015-2016学年山西大学附中高二上12月月考化学试卷2015-2016学年新疆农业大学附中高二下学期期中化学试卷2016-2017学年山东省德州市陵城一中高二上10月月考化学试卷2016-2017黑龙江牡丹江第一高级中学高二上期末化学卷河南省郑州市中牟县二中2017-2018学年高二第一次月考化学试题河北省邱县第一中学2017-2018学年高二上学期第一次月考化学试题河北省馆陶县第一中学2017-2018学年高二上学期第一次月考化学试题山东省枣庄市第八中学南校区高二10月份月考化学试题山东省枣庄市第八中学东校区2017-2018学年高二10月月考化学试题山东省济南市第一中学2017-2018学年高二10月阶段测试化学试题山东省锦泽技工学校2017-2018学年高二10月月考化学试题黑龙江省哈尔滨市第三中学2017-2018届高二上学期模块考试(期末)化学试题黑龙江省双鸭山市第一中学2017-2018学年高二下学期开学考试化学试题陕西省西安市交通大学附属中学2017-2018学年高二第二次月考期末选修四测试化学试题黑龙江省双鸭山市第一中学2017-2018学年高二3月开学考试化学试题陕西省黄陵中学2018-2019学年高二(重点班)上学期期中考试化学试题陕西省黄陵中学2018-2019学年高二上学期期末考试化学试题海南省临高县临高中学2019-2020学年高二上学期期中考试化学试题河北省邯郸市永年区第二中学2020-2021学年高二上学期第一次月考教学质量检测化学试题山东省莱芜一中2021届高三第一次考试化学试题陕西省渭南市临渭区尚德中学2020-2021学年高二上学期第一次月考化学试题(已下线)第12单元 电化学基础(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷河南省南阳市第十中学2020-2021学年高二上学期第一次月考化学试题河北省唐山市丰润区第二中学2020-2021学年高二上学期1月月考化学试题黑龙江省双鸭山市集贤县2021-2022学年高二上学期期末考试化学试题 山东省济南市莱芜第四中学2021-2022学年高二上学期第一次质量检测化学试题辽宁省昌图县第一高级中学2022-2023学年高二10月月考化学试题山东省青岛市第三十九中学2020-2021学年高二上学期期中考试化学试题辽宁省锦州市黑山县黑山中学2021-2022学年高二上学期12月月考化学试题辽宁省辽河油田第二高级中学2022-2023学年高二上学期期末考试化学试题广东省揭阳市2022-2023学年高二下学期教学质量测试化学试题辽宁省昌图县第一高级中学2023-2024学年高二上学期10月月考化学试题
解题方法
8 . 深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如下图所示,下列与此原理有关的说法错误的是


| A.输送暖气的管道(管外常涂有一层沥青)不易发生此类腐蚀 |
| B.管道上刷富锌油漆可以延缓管道的腐蚀 |
C.这种情况下,Fe腐蚀的最终产物为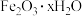 |
D.正极反应: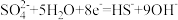 |
您最近一年使用:0次
2022-09-14更新
|
168次组卷
|
3卷引用:福建省漳平一中、永安一中、德化一中2021-2022学年高三上学期三校联考化学试卷
福建省漳平一中、永安一中、德化一中2021-2022学年高三上学期三校联考化学试卷福建省龙岩市永定区坎市中学2022-2023学年高三上学期期中化学试题(已下线)北京市海淀区2022届高三一模(选择题11-14)
9 . 生活中常常会涉及到一些化学知识。下列叙述中正确的是
| A.纯铁比生铁易生锈 |
| B.硅胶是食品包装袋中常用的干燥剂 |
| C.“84”消毒液与医用酒精都是因氧化性而使蛋白质变性 |
| D.酸雨是指pH<7的降水,主要是由于空气中SO2含量偏高引起 |
您最近一年使用:0次
解题方法
10 . 某化学兴趣小组设计了如下实验,探究铁的电化学腐蚀及防护原理。
(1)甲同学利用下图装置,进行铁的电化学腐蚀原理探究。
查阅资料:1.Fe2+遇K3[Fe(CN)6]溶液生成蓝色沉淀。
2.K3[Fe(CN)6]具有氧化性。
①用电极反应式解释实验ⅱ中的现象:_______ 。
②乙同学认为仅通过ⅲ中现象不能证明铁发生了电化学腐蚀,理由是_______ 。
③为验证猜想,乙同学设计了ⅳ、ⅴ、ⅵ三组对比实验,并记录如下:
a.以上实验表明:在Cl−存在条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b.为探究Cl−的存在对反应的影响:乙同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验ⅵ,发现铁片表面产生蓝色沉淀。此补充实验表明 Cl−的作用是_______ 。
④结合上述两位同学的实验探究,请你改进甲同学步骤ⅲ的操作:_______ ,以证明铁发生了电化学腐蚀。
(2)丙同学向如图所示装置的容器a、b中分别加入30 mL3.5%的NaCl溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。
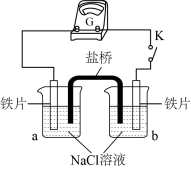
实验检测表明:容器a中的溶液产生了Fe2+,而容器b中的溶液不存在Fe2+。则:容器b中铁片做_______ 极(填:“正”或“负”)。加热后,电流计指针发生偏转的原因可能是_______ 。
(3)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下, Fe钝化形成致密Fe3O4氧化膜,则阳极的电极反应式为_______ 。
(1)甲同学利用下图装置,进行铁的电化学腐蚀原理探究。
| 装置 | 实验步骤及操作 | 现象 |
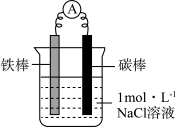 | ⅰ.连好装置,观察 | 电流表指针偏转 |
| ⅱ.一段时间后,向烧杯中滴加酚酞 | 碳棒附近溶液变红 | |
| ⅲ.一段时间后,向烧杯中滴加铁氰化钾 (K3[Fe(CN)6])溶液 | 铁片表面产生蓝色沉淀 |
2.K3[Fe(CN)6]具有氧化性。
①用电极反应式解释实验ⅱ中的现象:
②乙同学认为仅通过ⅲ中现象不能证明铁发生了电化学腐蚀,理由是
③为验证猜想,乙同学设计了ⅳ、ⅴ、ⅵ三组对比实验,并记录如下:
| 实验 | 滴管 | 试管 | 现象 |
 | 0.5 mol·L−1 K3[Fe(CN)6] 溶液 | ⅳ.蒸馏水 | 无明显变化 |
| ⅴ. 1.0 mol·L−1 NaCl 溶液 | 铁片表面产生大量蓝色沉淀 | ||
| ⅵ.0.5 mol·L−1 Na2SO4溶液 | 无明显变化 |
b.为探究Cl−的存在对反应的影响:乙同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验ⅵ,发现铁片表面产生蓝色沉淀。此补充实验表明 Cl−的作用是
④结合上述两位同学的实验探究,请你改进甲同学步骤ⅲ的操作:
(2)丙同学向如图所示装置的容器a、b中分别加入30 mL3.5%的NaCl溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。

实验检测表明:容器a中的溶液产生了Fe2+,而容器b中的溶液不存在Fe2+。则:容器b中铁片做
(3)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下, Fe钝化形成致密Fe3O4氧化膜,则阳极的电极反应式为
您最近一年使用:0次
2022-09-06更新
|
159次组卷
|
2卷引用:福建省宁德市部分达标中学2021-2022学年高二上学期期中联合考试化学试题



