解题方法
1 .  作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(主要含
作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(主要含 ,含有少量
,含有少量 等元素)制备
等元素)制备 的流程如下:
的流程如下:

已知: ,
, ,
, ,
, 。
。
回答下列问题:
(1)基态 的价电子排布式为
的价电子排布式为________ , 的中心原子杂化方式为
的中心原子杂化方式为________________ 。
(2)为提高硫酸溶解菱锰矿速率,可采取的措施有________ (举1例),溶解的化学方程式为________________ 。
(3)加入少量 的作用是将
的作用是将 氧化为
氧化为 ,实际生产中不宜用
,实际生产中不宜用 替代
替代 ,可能原因是
,可能原因是________________ 。
(4)溶矿反应完成后恢复常温,观察到反应器中溶液呈红褐色浑浊状且测得其 ,此时
,此时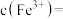
________  ,用石灰乳调节至
,用石灰乳调节至 ,除去的金属离子是
,除去的金属离子是________________ 。
(5)为了除去 ,加入少量
,加入少量 溶液,生成的沉淀有
溶液,生成的沉淀有________________ 。
(6)电解槽中阳极的电极反应式为________________ 。
(7)煅烧窑中生成 反应的化学方程式为
反应的化学方程式为________________ 。
 作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(主要含
作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(主要含 ,含有少量
,含有少量 等元素)制备
等元素)制备 的流程如下:
的流程如下:
已知:
 ,
, ,
, ,
, 。
。回答下列问题:
(1)基态
 的价电子排布式为
的价电子排布式为 的中心原子杂化方式为
的中心原子杂化方式为(2)为提高硫酸溶解菱锰矿速率,可采取的措施有
(3)加入少量
 的作用是将
的作用是将 氧化为
氧化为 ,实际生产中不宜用
,实际生产中不宜用 替代
替代 ,可能原因是
,可能原因是(4)溶矿反应完成后恢复常温,观察到反应器中溶液呈红褐色浑浊状且测得其
 ,此时
,此时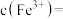
 ,用石灰乳调节至
,用石灰乳调节至 ,除去的金属离子是
,除去的金属离子是(5)为了除去
 ,加入少量
,加入少量 溶液,生成的沉淀有
溶液,生成的沉淀有(6)电解槽中阳极的电极反应式为
(7)煅烧窑中生成
 反应的化学方程式为
反应的化学方程式为
您最近一年使用:0次
2 . “碳中和”是国家战略,其目的是实现 的排放量和利用量达到相等,将
的排放量和利用量达到相等,将 资源化是实现“碳中和”目标的重要手段.回答下列问题:
资源化是实现“碳中和”目标的重要手段.回答下列问题:
(1)下列措施有利于“碳中和”的是_______________(填标号)。
(2) 和
和 在催化剂作用下发生反应可合成清洁能源甲醇:
在催化剂作用下发生反应可合成清洁能源甲醇:

①已知该反应的正反应率 (
( 为正反应的速率常数),某温度时测得数据如表中所示.则此温度下表中
为正反应的速率常数),某温度时测得数据如表中所示.则此温度下表中
_______________ 。
②在一定条件下,体系中 的平衡转化率
的平衡转化率 与
与 和
和 的关系如图所示,
的关系如图所示, 和
和 分别表示温度或压强.
分别表示温度或压强. 表示的物理量是
表示的物理量是_______________ (填“温度”或“压强”),
_______________  (填“>”或“<”)。
(填“>”或“<”)。

③为探究该反应原理,进行如下实验:在一恒温,体积为 恒容密闭容器中,充入
恒容密闭容器中,充入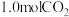 和
和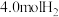 ,进行该反应(不考虑其它副反应),平衡时测得
,进行该反应(不考虑其它副反应),平衡时测得 的物质的量为
的物质的量为 .则该温度下平衡常数
.则该温度下平衡常数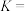
_______________ (保留2位有效数字)。
(3)若 和
和 按一定比例反应,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示.当温度为
按一定比例反应,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示.当温度为 时,图中
时,图中 点
点_______________ (填“是”或“不是”)处于平衡状态.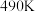 之后,甲醇产率下降,请分析其变化产生可能的原因:
之后,甲醇产率下降,请分析其变化产生可能的原因:_______________ 。(写出其中一种)。

(4) 是一种廉价的碳资源,其综合利用具有重要意义.
是一种廉价的碳资源,其综合利用具有重要意义. 可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在
可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在_______________ 极,该电极反应式是:_______________ 。
 的排放量和利用量达到相等,将
的排放量和利用量达到相等,将 资源化是实现“碳中和”目标的重要手段.回答下列问题:
资源化是实现“碳中和”目标的重要手段.回答下列问题:(1)下列措施有利于“碳中和”的是_______________(填标号)。
| A.植树造林,发展绿色经济 | B.通过裂化将重油转化为汽油 |
C.在燃煤中添加 或 或 | D.大力开采和使用可燃冰 |
(2)
 和
和 在催化剂作用下发生反应可合成清洁能源甲醇:
在催化剂作用下发生反应可合成清洁能源甲醇:
①已知该反应的正反应率
 (
( 为正反应的速率常数),某温度时测得数据如表中所示.则此温度下表中
为正反应的速率常数),某温度时测得数据如表中所示.则此温度下表中
 |  |  | |
| 1 | 0.02 | 0.01 |  |
| 2 | 0.04 | 0.01 |  |
 的平衡转化率
的平衡转化率 与
与 和
和 的关系如图所示,
的关系如图所示, 和
和 分别表示温度或压强.
分别表示温度或压强. 表示的物理量是
表示的物理量是
 (填“>”或“<”)。
(填“>”或“<”)。
③为探究该反应原理,进行如下实验:在一恒温,体积为
 恒容密闭容器中,充入
恒容密闭容器中,充入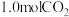 和
和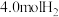 ,进行该反应(不考虑其它副反应),平衡时测得
,进行该反应(不考虑其它副反应),平衡时测得 的物质的量为
的物质的量为 .则该温度下平衡常数
.则该温度下平衡常数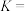
(3)若
 和
和 按一定比例反应,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示.当温度为
按一定比例反应,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示.当温度为 时,图中
时,图中 点
点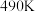 之后,甲醇产率下降,请分析其变化产生可能的原因:
之后,甲醇产率下降,请分析其变化产生可能的原因:
(4)
 是一种廉价的碳资源,其综合利用具有重要意义.
是一种廉价的碳资源,其综合利用具有重要意义. 可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在
可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在
您最近一年使用:0次
解题方法
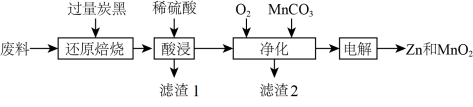
3 . 废旧锌锰电池回收处理可实现资源的再利用,初步处理后的废料中含有MnO2、MnOOH、Zn(OH)2、及Fe等,用该废料制备Zn和MnO2的一种工艺流程如下:
资料a:Mn的金属活动性强于Fe;
Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b:生成氢氧化物沉淀的pH
回答下列问题:
(1)“还原焙烧”是为了把Mn元素转化为MnO,请写出MnOOH发生反应的化学方程式_______ 。
(2)为了提高“酸浸”的速率,可以采取的措施有_______ ;滤渣1的主要成分为_______ 。
(3)“净化”时通入O2的目的是_______ ,加入MnCO3时必须控制pH范围为_______ ;检验净化后的溶液中是否含有Fe元素的试剂是_______ 。
(4)“电解”时MnO2在_______ (填“阳”或“阴”)极生成,其电极反应式为_______ 。

资料a:Mn的金属活动性强于Fe;
Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b:生成氢氧化物沉淀的pH
| Mn(OH)2 | Zn(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 8.1 | 6.2 | 1.9 |
| 完全沉淀时 | 10.1 | 8.2 | 3.2 |
(1)“还原焙烧”是为了把Mn元素转化为MnO,请写出MnOOH发生反应的化学方程式
(2)为了提高“酸浸”的速率,可以采取的措施有
(3)“净化”时通入O2的目的是
(4)“电解”时MnO2在
您最近一年使用:0次
名校
4 . 电镀实验在生产生活中应用广泛。
Ⅰ.某实验小组设计了如图在纽扣上电镀铜的实验装置:

(1)如图中,石墨是___________ (填阴极或阳极),对应的电极方程式为:___________ ;如图装置电解一段时间后,溶液中___________ (填微粒化学式)浓度下降,从而影响镀铜的速率和质量。
Ⅱ.实验小组利用如图装置进行铁上电镀铜的实验探究:
(2)实验①中,无色气体产生的原因是 或
或___________ 。
(3)实验①中,气体减少,推测是由于溶液中 减少,且
减少,且___________ 。
(4)欲测定实验①溶液中 的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线
的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线 时,改用胶头滴管滴加蒸馏水至溶液的
时,改用胶头滴管滴加蒸馏水至溶液的___________ ,用 标准溶液滴定时应选用
标准溶液滴定时应选用___________ 滴定管(填“酸式”或“碱式”)。
(5)为确定实验①电解质溶液中 的准确浓度
的准确浓度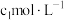 ,实验操作为:准确量取
,实验操作为:准确量取 含有
含有 的溶液于带塞锥形瓶中,调节溶液
的溶液于带塞锥形瓶中,调节溶液 ,加入过量的
,加入过量的 ,用
,用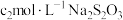 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 。上述过程中反应的离子方程式:
。上述过程中反应的离子方程式: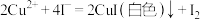 ,
, 。滴定选用的指示剂为
。滴定选用的指示剂为___________ ,滴定终点观察到的现象为:当滴入最后半滴标准溶液时,锥形㼛中溶液___________ 。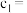
___________ (用 、
、 、
、 等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果
等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果___________ (填“偏大”“偏小”或“无影响”)。
(6)实验②中, 与过量氨水反应的离子方程式为
与过量氨水反应的离子方程式为___________ ,反应后的体系呈___________ 色。
Ⅰ.某实验小组设计了如图在纽扣上电镀铜的实验装置:

(1)如图中,石墨是
Ⅱ.实验小组利用如图装置进行铁上电镀铜的实验探究:
| 装置示意图 | 序号 | 电解质溶液 | 实验现象 |
 | ① | 0.1mol/L +少量 +少量 | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验,铁电极表面有 生成。 生成。 |
| ② | 0.1mol/L +过量氨水 +过量氨水 | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体,经检验,电解液中无Fe元素。 |
 或
或(3)实验①中,气体减少,推测是由于溶液中
 减少,且
减少,且(4)欲测定实验①溶液中
 的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线
的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线 时,改用胶头滴管滴加蒸馏水至溶液的
时,改用胶头滴管滴加蒸馏水至溶液的 标准溶液滴定时应选用
标准溶液滴定时应选用(5)为确定实验①电解质溶液中
 的准确浓度
的准确浓度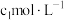 ,实验操作为:准确量取
,实验操作为:准确量取 含有
含有 的溶液于带塞锥形瓶中,调节溶液
的溶液于带塞锥形瓶中,调节溶液 ,加入过量的
,加入过量的 ,用
,用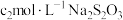 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 。上述过程中反应的离子方程式:
。上述过程中反应的离子方程式: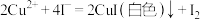 ,
, 。滴定选用的指示剂为
。滴定选用的指示剂为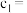
 、
、 、
、 等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果
等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果(6)实验②中,
 与过量氨水反应的离子方程式为
与过量氨水反应的离子方程式为
您最近一年使用:0次
2023-07-13更新
|
158次组卷
|
2卷引用:广东省四校(华附,省实,广雅,深中)2022-2023学年高二下学期期末联考化学试题
解题方法
5 . 工业上 加氢制
加氢制 ,为
,为 的减排与再利用提供了一种新策略,该过程中存在如下反应:
的减排与再利用提供了一种新策略,该过程中存在如下反应:
反应Ⅰ:
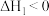
反应Ⅱ:

回答下列问题:
(1)已知: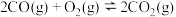

则反应

_______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(2)关于反应Ⅰ,下列说法正确的有_______(填标号)。
(3)向恒压密闭装置中充入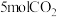 和
和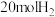 ,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得
,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得 和
和 的物质的量
的物质的量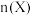 随温度
随温度 变化关系如图所示。
变化关系如图所示。

①曲线 对应物质为
对应物质为_______ (填化学式)。
② 达平衡时,
达平衡时, 的总转化率为
的总转化率为_______  。
。
③结合图像分析,达平衡时装置中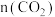 随温度升高的变化趋势为
随温度升高的变化趋势为_______ (填标号)。
A.减小 B.增大 C.先减小后增大 D.先增大后减小
④工业制备 通常控制温度在
通常控制温度在 ℃之间的原因是
℃之间的原因是_______ 。
(4)采用下图装置能实现 电化学法制
电化学法制 ,同时获得副产物
,同时获得副产物 。
。

①铜电极的电极反应式为_______ 。
②每制得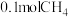 ,理论上
,理论上 电极生成
电极生成_______ 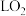 (折算为标准状况)。
(折算为标准状况)。
 加氢制
加氢制 ,为
,为 的减排与再利用提供了一种新策略,该过程中存在如下反应:
的减排与再利用提供了一种新策略,该过程中存在如下反应:反应Ⅰ:

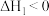
反应Ⅱ:


回答下列问题:
(1)已知:
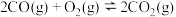

则反应


 、
、 、
、 的代数式表示)。
的代数式表示)。(2)关于反应Ⅰ,下列说法正确的有_______(填标号)。
| A.反应物的键能之和高于生成物的键能之和 |
| B.低温条件有利于该反应自发进行 |
| C.混合气体的平均摩尔质量不再改变,说明反应已达平衡 |
D.恒容条件下,充入更多的 能提高单位体积活化分子的百分数 能提高单位体积活化分子的百分数 |
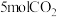 和
和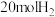 ,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得
,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得 和
和 的物质的量
的物质的量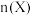 随温度
随温度 变化关系如图所示。
变化关系如图所示。
①曲线
 对应物质为
对应物质为②
 达平衡时,
达平衡时, 的总转化率为
的总转化率为 。
。③结合图像分析,达平衡时装置中
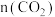 随温度升高的变化趋势为
随温度升高的变化趋势为A.减小 B.增大 C.先减小后增大 D.先增大后减小
④工业制备
 通常控制温度在
通常控制温度在 ℃之间的原因是
℃之间的原因是(4)采用下图装置能实现
 电化学法制
电化学法制 ,同时获得副产物
,同时获得副产物 。
。
①铜电极的电极反应式为
②每制得
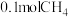 ,理论上
,理论上 电极生成
电极生成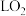 (折算为标准状况)。
(折算为标准状况)。
您最近一年使用:0次
6 . 近年来我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”,将 转化为高附加值化学品成为科学家研究的重要课题。
转化为高附加值化学品成为科学家研究的重要课题。
Ⅰ. 催化
催化 和
和 生产甲醇。
生产甲醇。
①

②

(1)已知:
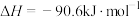 ,则
,则
________ 。
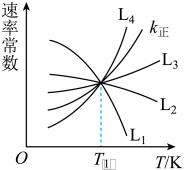
(2)已知:反应①的正反应速率可表示为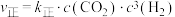 ,逆反应速率可表示为
,逆反应速率可表示为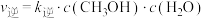 ,其中
,其中 、
、 为速率常数。图中能够代表
为速率常数。图中能够代表 的曲线为
的曲线为________ (填“ ”,“
”,“ ”、“
”、“ ”或“
”或“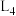 ”)。
”)。
(3)对于上述反应体系,下列说法正确的是________。
(4)不同条件下,按照 投料,
投料, 的平衡转化率如图所示。
的平衡转化率如图所示。

①压强 、
、 、
、 由大到小的顺序是
由大到小的顺序是________ ,压强为 时,温度高于570℃之后,随着温度升高
时,温度高于570℃之后,随着温度升高 平衡转化率增大的原因是
平衡转化率增大的原因是________ 。
②图中点 ,此时压强
,此时压强 为0.1MPa,
为0.1MPa, 的选择性为
的选择性为 (选择性:转化的
(选择性:转化的 中生成
中生成 占整个转化的
占整个转化的 的百分比)。则该温度时反应①的平衡常数
的百分比)。则该温度时反应①的平衡常数
________  (分压=总压
(分压=总压 物质的量分数)。
物质的量分数)。
Ⅱ.电化学法还原 制乙烯
制乙烯
在强酸性溶液中通入 ,用情性电极进行电解可制得乙烯。其原理如图所示:
,用情性电极进行电解可制得乙烯。其原理如图所示:
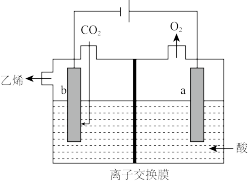
(5)阴极电极反应式为________ 。
 转化为高附加值化学品成为科学家研究的重要课题。
转化为高附加值化学品成为科学家研究的重要课题。Ⅰ.
 催化
催化 和
和 生产甲醇。
生产甲醇。①


②


(1)已知:

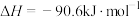 ,则
,则

(2)已知:反应①的正反应速率可表示为
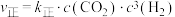 ,逆反应速率可表示为
,逆反应速率可表示为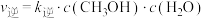 ,其中
,其中 、
、 为速率常数。图中能够代表
为速率常数。图中能够代表 的曲线为
的曲线为 ”,“
”,“ ”、“
”、“ ”或“
”或“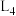 ”)。
”)。(3)对于上述反应体系,下列说法正确的是________。
A.增大 的浓度,反应①、②的正反应速率均增加,逆反应速率均减小 的浓度,反应①、②的正反应速率均增加,逆反应速率均减小 |
| B.恒容密闭容器中气体密度不变时,反应达到平衡状态 |
C.加入催化剂, 的平衡转化率不变 的平衡转化率不变 |
D.温度为 时,反应①的化学平衡常数 时,反应①的化学平衡常数 |
 投料,
投料, 的平衡转化率如图所示。
的平衡转化率如图所示。
①压强
 、
、 、
、 由大到小的顺序是
由大到小的顺序是 时,温度高于570℃之后,随着温度升高
时,温度高于570℃之后,随着温度升高 平衡转化率增大的原因是
平衡转化率增大的原因是②图中点
 ,此时压强
,此时压强 为0.1MPa,
为0.1MPa, 的选择性为
的选择性为 (选择性:转化的
(选择性:转化的 中生成
中生成 占整个转化的
占整个转化的 的百分比)。则该温度时反应①的平衡常数
的百分比)。则该温度时反应①的平衡常数
 (分压=总压
(分压=总压 物质的量分数)。
物质的量分数)。Ⅱ.电化学法还原
 制乙烯
制乙烯在强酸性溶液中通入
 ,用情性电极进行电解可制得乙烯。其原理如图所示:
,用情性电极进行电解可制得乙烯。其原理如图所示:
(5)阴极电极反应式为
您最近一年使用:0次
2023-07-02更新
|
200次组卷
|
2卷引用:广东省广州市天河区2022-2023学年高二下学期期末考试化学试题
7 . 研发二氧化碳的碳捕捉和碳利用有着十分重要的现实意义。一定条件下能发生:CO2(g)+CH4(g) 2CO(g)+2H2(g) △H。
2CO(g)+2H2(g) △H。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802.3kJ•mol-1
C(s)+2H2O(g)=CO(g)+H2(g) △H2=+131.3kJ•mol-1
C(s)+O2(g)=CO2(g) △H3=-393.5kJ•mol-1
则上述反应体系的反应热△H=_______ kJ•mol-1。
(2)对于上述反应体系,下列说法正确的是_______ 。
(3)在恒容密闭容器中通入CH4与CO2,使其物质的量浓度均为1.0mol•L-1,测得CH4的平衡转化率与温度及压强的关系如图所示。

①压强p1、p2、p3、p4由小到大的关系为______ 。
②压强为p4时,在b点:v正_______ v逆(填“<”或“=”或“>”)。
③若p4=3MPa,则1100℃时,该反应的平衡常数Kp=______ (MPa)2。
(4)科学家利用电化学装置实现CH4和CO2两种分子的耦合转化来达到减碳的目的,其原理如图所示:

①电极B上的电极反应式为______ 。
②若生成乙烷和乙烯的物质的量之比为2:1,则消耗CH4和CO2的物质的量之比为______ 。
 2CO(g)+2H2(g) △H。
2CO(g)+2H2(g) △H。(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802.3kJ•mol-1
C(s)+2H2O(g)=CO(g)+H2(g) △H2=+131.3kJ•mol-1
C(s)+O2(g)=CO2(g) △H3=-393.5kJ•mol-1
则上述反应体系的反应热△H=
(2)对于上述反应体系,下列说法正确的是
| A.升高温度,正反应速率增大,逆反应速率也增大 |
| B.恒容密闭容器中,当气体密度不变时,反应达到平衡状态 |
| C.加入合适催化剂,可提滴CH4的平衡转化率 |
| D.v正(H2)=2v逆(CH4)时,反应体系处于平衡状态 |

①压强p1、p2、p3、p4由小到大的关系为
②压强为p4时,在b点:v正
③若p4=3MPa,则1100℃时,该反应的平衡常数Kp=
(4)科学家利用电化学装置实现CH4和CO2两种分子的耦合转化来达到减碳的目的,其原理如图所示:

①电极B上的电极反应式为
②若生成乙烷和乙烯的物质的量之比为2:1,则消耗CH4和CO2的物质的量之比为
您最近一年使用:0次
名校
8 . 氢气是一种清洁高效的新型能源,如何经济实用的制取氢气成为重要课题。
I.氨气中氢含量高,是一种优质的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气:方法一:氨热分解法制氢气。
相关化学键的键能数据
(1)反应

______ kJ/mol
(2)已知反应的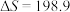 J∙mol-1∙K-1,在下列哪些温度下,反应能自发进行?_______(填标号)
J∙mol-1∙K-1,在下列哪些温度下,反应能自发进行?_______(填标号)
(3)298 K时,1 g H2燃烧生成 放热121 kJ,1 mol
放热121 kJ,1 mol  蒸发吸热44 kJ,表示
蒸发吸热44 kJ,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为____________________ 。
方法二:氨电解法制氢气。
利用电解原理,将氨转化为高纯氢气,其装置如图所示:
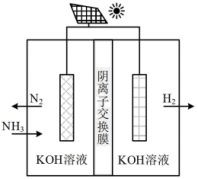
(4)电解过程中 的移动方向为
的移动方向为______ (填“从左往右”或“从右往左)
(5)阳极的电极反应式为__________________ 。
Ⅱ. 可用于高效制取氢气,发生的反应为
可用于高效制取氢气,发生的反应为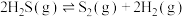 。
。
若起始时容器中只有 ,平衡时三种物质的物质的量与裂解温度的关系如图。
,平衡时三种物质的物质的量与裂解温度的关系如图。
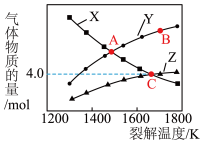
(6)图中曲线Z表示的物质是______ (填化学式)。
(7)C点时 的转化率为
的转化率为______ %(保留一位小数)。
(8)A点时,设容器内的总压为p Pa,则平衡常数
______ Pa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
I.氨气中氢含量高,是一种优质的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气:方法一:氨热分解法制氢气。
相关化学键的键能数据
| 化学键 |  |  |  |
| 键能E/(KJ/mol) | 946 | 436 | 391 |


(2)已知反应的
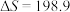 J∙mol-1∙K-1,在下列哪些温度下,反应能自发进行?_______(填标号)
J∙mol-1∙K-1,在下列哪些温度下,反应能自发进行?_______(填标号)| A.25℃ | B.125℃ | C.225℃ | D.325℃ |
 放热121 kJ,1 mol
放热121 kJ,1 mol  蒸发吸热44 kJ,表示
蒸发吸热44 kJ,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为方法二:氨电解法制氢气。
利用电解原理,将氨转化为高纯氢气,其装置如图所示:

(4)电解过程中
 的移动方向为
的移动方向为(5)阳极的电极反应式为
Ⅱ.
 可用于高效制取氢气,发生的反应为
可用于高效制取氢气,发生的反应为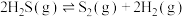 。
。若起始时容器中只有
 ,平衡时三种物质的物质的量与裂解温度的关系如图。
,平衡时三种物质的物质的量与裂解温度的关系如图。
(6)图中曲线Z表示的物质是
(7)C点时
 的转化率为
的转化率为(8)A点时,设容器内的总压为p Pa,则平衡常数

您最近一年使用:0次
9 . 利用1-甲基萗(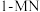 )制备四氢萘类物质(
)制备四氢萘类物质( ,包括
,包括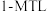 和
和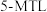 )。反应过程中伴有生成十氢萘
)。反应过程中伴有生成十氢萘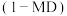 的副反应,涉及反应如图:
的副反应,涉及反应如图:

(1)已知一定条件下反应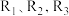 的焓变分别为
的焓变分别为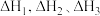 ,则反应
,则反应 的焓变为
的焓变为___________ (用含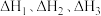 的代数式表示)。
的代数式表示)。
(2)四个平衡体系的平衡常数与温度的关系如图甲所示。
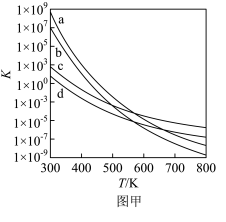
①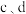 分别为反应
分别为反应 和
和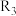 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应 的平衡常数随温度变化曲线为
的平衡常数随温度变化曲线为___________ 。
②已知反应 的速率方程
的速率方程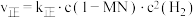 ,
,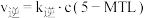 (
( 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关)。温度
分别为正、逆反应速率常数,只与温度、催化剂有关)。温度 下反应达到平衡时
下反应达到平衡时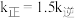 ,温度
,温度 下反应达到平衡时
下反应达到平衡时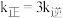 。由此推知,
。由此推知,
___________  (填“>”,“<”或“=”)。
(填“>”,“<”或“=”)。
③下列说法不正确的是___________ 。
A.四个反应均为放热反应
B.压强越大,温度越低越有利于生成四氢萘类物质
C.反应体系中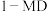 最稳定
最稳定
D.由上述信息可知,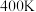 时反应
时反应 速率最快
速率最快
(3)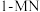 在
在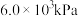 的高压
的高压 氛围下反应(
氛围下反应( 压强近似等于总压)。不同温度下达平衡时各产物的选择性
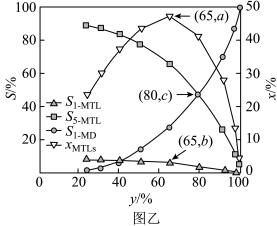
压强近似等于总压)。不同温度下达平衡时各产物的选择性 (某生成物
(某生成物 的物质的量与消耗
的物质的量与消耗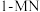 的物质的量之比)和物质的量分数
的物质的量之比)和物质的量分数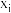 (
(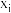 表示物种
表示物种 与除
与除 外其他各物种总物质的量之比)随
外其他各物种总物质的量之比)随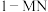 平衡转化率
平衡转化率 的变化关系如图乙所示,
的变化关系如图乙所示,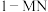 平衡转化率
平衡转化率 为
为 时,
时,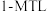 的产率=
的产率=___________ ;y为 时反应
时反应 的平衡常数
的平衡常数
___________  。
。
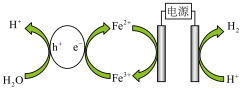
(4)一种以水为原料制氢的原理示意图如下,氢气在阴极生成。催化剂在太阳能的作用下产生电子 和空穴
和空穴 ,电子和空穴分别与
,电子和空穴分别与 和
和 发生反应。用离子方程式表示氧气的产生原理
发生反应。用离子方程式表示氧气的产生原理___________ 。
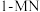 )制备四氢萘类物质(
)制备四氢萘类物质( ,包括
,包括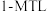 和
和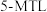 )。反应过程中伴有生成十氢萘
)。反应过程中伴有生成十氢萘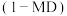 的副反应,涉及反应如图:
的副反应,涉及反应如图:
(1)已知一定条件下反应
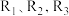 的焓变分别为
的焓变分别为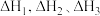 ,则反应
,则反应 的焓变为
的焓变为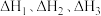 的代数式表示)。
的代数式表示)。(2)四个平衡体系的平衡常数与温度的关系如图甲所示。

①
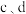 分别为反应
分别为反应 和
和 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应 的平衡常数随温度变化曲线为
的平衡常数随温度变化曲线为②已知反应
 的速率方程
的速率方程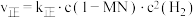 ,
,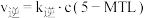 (
( 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关)。温度
分别为正、逆反应速率常数,只与温度、催化剂有关)。温度 下反应达到平衡时
下反应达到平衡时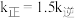 ,温度
,温度 下反应达到平衡时
下反应达到平衡时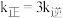 。由此推知,
。由此推知,
 (填“>”,“<”或“=”)。
(填“>”,“<”或“=”)。③下列说法不正确的是
A.四个反应均为放热反应
B.压强越大,温度越低越有利于生成四氢萘类物质
C.反应体系中
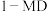 最稳定
最稳定D.由上述信息可知,
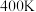 时反应
时反应 速率最快
速率最快(3)
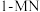 在
在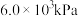 的高压
的高压 氛围下反应(
氛围下反应( 压强近似等于总压)。不同温度下达平衡时各产物的选择性
压强近似等于总压)。不同温度下达平衡时各产物的选择性 (某生成物
(某生成物 的物质的量与消耗
的物质的量与消耗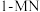 的物质的量之比)和物质的量分数
的物质的量之比)和物质的量分数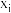 (
(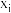 表示物种
表示物种 与除
与除 外其他各物种总物质的量之比)随
外其他各物种总物质的量之比)随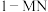 平衡转化率
平衡转化率 的变化关系如图乙所示,
的变化关系如图乙所示,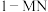 平衡转化率
平衡转化率 为
为 时,
时,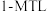 的产率=
的产率= 时反应
时反应 的平衡常数
的平衡常数
 。
。
(4)一种以水为原料制氢的原理示意图如下,氢气在阴极生成。催化剂在太阳能的作用下产生电子
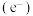 和空穴
和空穴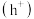 ,电子和空穴分别与
,电子和空穴分别与 和
和 发生反应。用离子方程式表示氧气的产生原理
发生反应。用离子方程式表示氧气的产生原理
您最近一年使用:0次
2023-05-30更新
|
262次组卷
|
2卷引用:广东省广州大学附属中学2023-2024学年高三上学期期末化学试题
10 . 实验是化学研究的重要手段,定性与定量是实验研究的两个不同角度。
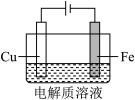
(1)为了比较Fe、Co、Cu三种金属的活动性,某实验小组设计如图实验装置。

①甲装置中Co电极附近产生气泡,Co电极的电极反应式为___________ 。
②丙装置中X电极附近溶液先变红,X电极名称为___________ 极,反应一段时间后,可制得NaClO消毒液,丙装置中的总化学反应方程式为___________ 。
③三种金属的活动性由强到弱的顺序是___________ 。
(2)为了测定市售白醋的总酸量(g/100mL),某实验小组设计如下实验流程。

①“量取白醋样品10.00mL”用到的量取仪器是___________ ,“配制100mL待测白醋溶液”用到的仪器有烧杯、玻璃棒和___________ 。
②用0.1mol/L的NaOH标准液进行“酸碱中和滴定”,实验记录如下
该市售白醋总酸量=___________ g/100mL。
③“酸碱中和滴定”过程中,下列操作会使实验结果偏大的是___________ 。
A.未用标准NaOH溶液润洗滴定管
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加入少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
(1)为了比较Fe、Co、Cu三种金属的活动性,某实验小组设计如图实验装置。

①甲装置中Co电极附近产生气泡,Co电极的电极反应式为
②丙装置中X电极附近溶液先变红,X电极名称为
③三种金属的活动性由强到弱的顺序是
(2)为了测定市售白醋的总酸量(g/100mL),某实验小组设计如下实验流程。

①“量取白醋样品10.00mL”用到的量取仪器是
②用0.1mol/L的NaOH标准液进行“酸碱中和滴定”,实验记录如下
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(待测白醋)mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗)mL | 15.95 | 15.00 | 15.05 | 14.95 |
③“酸碱中和滴定”过程中,下列操作会使实验结果偏大的是
A.未用标准NaOH溶液润洗滴定管
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加入少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
您最近一年使用:0次



