名校
1 . 废旧锌锰电池中的黑锰粉含有MnO2、MnO(OH)、NH4Cl和少量ZnCl2、Fe2O3及炭黑等,为了保护环境、充分利用锰资源,通过如下流程制备MnSO4。
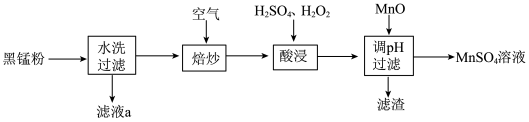
(1)Mn2+的价电子排布式为_______ 。
(2)“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为_______ 。
(3)探究“酸浸”中MnO2溶解的适宜操作。
实验I.向MnO2中加入H2O2溶液,产生大量气泡:再加入稀H2SO4,固体未明显溶解。
实验Ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是_______ ,实验Ⅱ中发生反应的离子方程式为_______ 。
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是_______ 。
(4)最近科学家研制出超薄铁磁β-MnSe半导体,β-MnSe的晶胞结构如图所示。β-MnSe中Mn的配位数为_______ 。

(5)MnSO4可通过反应制得Mn3O4,在加热烘干Mn3O4过程中常常混有Mn2O3杂质,现对样品中Mn3O4的含量进行测定。取Mn3O4样品22.19g加入足量浓盐酸并加热,得到标准状况下2.24L氯气。(Mn3O4和Mn2O3在加热时均能和浓盐酸反应生成MnCl2)计算样品中Mn2O3的质量分数为_______ 。(写出计算过程)

(1)Mn2+的价电子排布式为
(2)“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为
(3)探究“酸浸”中MnO2溶解的适宜操作。
实验I.向MnO2中加入H2O2溶液,产生大量气泡:再加入稀H2SO4,固体未明显溶解。
实验Ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是
(4)最近科学家研制出超薄铁磁β-MnSe半导体,β-MnSe的晶胞结构如图所示。β-MnSe中Mn的配位数为

(5)MnSO4可通过反应制得Mn3O4,在加热烘干Mn3O4过程中常常混有Mn2O3杂质,现对样品中Mn3O4的含量进行测定。取Mn3O4样品22.19g加入足量浓盐酸并加热,得到标准状况下2.24L氯气。(Mn3O4和Mn2O3在加热时均能和浓盐酸反应生成MnCl2)计算样品中Mn2O3的质量分数为
您最近一年使用:0次
解题方法
2 . 回收再利用金属冶炼厂的酸性废水(主要含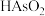 、
、 、
、 、
、 、
、 ),制备亚砷酸铜
),制备亚砷酸铜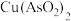 的流程如下。
的流程如下。
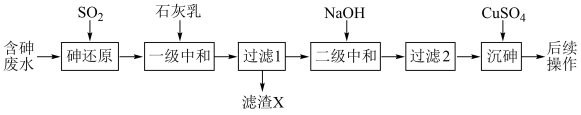
(1)基态砷原子的电子排布式为_______ 。
(2)砷的还原。常温下,五价砷溶液中各种微粒的物质的量分数随pH的变化曲线如图所示。向酸性废水中通入 ,能把五价砷转化为三价砷。
,能把五价砷转化为三价砷。
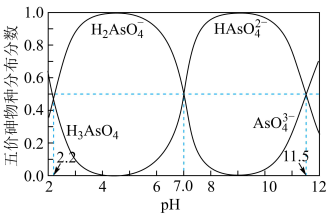
① 的二级电离平衡常数
的二级电离平衡常数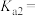
_______ 。
②pH为1时“还原”的主要反应的离子方程式为_______ 。
(3)中和除杂。当溶液中离子浓度小于 ,可认为已经完全除去。
,可认为已经完全除去。
已知: 在
在 时开始转化为
时开始转化为 ,
,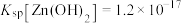 ,
, ,
, 。
。
①一级中和控制pH为2左右,滤渣X的主要成分有_______ 。
②二级中和沉淀重金属离子应控制pH范围为_______ 。
(4)应用碘量法可测定亚砷酸铜中的铜含量。称取2.000g试样溶于稀 搅拌后过滤,洗涤滤渣,将洗涤后的滤液与原滤液合并,配成
搅拌后过滤,洗涤滤渣,将洗涤后的滤液与原滤液合并,配成 溶液,取
溶液,取 所配溶液于碘量瓶中加入过量的碘化钾溶液,用
所配溶液于碘量瓶中加入过量的碘化钾溶液,用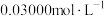
 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 。
。
①计算样品中铜元素的质量分数_______ 。(写出计算过程)
②已知纯亚砷酸铜中铜元素的质量分数为23.02%,实际测得样品中铜元素的质量分数有偏差(操作步骤均正确)的原因为_______ 。(已知: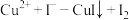 ;
;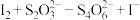 ,未配平)
,未配平)
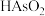 、
、 、
、 、
、 、
、 ),制备亚砷酸铜
),制备亚砷酸铜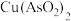 的流程如下。
的流程如下。
(1)基态砷原子的电子排布式为
(2)砷的还原。常温下,五价砷溶液中各种微粒的物质的量分数随pH的变化曲线如图所示。向酸性废水中通入
 ,能把五价砷转化为三价砷。
,能把五价砷转化为三价砷。
①
 的二级电离平衡常数
的二级电离平衡常数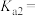
②pH为1时“还原”的主要反应的离子方程式为
(3)中和除杂。当溶液中离子浓度小于
 ,可认为已经完全除去。
,可认为已经完全除去。已知:
 在
在 时开始转化为
时开始转化为 ,
,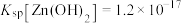 ,
, ,
, 。
。①一级中和控制pH为2左右,滤渣X的主要成分有
②二级中和沉淀重金属离子应控制pH范围为
(4)应用碘量法可测定亚砷酸铜中的铜含量。称取2.000g试样溶于稀
 搅拌后过滤,洗涤滤渣,将洗涤后的滤液与原滤液合并,配成
搅拌后过滤,洗涤滤渣,将洗涤后的滤液与原滤液合并,配成 溶液,取
溶液,取 所配溶液于碘量瓶中加入过量的碘化钾溶液,用
所配溶液于碘量瓶中加入过量的碘化钾溶液,用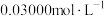
 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 。
。①计算样品中铜元素的质量分数
②已知纯亚砷酸铜中铜元素的质量分数为23.02%,实际测得样品中铜元素的质量分数有偏差(操作步骤均正确)的原因为
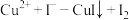 ;
;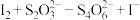 ,未配平)
,未配平)
您最近一年使用:0次
解题方法
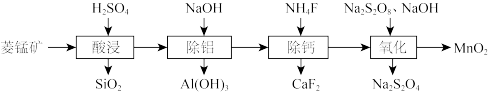
3 . 一种以低品位菱锰矿(含 和少量钙、铝的碳酸盐及
和少量钙、铝的碳酸盐及 等)为主要原料制备
等)为主要原料制备 的流程如下。
的流程如下。
(1)基态 核外电子排布式为
核外电子排布式为_______ 。
(2)已知常温下: ,
, ,取“除钙”后得到的
,取“除钙”后得到的
 ,向其中加入
,向其中加入
 ,再加入
,再加入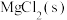 充分搅拌至
充分搅拌至 完全转化,至少需要加入
完全转化,至少需要加入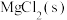 的物质的量为
的物质的量为_______ mol(溶液体积变化忽略不计)。
(3)常温下, 在含
在含 的水溶液中会产生具有强氧化性的自由基·
的水溶液中会产生具有强氧化性的自由基· 。
。
①写出“氧化”时· 与
与 的发生反应的离子方程式:
的发生反应的离子方程式:_______ 。
②当 和
和 的用量一定时,
的用量一定时, 的产率随温度的变化如图所示,相同时间内,50℃下
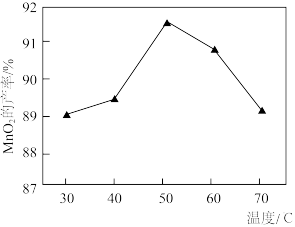
的产率随温度的变化如图所示,相同时间内,50℃下 的产率高于40℃和60℃时的产率,原因分别是
的产率高于40℃和60℃时的产率,原因分别是_______ 。
(4) 含量测定:称取
含量测定:称取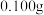
 样品,加入
样品,加入
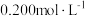 的
的 溶液和适量
溶液和适量 溶液,加热使
溶液,加热使 充分转化为
充分转化为 溶液。冷却后,向溶液中加入
溶液。冷却后,向溶液中加入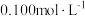 的
的 溶液滴定过量
溶液滴定过量 ,消耗
,消耗 溶液
溶液 。计算样品中
。计算样品中 的质量分数。
的质量分数。______ (写出计算过程),已知: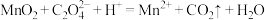 ;
;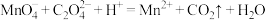 。(方程式均未配平)
。(方程式均未配平)
 和少量钙、铝的碳酸盐及
和少量钙、铝的碳酸盐及 等)为主要原料制备
等)为主要原料制备 的流程如下。
的流程如下。
(1)基态
 核外电子排布式为
核外电子排布式为(2)已知常温下:
 ,
, ,取“除钙”后得到的
,取“除钙”后得到的
 ,向其中加入
,向其中加入
 ,再加入
,再加入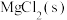 充分搅拌至
充分搅拌至 完全转化,至少需要加入
完全转化,至少需要加入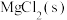 的物质的量为
的物质的量为(3)常温下,
 在含
在含 的水溶液中会产生具有强氧化性的自由基·
的水溶液中会产生具有强氧化性的自由基· 。
。①写出“氧化”时·
 与
与 的发生反应的离子方程式:
的发生反应的离子方程式:②当
 和
和 的用量一定时,
的用量一定时, 的产率随温度的变化如图所示,相同时间内,50℃下
的产率随温度的变化如图所示,相同时间内,50℃下 的产率高于40℃和60℃时的产率,原因分别是
的产率高于40℃和60℃时的产率,原因分别是
(4)
 含量测定:称取
含量测定:称取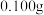
 样品,加入
样品,加入
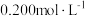 的
的 溶液和适量
溶液和适量 溶液,加热使
溶液,加热使 充分转化为
充分转化为 溶液。冷却后,向溶液中加入
溶液。冷却后,向溶液中加入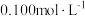 的
的 溶液滴定过量
溶液滴定过量 ,消耗
,消耗 溶液
溶液 。计算样品中
。计算样品中 的质量分数。
的质量分数。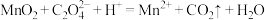 ;
;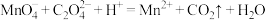 。(方程式均未配平)
。(方程式均未配平)
您最近一年使用:0次
名校
解题方法
4 . 柠檬酸亚铁(FeC6H6O7)是一种易被人体吸收的高效铁制剂,医疗上可以用来治疗缺铁性贫血。某课题组以硫铁矿烧渣(含Fe2O3、SiO2、少量Al2O3等)为原料,先制备碳酸亚铁,再与柠檬酸反应可以制得柠檬酸亚铁。其工艺流程如下:

已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
(1)基态Fe2+的核外电子排布式为_______ 。
(2)“浸泡”时加入过量硫酸的目的:_______ 。
(3)“除杂”时有同学提出下列两种途径,请选择较合理的途径并说明理由_______ 。
途径一:
途径二:
(4)“制备FeCO3”时,Na2CO3溶液的浓度对沉淀中铁元素的质量分数以及FeCO3产率的影响如图:
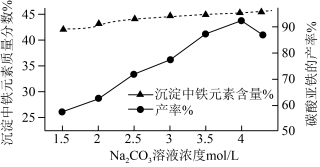
Na2CO3溶液的浓度大于4mol/L时,FeCO3的产率有所下降,而沉淀中铁元素质量分数仍在上升的原因是_______ 。
(5)已知柠檬酸亚铁易被氧化,能溶于水,不溶于乙醇。设计试验方案,从“除杂”后的FeSO4溶液制备柠檬酸亚铁晶体:_______ ,静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。(必须用到的试剂有:Fe粉、4mol/LNa2CO3溶液、柠檬酸溶液、无水乙醇)
(6)产品纯度的测定。产品中铁的含量用 EDTA 配位滴定法测定:称取0.4000g产品中加入足量H2O2溶液和适量的稀H2SO4,充分反应后再用0.0600mol·L-1EDTA溶液滴定至终点(其他离子对滴定过程无干扰),消耗EDTA溶液的体积为20.00mL(已知:EDTA与Fe3+的滴定比例为1:1,柠檬酸亚铁的摩尔质量为246g/mol)。计算产品的纯度为_______ 。
(7)上述滴定过程中,导致测定结果偏大的是_______ 。
a.滴定前,盛装EDTA的酸式滴定管未润洗
b.滴定时,酸式滴定管中开始有气泡,后来无气泡
c.滴定开始时平视,滴定结束时俯视

已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
金属离子 | 沉淀开始pH | 沉淀完全pH |
Al3+ | 3.1 | 5.1 |
Fe2+ | 5.9 | 6.9 |
Fe3+ | 1.2 | 3.2 |
(1)基态Fe2+的核外电子排布式为
(2)“浸泡”时加入过量硫酸的目的:
(3)“除杂”时有同学提出下列两种途径,请选择较合理的途径并说明理由
途径一:

途径二:

(4)“制备FeCO3”时,Na2CO3溶液的浓度对沉淀中铁元素的质量分数以及FeCO3产率的影响如图:

Na2CO3溶液的浓度大于4mol/L时,FeCO3的产率有所下降,而沉淀中铁元素质量分数仍在上升的原因是
(5)已知柠檬酸亚铁易被氧化,能溶于水,不溶于乙醇。设计试验方案,从“除杂”后的FeSO4溶液制备柠檬酸亚铁晶体:
(6)产品纯度的测定。产品中铁的含量用 EDTA 配位滴定法测定:称取0.4000g产品中加入足量H2O2溶液和适量的稀H2SO4,充分反应后再用0.0600mol·L-1EDTA溶液滴定至终点(其他离子对滴定过程无干扰),消耗EDTA溶液的体积为20.00mL(已知:EDTA与Fe3+的滴定比例为1:1,柠檬酸亚铁的摩尔质量为246g/mol)。计算产品的纯度为
(7)上述滴定过程中,导致测定结果偏大的是
a.滴定前,盛装EDTA的酸式滴定管未润洗
b.滴定时,酸式滴定管中开始有气泡,后来无气泡
c.滴定开始时平视,滴定结束时俯视
您最近一年使用:0次
解题方法
5 . 利用黄铁矿(主要成分为 )与软锰矿(主要成分为
)与软锰矿(主要成分为 )制备
)制备 并回收单质硫的部分工艺流程如下:
并回收单质硫的部分工艺流程如下:
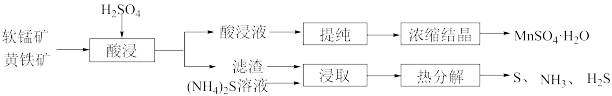
已知:酸浸液主要含有 、
、 、
、 等金属阳离子。
等金属阳离子。
(1)当温度为90℃时,酸浸过程中硫酸浓度c对Mn浸取率的影响如图1所示。

①基态 的价电子排布式为
的价电子排布式为___________ 。
②酸浸时反应生成 和S的离子方程式为
和S的离子方程式为___________ 。
③100min后,Mn浸取率随硫酸浓度增大而呈下降趋势,可能的原因是___________ 。
④酸浸液中还含有 等重金属阳离子,请结合数据说明能否用MnS除去
等重金属阳离子,请结合数据说明能否用MnS除去
___________ 。[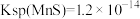 ,
,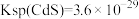 ]
]
(2) 溶液浸取滤渣时的反应为
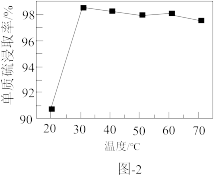
溶液浸取滤渣时的反应为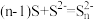 ,单质硫浸取率随温度变化曲线如图2所示。温度高于30℃,单质硫浸取率下降的可能原因是
,单质硫浸取率随温度变化曲线如图2所示。温度高于30℃,单质硫浸取率下降的可能原因是___________ 。
(3)制备得到的 产品中含有少量
产品中含有少量 和
和 杂质,进行以下实验测定产品中
杂质,进行以下实验测定产品中 含量:取10.00g产品溶于水,配成100mL溶液;取10.00mL所配溶液用
含量:取10.00g产品溶于水,配成100mL溶液;取10.00mL所配溶液用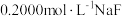 溶液滴定,消耗10.00mL;另取10.00mL所配溶液用
溶液滴定,消耗10.00mL;另取10.00mL所配溶液用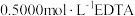 溶液滴定,消耗13.00mL。(已知:
溶液滴定,消耗13.00mL。(已知: 和
和 难溶于水;
难溶于水; 、
、 和
和 与EDTA按物质的量之比1∶1反应。),计算产品中
与EDTA按物质的量之比1∶1反应。),计算产品中 的质量分数
的质量分数___________ 。(写出计算过程)
 )与软锰矿(主要成分为
)与软锰矿(主要成分为 )制备
)制备 并回收单质硫的部分工艺流程如下:
并回收单质硫的部分工艺流程如下:
已知:酸浸液主要含有
 、
、 、
、 等金属阳离子。
等金属阳离子。(1)当温度为90℃时,酸浸过程中硫酸浓度c对Mn浸取率的影响如图1所示。

①基态
 的价电子排布式为
的价电子排布式为②酸浸时反应生成
 和S的离子方程式为
和S的离子方程式为③100min后,Mn浸取率随硫酸浓度增大而呈下降趋势,可能的原因是
④酸浸液中还含有
 等重金属阳离子,请结合数据说明能否用MnS除去
等重金属阳离子,请结合数据说明能否用MnS除去
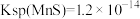 ,
,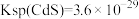 ]
](2)
 溶液浸取滤渣时的反应为
溶液浸取滤渣时的反应为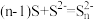 ,单质硫浸取率随温度变化曲线如图2所示。温度高于30℃,单质硫浸取率下降的可能原因是
,单质硫浸取率随温度变化曲线如图2所示。温度高于30℃,单质硫浸取率下降的可能原因是
(3)制备得到的
 产品中含有少量
产品中含有少量 和
和 杂质,进行以下实验测定产品中
杂质,进行以下实验测定产品中 含量:取10.00g产品溶于水,配成100mL溶液;取10.00mL所配溶液用
含量:取10.00g产品溶于水,配成100mL溶液;取10.00mL所配溶液用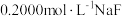 溶液滴定,消耗10.00mL;另取10.00mL所配溶液用
溶液滴定,消耗10.00mL;另取10.00mL所配溶液用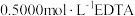 溶液滴定,消耗13.00mL。(已知:
溶液滴定,消耗13.00mL。(已知: 和
和 难溶于水;
难溶于水; 、
、 和
和 与EDTA按物质的量之比1∶1反应。),计算产品中
与EDTA按物质的量之比1∶1反应。),计算产品中 的质量分数
的质量分数
您最近一年使用:0次
6 . 以含钛高炉渣(含 及少量
及少量 )和硫酸铵为原料制备钛白粉(主要成分
)和硫酸铵为原料制备钛白粉(主要成分 ),其流程可表示为:
),其流程可表示为:

已知: 只存在于强酸性溶液中,酸性减弱时易转化为
只存在于强酸性溶液中,酸性减弱时易转化为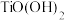 沉淀.
沉淀.
(1) 基态核外电子排布式为
基态核外电子排布式为______________ .
(2)“熔融”时,硫酸铵将 转化为
转化为 ,同时有气体生成.该气体的化学式为
,同时有气体生成.该气体的化学式为______________ .
(3)“水解”得到的滤渣 ,用氧化物的形式表示为
,用氧化物的形式表示为______________ .
(4)“沉淀”时, 与氨水反应的离子方程式是
与氨水反应的离子方程式是______________ .
(5)测定所得钛白粉样品的纯度,步骤如下:
步骤1:称取 样品,经熔融、溶解、还原等操作,将
样品,经熔融、溶解、还原等操作,将 完全转化为
完全转化为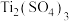 溶液.
溶液.
步骤2:将步骤1所得溶液冷却至室温,加入1~2滴 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定至终点,消耗该溶液
标准溶液滴定至终点,消耗该溶液 ,发生的反应为
,发生的反应为 ;
;
①滴定终点时的现象是______________ .
②计算样品中 的质量分数
的质量分数______________ (写出计算过程)
 及少量
及少量 )和硫酸铵为原料制备钛白粉(主要成分
)和硫酸铵为原料制备钛白粉(主要成分 ),其流程可表示为:
),其流程可表示为:
已知:
 只存在于强酸性溶液中,酸性减弱时易转化为
只存在于强酸性溶液中,酸性减弱时易转化为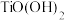 沉淀.
沉淀.(1)
 基态核外电子排布式为
基态核外电子排布式为(2)“熔融”时,硫酸铵将
 转化为
转化为 ,同时有气体生成.该气体的化学式为
,同时有气体生成.该气体的化学式为(3)“水解”得到的滤渣
 ,用氧化物的形式表示为
,用氧化物的形式表示为(4)“沉淀”时,
 与氨水反应的离子方程式是
与氨水反应的离子方程式是(5)测定所得钛白粉样品的纯度,步骤如下:
步骤1:称取
 样品,经熔融、溶解、还原等操作,将
样品,经熔融、溶解、还原等操作,将 完全转化为
完全转化为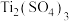 溶液.
溶液.步骤2:将步骤1所得溶液冷却至室温,加入1~2滴
 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定至终点,消耗该溶液
标准溶液滴定至终点,消耗该溶液 ,发生的反应为
,发生的反应为 ;
;①滴定终点时的现象是
②计算样品中
 的质量分数
的质量分数
您最近一年使用:0次
名校
7 . 钴及其化合物在工业生产中有广阔的应用前景。已知:Co2+不易被氧化,Co3+具有强氧化性,[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。
(1)从锂钴废料(主要成分为LiCoO2)分离Co2+。
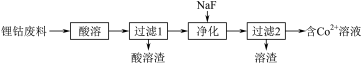
① 的电子排布式为
的电子排布式为______ 。
②“酸溶”时不选择浓 的理由是:
的理由是:______ 。
③“净化”时,加 固体是将
固体是将 转化为沉淀,“净化”后溶液中
转化为沉淀,“净化”后溶液中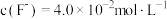 ,若“过滤1”后溶液中
,若“过滤1”后溶液中 浓度为1.0
浓度为1.0 ,则“净化”后c(Na+)=
,则“净化”后c(Na+)=_____ 。[溶液体积变化忽略不计,不考虑其他离子影响。25℃时Ksp(LiF)= 2.0×10-3]
(2)从由CoCl2制备[Co(NH3)6]Cl3。
实验过程:称取研细的 10.0g和NH4Cl50g于烧杯中溶解,将溶液转入三颈烧瓶,分液漏斗中分别装有25
10.0g和NH4Cl50g于烧杯中溶解,将溶液转入三颈烧瓶,分液漏斗中分别装有25 浓氨水,5
浓氨水,5 30%的H2O2溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得[Co(NH3)6]Cl3溶液,实验装置如图所示:
30%的H2O2溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得[Co(NH3)6]Cl3溶液,实验装置如图所示:

①由 制备[Co(NH3)6]Cl3溶液的离子方程式为
制备[Co(NH3)6]Cl3溶液的离子方程式为________ 。
②分液漏斗中液体加入三颈烧瓶中的顺序为_______ 。
(3)用CoSO4溶液为原料“沉钴”时,可先制得CoCO3再制备Co3O4.CoCO3在空气中受热分解,测得剩余固体的质量与起始CoCO3的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。
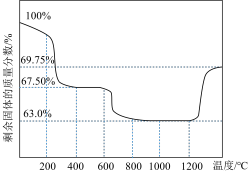
为获得较高产率的Co3O4,请补充实验方案:取CoSO4溶液_______ 。(可选用的试剂:0.1 mol/L NH4HCO3溶液、空气、0.1 mol/L HCl溶液、0.1 mol/L BaCl2溶液)。
(1)从锂钴废料(主要成分为LiCoO2)分离Co2+。

①
 的电子排布式为
的电子排布式为②“酸溶”时不选择浓
 的理由是:
的理由是:③“净化”时,加
 固体是将
固体是将 转化为沉淀,“净化”后溶液中
转化为沉淀,“净化”后溶液中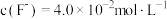 ,若“过滤1”后溶液中
,若“过滤1”后溶液中 浓度为1.0
浓度为1.0 ,则“净化”后c(Na+)=
,则“净化”后c(Na+)=(2)从由CoCl2制备[Co(NH3)6]Cl3。
实验过程:称取研细的
 10.0g和NH4Cl50g于烧杯中溶解,将溶液转入三颈烧瓶,分液漏斗中分别装有25
10.0g和NH4Cl50g于烧杯中溶解,将溶液转入三颈烧瓶,分液漏斗中分别装有25 浓氨水,5
浓氨水,5 30%的H2O2溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得[Co(NH3)6]Cl3溶液,实验装置如图所示:
30%的H2O2溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得[Co(NH3)6]Cl3溶液,实验装置如图所示:
①由
 制备[Co(NH3)6]Cl3溶液的离子方程式为
制备[Co(NH3)6]Cl3溶液的离子方程式为②分液漏斗中液体加入三颈烧瓶中的顺序为
(3)用CoSO4溶液为原料“沉钴”时,可先制得CoCO3再制备Co3O4.CoCO3在空气中受热分解,测得剩余固体的质量与起始CoCO3的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。

为获得较高产率的Co3O4,请补充实验方案:取CoSO4溶液
您最近一年使用:0次
名校
解题方法
8 . 三氯化铬( )在工业上主要用作媒染剂和催化剂,
)在工业上主要用作媒染剂和催化剂, 常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以BaCrO4为原料制备
常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以BaCrO4为原料制备 和
和 。
。
(1)三价铬离子能形成多种配位化合物,配合物[Cr(NH3)3(H2O)2Cl]2+中元素电负性由大到小的顺序___________ 。
(2)制备 。取一定质量的BaCrO4和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成
。取一定质量的BaCrO4和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成 并放出
并放出 气体。
气体。
①上述反应的化学方程式为___________ 。
②上述反应中的乙醇与BaCrO4投料的物质的量比例大约为3:8,原因是___________ 。
(3)测定 的质量分数。
的质量分数。
Ⅰ.称取样品0.3300g,加水溶解并配成250.0mL的溶液。
Ⅱ.移取25.00mL样品溶液于带塞的锥形瓶中,加热至沸后加入稍过量的 ,稀释并加热煮沸,再加入过量的硫酸酸化,将
,稀释并加热煮沸,再加入过量的硫酸酸化,将 氧化为
氧化为 ;再加入过量KI固体加塞摇匀,使铬完全以
;再加入过量KI固体加塞摇匀,使铬完全以 的形式存在。
的形式存在。
Ⅲ.加入1mL淀粉溶液,用0.0250 标准
标准 溶液滴定至终点,平行测定3次,平均消耗标准
溶液滴定至终点,平行测定3次,平均消耗标准 溶液24.00mL。
溶液24.00mL。
已知反应: (未配平) ;
(未配平) ; (未配平)
(未配平)
①滴定终点的现象是___________ 。
②计算 的质量分数(写出计算过程)
的质量分数(写出计算过程)___________ 。
(4)制备 。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。
。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。

请补充完整由 溶液制备
溶液制备 的实验方案:取适量
的实验方案:取适量 溶液,
溶液,___________ ,低温烘干,得到 晶体(实验中须使用的试剂:1
晶体(实验中须使用的试剂:1 NaOH溶液、0.1
NaOH溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、蒸馏水)。
溶液、蒸馏水)。
 )在工业上主要用作媒染剂和催化剂,
)在工业上主要用作媒染剂和催化剂, 常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以BaCrO4为原料制备
常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以BaCrO4为原料制备 和
和 。
。(1)三价铬离子能形成多种配位化合物,配合物[Cr(NH3)3(H2O)2Cl]2+中元素电负性由大到小的顺序
(2)制备
 。取一定质量的BaCrO4和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成
。取一定质量的BaCrO4和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成 并放出
并放出 气体。
气体。①上述反应的化学方程式为
②上述反应中的乙醇与BaCrO4投料的物质的量比例大约为3:8,原因是
(3)测定
 的质量分数。
的质量分数。Ⅰ.称取样品0.3300g,加水溶解并配成250.0mL的溶液。
Ⅱ.移取25.00mL样品溶液于带塞的锥形瓶中,加热至沸后加入稍过量的
 ,稀释并加热煮沸,再加入过量的硫酸酸化,将
,稀释并加热煮沸,再加入过量的硫酸酸化,将 氧化为
氧化为 ;再加入过量KI固体加塞摇匀,使铬完全以
;再加入过量KI固体加塞摇匀,使铬完全以 的形式存在。
的形式存在。Ⅲ.加入1mL淀粉溶液,用0.0250
 标准
标准 溶液滴定至终点,平行测定3次,平均消耗标准
溶液滴定至终点,平行测定3次,平均消耗标准 溶液24.00mL。
溶液24.00mL。已知反应:
 (未配平) ;
(未配平) ; (未配平)
(未配平)①滴定终点的现象是
②计算
 的质量分数(写出计算过程)
的质量分数(写出计算过程)(4)制备
 。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。
。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。
请补充完整由
 溶液制备
溶液制备 的实验方案:取适量
的实验方案:取适量 溶液,
溶液, 晶体(实验中须使用的试剂:1
晶体(实验中须使用的试剂:1 NaOH溶液、0.1
NaOH溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、蒸馏水)。
溶液、蒸馏水)。
您最近一年使用:0次
9 . 铁黄 可用作颜料。一种由钛铁矿浸出后的废液[主要含
可用作颜料。一种由钛铁矿浸出后的废液[主要含 和
和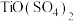 ]制取铁黄的过程如下:
]制取铁黄的过程如下:

已知:实验中 开始生成
开始生成 沉淀时
沉淀时 开始生成
开始生成 时
时 ,完全沉淀时
,完全沉淀时 。
。
(1) 的核外电子排布式为
的核外电子排布式为___________ 。
(2)“氧化”时的离子方程式为___________ 。
(3)测定样品中铁黄的质量分数。
称取铁黄样品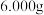 置于
置于 锥形瓶中,加入适量稀盐酸、加热,滴加稍过量的
锥形瓶中,加入适量稀盐酸、加热,滴加稍过量的 溶液(将
溶液(将 还原为
还原为 )充分反应,再除去过量的
)充分反应,再除去过量的 。移取
。移取 溶液于锥形瓶中,用
溶液于锥形瓶中,用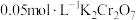 标准溶液滴定至终点(
标准溶液滴定至终点( 未配平),消耗
未配平),消耗 溶液
溶液 。计算该样品中铁黄的质量分数
。计算该样品中铁黄的质量分数___________ (写出计算过程)。
(4)铁和氨在640℃时可发生置换反应,一种产物的晶胞结构如图所示。

①该产物的化学式为___________ 。
②该晶胞中与铁原子最近且距离相等的铁原子个数为___________ 个。
 可用作颜料。一种由钛铁矿浸出后的废液[主要含
可用作颜料。一种由钛铁矿浸出后的废液[主要含 和
和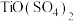 ]制取铁黄的过程如下:
]制取铁黄的过程如下:
已知:实验中
 开始生成
开始生成 沉淀时
沉淀时 开始生成
开始生成 时
时 ,完全沉淀时
,完全沉淀时 。
。(1)
 的核外电子排布式为
的核外电子排布式为(2)“氧化”时的离子方程式为
(3)测定样品中铁黄的质量分数。
称取铁黄样品
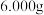 置于
置于 锥形瓶中,加入适量稀盐酸、加热,滴加稍过量的
锥形瓶中,加入适量稀盐酸、加热,滴加稍过量的 溶液(将
溶液(将 还原为
还原为 )充分反应,再除去过量的
)充分反应,再除去过量的 。移取
。移取 溶液于锥形瓶中,用
溶液于锥形瓶中,用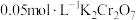 标准溶液滴定至终点(
标准溶液滴定至终点( 未配平),消耗
未配平),消耗 溶液
溶液 。计算该样品中铁黄的质量分数
。计算该样品中铁黄的质量分数(4)铁和氨在640℃时可发生置换反应,一种产物的晶胞结构如图所示。

①该产物的化学式为
②该晶胞中与铁原子最近且距离相等的铁原子个数为
您最近一年使用:0次
名校
10 . 三氯化铬( )在工业上主要用作媒染剂和催化剂,实验室模拟工业上以
)在工业上主要用作媒染剂和催化剂,实验室模拟工业上以 为原料制备
为原料制备 。
。
(1)制备 。取一定质量的
。取一定质量的 和对应量的水加入到三颈烧瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成
和对应量的水加入到三颈烧瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成 并放出
并放出 气体。
气体。
①Cr原子的外围电子排布式为___________ 。
②上述反应的化学方程式为___________ 。
③上述反应中的乙醇与投料的 物质的量比例大约为
物质的量比例大约为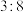 ,原因是
,原因是___________ 。
(2)测定 的质量分数。
的质量分数。
I.称取样品0.3300g,加水溶解并配成250.0mL的溶液。
II.移取25.00mL样品溶液于带塞的锥形瓶中,加热至沸后加入稍过量的 ,稀释并加热煮沸,再加入过量的硫酸酸化,将
,稀释并加热煮沸,再加入过量的硫酸酸化,将 氧化为
氧化为 ;再加入过量KI固体加塞摇匀,使铬元素完全以
;再加入过量KI固体加塞摇匀,使铬元素完全以 的形式存在。
的形式存在。
III.加入1mL淀粉溶液,用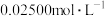 标准
标准 溶液滴定至终点,平行测定3次,平均消耗标准
溶液滴定至终点,平行测定3次,平均消耗标准 溶液24.00mL。
溶液24.00mL。
已知反应:
 (未配平)
(未配平)
 (未配平)
(未配平)
①滴定终点的现象是___________ 。
②计算 的质量分数(写出计算过程)
的质量分数(写出计算过程)___________ 。
 )在工业上主要用作媒染剂和催化剂,实验室模拟工业上以
)在工业上主要用作媒染剂和催化剂,实验室模拟工业上以 为原料制备
为原料制备 。
。(1)制备
 。取一定质量的
。取一定质量的 和对应量的水加入到三颈烧瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成
和对应量的水加入到三颈烧瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成 并放出
并放出 气体。
气体。①Cr原子的外围电子排布式为
②上述反应的化学方程式为
③上述反应中的乙醇与投料的
 物质的量比例大约为
物质的量比例大约为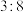 ,原因是
,原因是(2)测定
 的质量分数。
的质量分数。I.称取样品0.3300g,加水溶解并配成250.0mL的溶液。
II.移取25.00mL样品溶液于带塞的锥形瓶中,加热至沸后加入稍过量的
 ,稀释并加热煮沸,再加入过量的硫酸酸化,将
,稀释并加热煮沸,再加入过量的硫酸酸化,将 氧化为
氧化为 ;再加入过量KI固体加塞摇匀,使铬元素完全以
;再加入过量KI固体加塞摇匀,使铬元素完全以 的形式存在。
的形式存在。III.加入1mL淀粉溶液,用
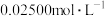 标准
标准 溶液滴定至终点,平行测定3次,平均消耗标准
溶液滴定至终点,平行测定3次,平均消耗标准 溶液24.00mL。
溶液24.00mL。已知反应:
 (未配平)
(未配平) (未配平)
(未配平)①滴定终点的现象是
②计算
 的质量分数(写出计算过程)
的质量分数(写出计算过程)
您最近一年使用:0次
2023-07-19更新
|
103次组卷
|
2卷引用:江苏省镇江第一中学2022-2023学年高二下学期学情检测调研(2)化学试题



