名校
解题方法
1 . 氮及其化合物在工农业生产和生命活动中起着重要的作用。回答下列问题:
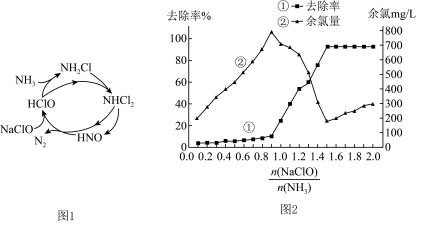
(1)“中国制造2025”是中国政府实施制造强国战略第一个十年行动纲领。氮化铬在现代工业中发挥更重要的作用,请写出
 的价电子轨道表示式
的价电子轨道表示式
_____ ;基态铬、氮原子的未成对电子数之比为
_____ 。
(2) 也是造成水体富营养化的重要原因之一,用
也是造成水体富营养化的重要原因之一,用
 溶液氧化可除去氨气。其反应机理如图1所示(其中
溶液氧化可除去氨气。其反应机理如图1所示(其中
 和
和
 略去)。
略去)。
 氧化
氧化
 的总反应化学方程式为
的总反应化学方程式为
_____ 。
(3)改变
 对溶液中
对溶液中
 去除氨气效果与余氯(溶液中+1价氯元素的含量)的影响如图2所示,则除氨气过程中最佳的
去除氨气效果与余氯(溶液中+1价氯元素的含量)的影响如图2所示,则除氨气过程中最佳的
 值约为
值约为
_____ 。
(4)室温下,用水稀释
 氨水,溶液中随着水量的增加而减小的是_____。
氨水,溶液中随着水量的增加而减小的是_____。
(5) 时,将
时,将
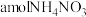 溶于水,向该溶液中滴加
溶于水,向该溶液中滴加
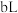 氨水后溶液呈中性,滴加氨水的过程中水的电离平衡将
氨水后溶液呈中性,滴加氨水的过程中水的电离平衡将
_____ (填“正向”、“逆向”或“不”)移动。
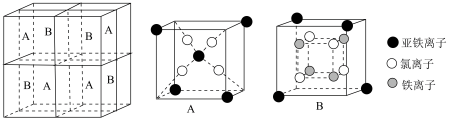
(6)某种离子型铁的氧化物晶胞如图所示,它由
 方块组成。已知该晶体的密度为
方块组成。已知该晶体的密度为
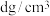 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为
 ,下列说法中正确的是_____。
,下列说法中正确的是_____。

(1)“中国制造2025”是中国政府实施制造强国战略第一个十年行动纲领。氮化铬在现代工业中发挥更重要的作用,请写出
 的价电子轨道表示式
的价电子轨道表示式(2)
 也是造成水体富营养化的重要原因之一,用
也是造成水体富营养化的重要原因之一,用 溶液氧化可除去氨气。其反应机理如图1所示(其中
溶液氧化可除去氨气。其反应机理如图1所示(其中 和
和 略去)。
略去)。 氧化
氧化 的总反应化学方程式为
的总反应化学方程式为(3)改变
 对溶液中
对溶液中 去除氨气效果与余氯(溶液中+1价氯元素的含量)的影响如图2所示,则除氨气过程中最佳的
去除氨气效果与余氯(溶液中+1价氯元素的含量)的影响如图2所示,则除氨气过程中最佳的 值约为
值约为(4)室温下,用水稀释
 氨水,溶液中随着水量的增加而减小的是_____。
氨水,溶液中随着水量的增加而减小的是_____。A.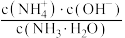 | B. | C. | D. |
(5)
 时,将
时,将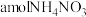 溶于水,向该溶液中滴加
溶于水,向该溶液中滴加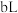 氨水后溶液呈中性,滴加氨水的过程中水的电离平衡将
氨水后溶液呈中性,滴加氨水的过程中水的电离平衡将(6)某种离子型铁的氧化物晶胞如图所示,它由
 方块组成。已知该晶体的密度为
方块组成。已知该晶体的密度为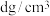 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,下列说法中正确的是_____。
,下列说法中正确的是_____。
A.该铁的氧化物化学式为 |
B.距离 最近的 最近的 有6个 有6个 |
C.晶体中的 只能构成正四面体空隙 只能构成正四面体空隙 |
D.晶胞的边长为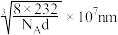 |
您最近一年使用:0次
名校
2 . 前四周期元素X、Y、Z、W的原子序数依次增大,X原子中有6个运动状态不同的电子,Y是地壳中含量最多的元素,基态Z原子K、L层上的电子总数是3p原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法不正确的是
A.电负性: ,原子半径: ,原子半径: |
| B.同周期中,元素Z的第一电离能最大 |
C.简单氢化物的沸点: |
D.在一定条件下,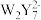 和 和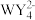 可以相互转化 可以相互转化 |
您最近一年使用:0次
名校
3 .  作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为
作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为 ,含有少量Fe、Ni、Al等元素)制备
,含有少量Fe、Ni、Al等元素)制备 的流程如图。
的流程如图。
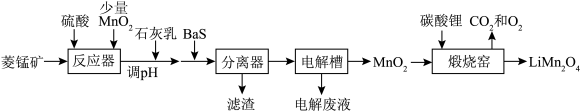
已知常温下部分物质的 如表。
如表。
回答下列问题:
(1)基态Mn原子的价电子轨道表示式为______ 。
(2)常温下,若溶矿反应完成后,反应器中溶液pH=5,可沉淀完全的金属离子是______ ;若测得溶液中 浓度为0.1
浓度为0.1 ,
, 浓度为0.01
浓度为0.01 ,为防止
,为防止 、
、 发生沉淀,反应器中溶液用石灰乳调节的pH应小于
发生沉淀,反应器中溶液用石灰乳调节的pH应小于______ 。(已知:离子浓度小于等于
 ,即可认为该离子沉淀完全)
,即可认为该离子沉淀完全)
(3)加入少量BaS溶液除去 ,生成的沉淀有
,生成的沉淀有______ (填化学式)。
(4)具有强氧化性的过一硫酸( )可代替电解槽反应将
)可代替电解槽反应将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为______ (已知: 的电离第一步完全,第二步微弱)。
的电离第一步完全,第二步微弱)。
(5)煅烧窑中,生成 反应的化学方程式是
反应的化学方程式是______ 。
(6) 中锰元素的平均价态为+3.5。在不同温度下,合成的
中锰元素的平均价态为+3.5。在不同温度下,合成的 中
中 、
、 和
和 的含量与温度的关系见下表。
的含量与温度的关系见下表。
由此可以确定,在上述温度范围内,锰元素的平均价态的变化情况是______ 。
 作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为
作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为 ,含有少量Fe、Ni、Al等元素)制备
,含有少量Fe、Ni、Al等元素)制备 的流程如图。
的流程如图。
已知常温下部分物质的
 如表。
如表。物质 |
|
|
|
|
|
|
|
|
|
|
|
(1)基态Mn原子的价电子轨道表示式为
(2)常温下,若溶矿反应完成后,反应器中溶液pH=5,可沉淀完全的金属离子是
 浓度为0.1
浓度为0.1 ,
, 浓度为0.01
浓度为0.01 ,为防止
,为防止 、
、 发生沉淀,反应器中溶液用石灰乳调节的pH应小于
发生沉淀,反应器中溶液用石灰乳调节的pH应小于
 ,即可认为该离子沉淀完全)
,即可认为该离子沉淀完全)(3)加入少量BaS溶液除去
 ,生成的沉淀有
,生成的沉淀有(4)具有强氧化性的过一硫酸(
 )可代替电解槽反应将
)可代替电解槽反应将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 的电离第一步完全,第二步微弱)。
的电离第一步完全,第二步微弱)。(5)煅烧窑中,生成
 反应的化学方程式是
反应的化学方程式是(6)
 中锰元素的平均价态为+3.5。在不同温度下,合成的
中锰元素的平均价态为+3.5。在不同温度下,合成的 中
中 、
、 和
和 的含量与温度的关系见下表。
的含量与温度的关系见下表。T/℃ |
|
|
|
700 | 5.56 | 44.58 | 49.86 |
750 | 2.56 | 44.87 | 52.57 |
800 | 5.50 | 44.17 | 50.33 |
850 | 6.22 | 44.40 | 49.38 |
您最近一年使用:0次
2024-02-25更新
|
835次组卷
|
3卷引用:2024届吉林省通化市梅河口市第五中学高三下学期一模化学试题
2024届吉林省通化市梅河口市第五中学高三下学期一模化学试题湖南省长沙市长郡中学2023-2024学年高三模拟考试(一)化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
4 . 前四周期元素X、Y、Z、W的原子序数依次增大,X原子中有6个运动状态不同的电子,Y是地壳中含量最多的元素,基态Z原子K、L层上的电子总数是3p原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法不正确的是
| A.电负性:X<Y,原子半径:X>Y |
| B.同周期中,元素Z的第一电离能最大 |
| C.简单氢化物的稳定性:X<Z |
| D.在一定条件下,W2Y72-和WY42-可以相互转化 |
您最近一年使用:0次
名校
解题方法
5 . 翡翠的主要成分为NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅,是决定翡翠品质的重要因素之一。
(1)基态Cr3+最外电子层的电子排布图(轨道表示式)为___________ 。
(2)下列状态的铝中,电离最外层一个电子所需能量最大的是___________ ,最小的是___________ (填标号)。
A. B.
B.  C.
C.  D.
D. 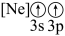
(3)配合物K[Cr(C2O4)(H2O)]中的配体是___________ ,H2O的沸点比CO2的高了许多,主要原因是___________ 。
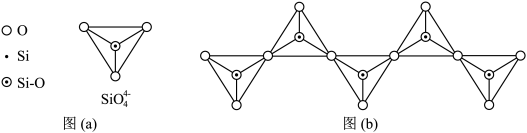
(4)在翡翠等硅酸盐中, 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为___________ ,其化学式为___________ 。低温石英中也存在有顶角相连的硅氧四面体形成螺旋上升的长链,没有封闭的环状结构,这一结构决定了它具有___________ 。
(5)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是___________ 原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子空间占有率为___________ % (列出计算表达式)。

(1)基态Cr3+最外电子层的电子排布图(轨道表示式)为
(2)下列状态的铝中,电离最外层一个电子所需能量最大的是
A.
 B.
B.  C.
C.  D.
D. 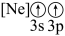
(3)配合物K[Cr(C2O4)(H2O)]中的配体是
(4)在翡翠等硅酸盐中,
 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
(5)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是

您最近一年使用:0次
名校
6 . 现有A、B、C、D、E、F、G七种短周期主族元素,原子序数依次增大。A与C形成的化合物能使湿润的红色石蕊试纸变蓝;D是地壳中含量最多的元素;D、F原子的最外层电子数相等;E的焰色反应呈黄色;B元素的一种同位素在考古时可用于测定一些文物的年代。
请回答下列问题:(注意回答问题时均用元素符号表示)
(1)元素B在周期表中的位置:___________ 。
(2)元素D与E组成的含非极性键的化合物的电子式:___________ 。元素A与D组成的18电子分子的结构式:___________ 。
(3)写出G的简单阴离子的电子排布式___________ 。
(4)D和F的简单气态氢化物沸点比较高的是:________ (写分子式),原因:________ 。
(5)D、E、F、G的电负性小到大的顺序为___________ (用元素符号表示)。
(6)用电子式表示化合物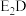 的形成过程:
的形成过程:___________ 。
请回答下列问题:(注意回答问题时均用元素符号表示)
(1)元素B在周期表中的位置:
(2)元素D与E组成的含非极性键的化合物的电子式:
(3)写出G的简单阴离子的电子排布式
(4)D和F的简单气态氢化物沸点比较高的是:
(5)D、E、F、G的电负性小到大的顺序为
(6)用电子式表示化合物
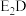 的形成过程:
的形成过程:
您最近一年使用:0次
名校
7 . 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子最外层有3个未成对电子,Y是地壳中含量高的元素,Z单质能与冷水剧烈反应并放出氢气,W的周期数与族序数相等。下列说法正确的是
| A.简单离子的半径:X>Y>Z>W |
| B.电负性大小:X>Y>W>Z |
| C.第一电离能:Y>X>W>Z |
| D.X、Z、W三种元素最高价氧化物对应水化物间只存在两个反应 |
您最近一年使用:0次
2023-03-08更新
|
456次组卷
|
2卷引用:吉林省长春市第二实验中学2023-2024学年高三上学期9月月考化学试题
解题方法
8 . 已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。其中A是宇宙中含量最多的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布是nsnnp2n;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
(1)请用元素符号完成下列空白:
①元素:A_______ ;B_______ ;C_______ ;D_______ 。
②A、B、C三种元素的电负性由大到小的顺序为:_______ 。
③B、C、D、E四种元素的第一电离能由大到小的顺序为:_______ 。
(2)以下是A、B、C、D、E、F元素中某种元素的部分电离能,由此可推断该元素是_______ 。(填元素名称)
(3)F元素位于周期表的_______ 区,未成对电子对数为_______ ,最外层电子所占能级轨道电子云轮廓图的形状为_______ ,与F元素同周期的元素中未成对电子数最多的是_______ 。(填元素符号)
(1)请用元素符号完成下列空白:
①元素:A
②A、B、C三种元素的电负性由大到小的顺序为:
③B、C、D、E四种元素的第一电离能由大到小的顺序为:
(2)以下是A、B、C、D、E、F元素中某种元素的部分电离能,由此可推断该元素是
| I1 | I2 | I3 | I4 | I5 |
| 578 kJ·mol-1 | 1817 kJ·mol-1 | 2745 kJ·mol-1 | 11575 kJ·mol-1 | 14830 kJ·mol-1 |
您最近一年使用:0次
2023-03-06更新
|
180次组卷
|
2卷引用:吉林省辽源市等2地高中友好学校2022-2023学年高二上学期期末联考化学试题
名校
9 . 某水性钠离子电池电极材料由Na+、Fe2+、Fe3+、CN-组成,其立方晶胞嵌入和嵌出Na+过程中,Fe2与Fe3+含量发生变化,依次变为格林绿、普鲁士蓝、普鲁士白三种物质,其过程如图所示。下列说法错误的是
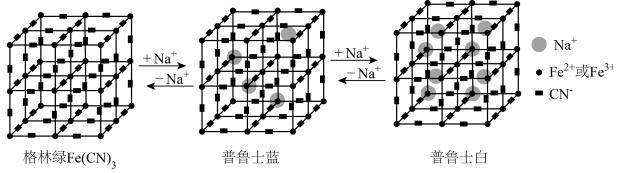

| A.基态Fe原子的价电子排布式为3d64s2,失去4s电子转化为Fe2+ |
| B.导电能力普鲁士蓝小于普鲁士白 |
| C.普鲁士蓝中Fe2+与Fe3+个数比为1:2 |
D.若普鲁士白的晶胞棱长为apm,则其晶体的密度为 |
您最近一年使用:0次
2023-01-13更新
|
698次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2022-2023学年高二上学期期末考试化学试题
名校
10 . 已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数, B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素。E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。
(1)基态E原子的价电子排布式_______ 。
(2)B、C、D三元素第一电离能由大到小的顺序为(用元素符号表示)_______ 。
(3)CD 中心原子杂化轨道的类型为
中心原子杂化轨道的类型为_______ 杂化;CA 的空间构型为
的空间构型为_______ (用文字描述)。
(4)D、E元素最简单氢化物的熔点_______ > _______ (填化学式),理由是_______ 。
(5)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是_______ 。若相邻C原子和F原子间的距离为apm,阿伏加德罗常数为NA,则该晶体的密度为_______ g/cm3(用含a、NA的符号表示,只列式不需要计算)。

(1)基态E原子的价电子排布式
(2)B、C、D三元素第一电离能由大到小的顺序为(用元素符号表示)
(3)CD
 中心原子杂化轨道的类型为
中心原子杂化轨道的类型为 的空间构型为
的空间构型为(4)D、E元素最简单氢化物的熔点
(5)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是

您最近一年使用:0次
2022-09-22更新
|
114次组卷
|
2卷引用:吉林省长春市北师大附属学校2021-2022学年高二上学期期末考试化学试题







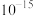

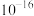
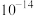
 /%
/% /%
/% /%
/%

