名校
解题方法
1 . 已知R、X、Y、Z、W为原子序数依次增大的短周期主族元素,其中R、X、Y与Z同一周期,Y与W同族,形成的化合物M的结构如图所示。下列说法正确的是
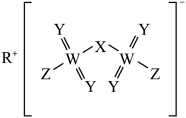
| A.简单离子半径:W>Z>Y>X>R |
| B.第一电离能:Z>X>Y>W |
| C.R与Y的单质反应可生成含非极性键的化合物 |
D.在水中的溶解度: |
您最近一年使用:0次
2023-03-17更新
|
414次组卷
|
6卷引用:广西北海市2022-2023学年高二下学期期末检测化学(B卷)试题
解题方法
2 . 下列有关化学用语表示正确的是
A.N2的电子式: |
| B.Zn2+的最外层电子排布式:3s23p63d10 |
C.基态碳原子的最外层电子轨道表示式: |
D.空间填充模型 可以表示CH4分子,也可以表示CCl4分子 可以表示CH4分子,也可以表示CCl4分子 |
您最近一年使用:0次
2023-03-13更新
|
275次组卷
|
3卷引用:广西山县第三高级中学2022-2023学年高二下学期6月期末考试化学试题
名校
解题方法
3 . 下列与分子性质有关的说法正确的是
A.邻硝基苯酚( )的沸点高于对硝基苯酚( )的沸点高于对硝基苯酚( )是因为后者形成了分子间氢键 )是因为后者形成了分子间氢键 |
B. 的酸性强于 的酸性强于 是因为 是因为 的电负性大,使 的电负性大,使 中 中 极性强 极性强 |
C.C的电负性强于Si,所以 的熔沸点高于 的熔沸点高于 |
D.尿素 不溶于水,易溶于有机溶剂 不溶于水,易溶于有机溶剂 |
您最近一年使用:0次
2023-03-10更新
|
1255次组卷
|
7卷引用:广西柳州地区民族高级中学2022-2023学年高二下学期期中考试化学试题
4 . 黑火药的爆炸反应原理为2KNO3+3C+S K2S+N2↑+3CO2↑。请回答下列问题:
K2S+N2↑+3CO2↑。请回答下列问题:
(1)基态O原子的核外电子排布式为___________ ;基态18O原子核外有___________ 种空间运动状态的电子。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用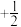 表示,与之相反的用
表示,与之相反的用 表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为
表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为___________ 。
(3)K位于周期表的___________ 区;基态钾离子的电子占据的最高能层符号是___________ 。
(4)K+与S2-具有相同的电子构型,r(K+)小于r(S2-),原因是___________ 。
(5)下列曲线表示氧族元素性质随核电荷数的变化趋势,正确的是___________ 。
a.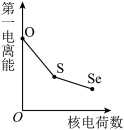 b.
b.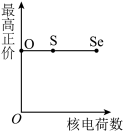 c.
c. d.
d.
(6)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲和能(E1)。MgO的Born-Haber循环如图所示。

由图可知,Mg原子的第二电离能为___________ kJ/mol;O=O键的键能为___________ kJ/mol;氧原子的第一电子亲和能为___________ kJ/mol。
 K2S+N2↑+3CO2↑。请回答下列问题:
K2S+N2↑+3CO2↑。请回答下列问题:(1)基态O原子的核外电子排布式为
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
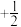 表示,与之相反的用
表示,与之相反的用 表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为
表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为(3)K位于周期表的
(4)K+与S2-具有相同的电子构型,r(K+)小于r(S2-),原因是
(5)下列曲线表示氧族元素性质随核电荷数的变化趋势,正确的是
a.
 b.
b. c.
c. d.
d.
(6)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲和能(E1)。MgO的Born-Haber循环如图所示。

由图可知,Mg原子的第二电离能为
您最近一年使用:0次
2023-03-10更新
|
392次组卷
|
2卷引用:广西南宁市2022-2023学年高二上学期期末教学质量调研化学试题
名校
解题方法
5 . 下列化学用语或图示表达错误的是
A.碳原子结构示意图: |
B.氧原子核外能量最高的电子云的形状: |
C.Na2O2的电子式: |
D.基态N原子的价层电子轨道表示式: |
您最近一年使用:0次
2023-03-05更新
|
546次组卷
|
5卷引用:广西南宁市2022-2023学年高二上学期期末教学质量调研化学试题
广西南宁市2022-2023学年高二上学期期末教学质量调研化学试题广西柳州市第三中学2022-2023学年高二下学期3月月考化学试题湖北省宜昌英杰学校2022-2023学年高二3月月考化学试题广东省东莞市东华高级中学2022-2023学年高二下学期3月月考化学试题(已下线)专题11 原子结构 原子结构与元素的性质-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)
名校
解题方法
6 . 根据信息回答问题:
(1)实验测得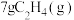 在氧气中充分燃烧生成二氧化碳气体和液态水时释放出352.75kJ的热量,试写出
在氧气中充分燃烧生成二氧化碳气体和液态水时释放出352.75kJ的热量,试写出 燃烧热的热化学方程式:
燃烧热的热化学方程式:_________________________________________ 。
(2)已知反应: .有关键能数据如下:
.有关键能数据如下: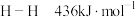 ,
,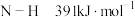 ,
,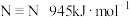 ,根据键能数据计算
,根据键能数据计算
___________ 。
(3)已知: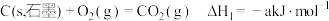 ;
;
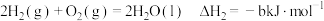 ;
;
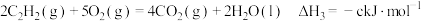 ;
;
根据盖斯定律,计算 时由
时由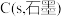 和
和 生成
生成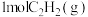 反应的反应热为:
反应的反应热为:
____________  。
。
(4)已知:A,B,C,D四种短周期元素的原子半径依次减小,D能分别与A,B,C形成电子总数相等的分子X、Y、Z。C原子的最外层电子排布为 。E的原子序数为29.回答下列问题:
。E的原子序数为29.回答下列问题:
①A,B,C的第一电离能由小到大的顺序为____________________ (用元素符号表示)。
②C元素原子核外有_______ 个原子轨道。
③E元素在周期表中属于_______ 区元素。写出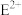 的电子排布式
的电子排布式_______________________ 。
(1)实验测得
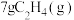 在氧气中充分燃烧生成二氧化碳气体和液态水时释放出352.75kJ的热量,试写出
在氧气中充分燃烧生成二氧化碳气体和液态水时释放出352.75kJ的热量,试写出 燃烧热的热化学方程式:
燃烧热的热化学方程式:(2)已知反应:
 .有关键能数据如下:
.有关键能数据如下: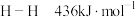 ,
,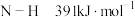 ,
,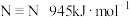 ,根据键能数据计算
,根据键能数据计算
(3)已知:
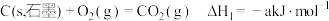 ;
;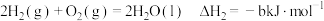 ;
;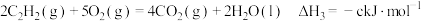 ;
;根据盖斯定律,计算
 时由
时由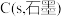 和
和 生成
生成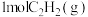 反应的反应热为:
反应的反应热为:
 。
。(4)已知:A,B,C,D四种短周期元素的原子半径依次减小,D能分别与A,B,C形成电子总数相等的分子X、Y、Z。C原子的最外层电子排布为
 。E的原子序数为29.回答下列问题:
。E的原子序数为29.回答下列问题:①A,B,C的第一电离能由小到大的顺序为
②C元素原子核外有
③E元素在周期表中属于
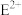 的电子排布式
的电子排布式
您最近一年使用:0次
2023-03-04更新
|
213次组卷
|
2卷引用:广西山县第三高级中学2022-2023学年高二下学期6月期末考试化学试题
名校
解题方法
7 . 元素周期表可以有多种表示方法,如图1为八角形元素周期表,八角形的每个顶角对应一种元素,下列说法错误的是


| A.图1中沿虚线箭头方向,元素单质的还原性逐渐增强 |
| B.元素第一电离能大小关系:②>①>④ |
| C.最简单气态氢化物的稳定性:⑤>⑥ |
D. 与③、④可形成冰晶石 与③、④可形成冰晶石 (已知 (已知 (熔融) (熔融) ,形成的晶胞如图2所示,其中黑球代表 ,形成的晶胞如图2所示,其中黑球代表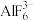 ,该晶体密度为 ,该晶体密度为 |
您最近一年使用:0次
2023-03-04更新
|
1109次组卷
|
5卷引用:广西南宁市第二中学2023-2024学年高三10月教学质量调研化学试题
名校
8 . 下列化学用语表述正确的是
A.二氧化碳的电子式: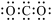 |
B.基态溴原子的简化电子排布式: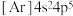 |
C.双线桥表示 和浓 和浓 反应电子转移的方向和数目: 反应电子转移的方向和数目: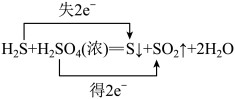 |
D. 的质谱图: 的质谱图: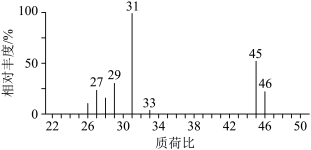 |
您最近一年使用:0次
2023-03-02更新
|
223次组卷
|
2卷引用:广西壮族自治区苍梧中学2022-2023学年高二下学期3月月考化学试题
9 . 元素周期表中锑元素的数据如图。

(1)根据锑的价层电子排布式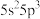 可知,锑在元素周期表中位于第
可知,锑在元素周期表中位于第_______ 周期第_______ 族。
(2)基态锑原子中有_______ 个未成对电子,这些未成对电子具有_______ (填“相同”或“不同”)的自旋状态。
(3)基态锑原子的5s轨道形状为_______ 形;该原子最外层电子占有_______ 个轨道。
(4)Bi在元素周期表中与Sb相邻,位于Sb的正下方。
①下列推断正确的是_______ 。
a.电负性:Sb>Bi b.原子半径:Sb>Bi c.金属性:Sb>Bi d.氧化性: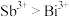
②第一电离能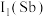
_______ (填“大于”或“小于”) 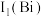 ,原因是
,原因是_______ 。

(1)根据锑的价层电子排布式
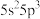 可知,锑在元素周期表中位于第
可知,锑在元素周期表中位于第(2)基态锑原子中有
(3)基态锑原子的5s轨道形状为
(4)Bi在元素周期表中与Sb相邻,位于Sb的正下方。
①下列推断正确的是
a.电负性:Sb>Bi b.原子半径:Sb>Bi c.金属性:Sb>Bi d.氧化性:
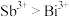
②第一电离能
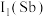
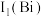 ,原因是
,原因是
您最近一年使用:0次
10 . 下列原子的电子排布式中,处于激发状态的是
A.钠原子: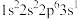 | B.氟原子: |
C.锰原子: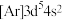 | D.铜原子: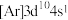 |
您最近一年使用:0次
2023-02-24更新
|
508次组卷
|
3卷引用:广西桂林市2022-2023学年高二上学期期末考试化学试题



