1 . 填空。
(1)基态X原子的第二电子层上只有一个空轨道,则X是___________ ,其电子排布图为___________ ;Y原子的核电荷数为33,其价层电子排布式是___________ ,其在元素周期表中的位置属于___________ 区的元素。
(2)德国和美国科学家首次研制出了由20个碳原子构成的空心笼状分子C20,该笼状结构是由多个正五边形构成的(如图所示)。请回答:
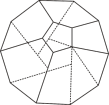
①C20分子中共有_______ 个正五边形,共有_______ 条棱。C20晶体属于________ (填晶体类型)。
②固体C60与C20相比较,熔点较高的应为_______ ,理由是________ 。
(3)在某种含镁、镍、碳3种元素的超导材料晶体中,镁原子和镍原子一起以立方最密堆积方式形成有序结构。结构中的两种八面体空隙,一种完全由镍原子构成,另一种由镍原子和镁原子共同构成,碳原子只填充在由镍原子构成的八面体空院中,晶胞如图所示。

①该晶体的化学式为___________ 。
②若取碳原子为晶胞顶点,则镍原子位于晶胞的_________ 位置。
(4)白磷分子中P—P键易断开,若一个白磷分子( )中的每个P—P键均断开插入一个氧原子,则一共可结合
)中的每个P—P键均断开插入一个氧原子,则一共可结合________ 个氧原子,这样得到磷的一种氧化物,其分子式为_________ 。由C、H、N三种元素组成的某化合物CxHyNz,其分子内含4个氮原子排成的内空的正四面体(同白磷),每两个氮原子间都有一个碳原子,且分子内无C—C键和C=C键,则化合物的分子式为________ 。
(1)基态X原子的第二电子层上只有一个空轨道,则X是
(2)德国和美国科学家首次研制出了由20个碳原子构成的空心笼状分子C20,该笼状结构是由多个正五边形构成的(如图所示)。请回答:

①C20分子中共有
②固体C60与C20相比较,熔点较高的应为
(3)在某种含镁、镍、碳3种元素的超导材料晶体中,镁原子和镍原子一起以立方最密堆积方式形成有序结构。结构中的两种八面体空隙,一种完全由镍原子构成,另一种由镍原子和镁原子共同构成,碳原子只填充在由镍原子构成的八面体空院中,晶胞如图所示。

①该晶体的化学式为
②若取碳原子为晶胞顶点,则镍原子位于晶胞的
(4)白磷分子中P—P键易断开,若一个白磷分子(
 )中的每个P—P键均断开插入一个氧原子,则一共可结合
)中的每个P—P键均断开插入一个氧原子,则一共可结合
您最近一年使用:0次
名校
解题方法
2 . 镍及其化合物在工业生产中具有重要作用,回答下列问题:
(1)层状镍钴锰三元材料可用作锂离子电池正极材料,化学式可表示为LiNixCoyMnzO2,其五种组成元素中第一电离能最小的是___________ ;基态Ni2+与Co2+离子中未成对电子数之比为___________ 。
(2)镍的配合物[Ni(CN)4]SO4中,配位数为___________ ,配体的空间构型为___________ ,S原子的杂化轨道类型为___________ 。
(3)镍的另一种配合物Ni(CO)4的熔点、沸点分别为-25℃、43℃,其晶体中存在的作用力有___________ (填标号);
A.离子键B.极性键C.非极性键D.配位键E.范德华力
Ni(CO)4___________ (填“能”或“不能")溶于水,其判断理由是___________ 。
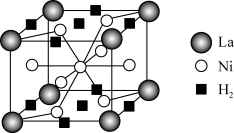
(4)某镧镍合金的结构属六方晶系(晶胞参数为apm、apm、cpm,α=β=90°,γ=120°),是一种储氢材料,储氢后的晶胞结构如图。若储氢前后晶胞参数不变,则储氢后晶体的密度为___________ g·cm-3(设阿伏加德罗常数的值为NA)。
(1)层状镍钴锰三元材料可用作锂离子电池正极材料,化学式可表示为LiNixCoyMnzO2,其五种组成元素中第一电离能最小的是
(2)镍的配合物[Ni(CN)4]SO4中,配位数为
(3)镍的另一种配合物Ni(CO)4的熔点、沸点分别为-25℃、43℃,其晶体中存在的作用力有
A.离子键B.极性键C.非极性键D.配位键E.范德华力
Ni(CO)4
(4)某镧镍合金的结构属六方晶系(晶胞参数为apm、apm、cpm,α=β=90°,γ=120°),是一种储氢材料,储氢后的晶胞结构如图。若储氢前后晶胞参数不变,则储氢后晶体的密度为

您最近一年使用:0次
2022-03-03更新
|
380次组卷
|
2卷引用:云南省昆明市第一中学2022届高三第七次高考仿真模拟理科综合化学试题
3 . 关于原子光谱说法不正确 的是
| A.霓虹灯光、LED灯光与原子核外电子跃迁释放能量有关 |
| B.焰色试验是利用元素的特征可见原子光谱鉴别某些元素 |
| C.许多元素是通过原子光谱发现的 |
| D.原子电子发生跃迁,是指电子从较低能量的状态变为较高能量的状态 |
您最近一年使用:0次
2022-02-28更新
|
616次组卷
|
3卷引用:云南省大理白族自治州民族中学2022-2023学年高二下学期5月期中考试化学试题
云南省大理白族自治州民族中学2022-2023学年高二下学期5月期中考试化学试题(已下线)北京市第四中学2021-2022学年高二上学期期末考试化学试题天津北京师范大学静海附属学校2021-2022学年高二下学期期中考试化学试题
名校
4 . 德国科学家本杰明和美国科学家戴维荣膺2021年诺贝尔化学奖,他们在不对称有机催化作出巨大贡献。过渡金属氧化物与过渡金属都可作为反应催化剂,其耐热性、抗毒性强,应用广泛。完成下列问题:
(1)OsO4是不对称氨基羟基化反应的催化剂,Os原子序数为76,Os的价层电子排布式为____ 。
(2)双(环戊二烯)锇的结构为 分子中碳原子的轨道杂化类型为
分子中碳原子的轨道杂化类型为____ ;C、H、Os三种元素的电负性由小到大的顺序为____ 。
(3)硝酸锰是化学反应中常用催化剂,Mn(NO3)2中的化学键除了σ键外,还存在____ 。
(4)NH3、NaH、CH3OH的沸点由高到低的顺序为____ (填化学式,下同),还原性由强到弱的顺序为____ 。
(5)下列说法正确的是____ (填序号)。
a.CS2与SO2分子的键角相同 b.HCHO中的C原子为sp3杂化
c.CF4与SiCl4均为非极性分子 d.CO与N2为等电子体,CO熔沸点较高
(6)MgH2是金属氢化物储氢材料,其晶胞如图所示,Mg的配位数为____ ,该晶体的密度为ρg/cm3,则该晶胞的体积为____ cm3(用含ρ、NA的代数式表示)。

(1)OsO4是不对称氨基羟基化反应的催化剂,Os原子序数为76,Os的价层电子排布式为
(2)双(环戊二烯)锇的结构为
 分子中碳原子的轨道杂化类型为
分子中碳原子的轨道杂化类型为(3)硝酸锰是化学反应中常用催化剂,Mn(NO3)2中的化学键除了σ键外,还存在
(4)NH3、NaH、CH3OH的沸点由高到低的顺序为
(5)下列说法正确的是
a.CS2与SO2分子的键角相同 b.HCHO中的C原子为sp3杂化
c.CF4与SiCl4均为非极性分子 d.CO与N2为等电子体,CO熔沸点较高
(6)MgH2是金属氢化物储氢材料,其晶胞如图所示,Mg的配位数为

您最近一年使用:0次
名校
解题方法
5 . 按照量子力学对原子核外电子运动状态的描述,下列说法不正确 的是
| A.原子的核外电子处于能量最低的状态称为基态 |
| B.在一个原子中,不可能出现运动状态完全相同的两个电子 |
| C.原子核外电子从一个轨道跃迁到另一个轨道时,会辐射或吸收能量 |
| D.电子云图中点密集的地方表示电子在此处单位体积内出现的数量多 |
您最近一年使用:0次
2022-01-12更新
|
431次组卷
|
3卷引用:云南省曲靖市第一中学2023-2024学年高二下学期3月月考化学试题
云南省曲靖市第一中学2023-2024学年高二下学期3月月考化学试题北京市昌平区2021-2022学年高二上学期期末考试化学试题(已下线)第一章 原子结构与性质 章节过关检测-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)
名校
解题方法
6 . 硫及其化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)V2O5是SO2氧化为SO3的重要催化剂。S位于元素周期表中的___________ 区;基态V原子的价层电子排布式为___________ ;V2O5溶于NaOH溶液中,可得到钒酸钠(Na3VO4),也可得到偏钒酸钠,偏钒酸根阴离子呈如图所示的无限链状结构(钒位于氧构成的四面体中心),该阴离子的化学式为___________ 。
(2)SOCl2常用于农药医药、染料的生产,遇水易分解生成H2SO3。SOCl2的中心原子杂化类型为___________ ,H2SO3的酸性比H2SO4弱,其原因是___________
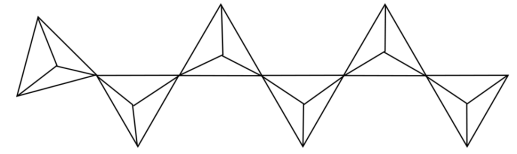
(3)单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。

①根据其超导性质,推断该晶体的类型为___________ 。
②S位于H构成的___________ (填“八面体空隙”或“四面体空隙")中。
③若以晶胞参数为单位长度建立坐标系,用来表示晶胞中各原子的位置,称为原子坐标。在晶胞坐标系中,a点氢原子坐标为(1, ,
, ),b点硫原子坐标为(0,1,0),则c点氢原子坐标为
),b点硫原子坐标为(0,1,0),则c点氢原子坐标为___________ ;已知该晶体的密度为ρg·cm-3,设NA为阿伏加德罗常数的值,则a、b两个原子核之间的距离为___________ pm。
(1)V2O5是SO2氧化为SO3的重要催化剂。S位于元素周期表中的

(2)SOCl2常用于农药医药、染料的生产,遇水易分解生成H2SO3。SOCl2的中心原子杂化类型为
(3)单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。

①根据其超导性质,推断该晶体的类型为
②S位于H构成的
③若以晶胞参数为单位长度建立坐标系,用来表示晶胞中各原子的位置,称为原子坐标。在晶胞坐标系中,a点氢原子坐标为(1,
 ,
, ),b点硫原子坐标为(0,1,0),则c点氢原子坐标为
),b点硫原子坐标为(0,1,0),则c点氢原子坐标为
您最近一年使用:0次
名校
解题方法
7 . 铜及其合金广泛应用于生活生产中。如黄铜合金可作首饰、镀层等。请回答下列问题:
(1)基态铜原子价电子排布式为___________ 。
(2)在Cu(NO3)2溶液中加入氨水至过量,生成[Cu(NH3)4]2+。
① 中N原子的杂化类型是
中N原子的杂化类型是___________ ;NH3分子的立体构型是___________ 。
②[Cu(NH3)4]2+中提供孤对电子的基态原子有___________ 个未成对电子。1 mol该阳离子含有的σ键数目为___________
③NH3能与Cu2+形成[Cu(NH3)4]2+,而NF3不能,其原因是___________ ,NH3的沸点比NF3___________ ( 选填“高”或“低”),原因是___________ 。
(3)黄铜合金采取面心立方堆积,其晶胞结构如图所示:
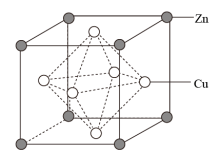
已知:晶胞参数为a nm。
①合金中粒子间作用力类型是___________ 。
②与Cu原子等距离且最近的Cu原子有___________ 个。
③黄铜合金晶体密度为___________ g·cm-3。(设NA为阿伏加德罗常数的值)
(1)基态铜原子价电子排布式为
(2)在Cu(NO3)2溶液中加入氨水至过量,生成[Cu(NH3)4]2+。
①
 中N原子的杂化类型是
中N原子的杂化类型是②[Cu(NH3)4]2+中提供孤对电子的基态原子有
③NH3能与Cu2+形成[Cu(NH3)4]2+,而NF3不能,其原因是
(3)黄铜合金采取面心立方堆积,其晶胞结构如图所示:

已知:晶胞参数为a nm。
①合金中粒子间作用力类型是
②与Cu原子等距离且最近的Cu原子有
③黄铜合金晶体密度为
您最近一年使用:0次
2021-12-31更新
|
596次组卷
|
3卷引用:云南省景东彝族自治县第一中学2022-2023学年高二下学期期末考试化学试题
名校
解题方法
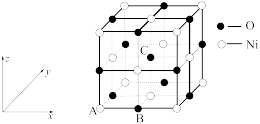
8 . 周期表前三周期的四种元素W、X、Y、Z可形成结构如图的物质A,该物质中所有原子均满足稳定结构,W的原子序数最大,Y、Z处于同一周期。
回答下列问题:

(1)在该物质中,Y的化合价为___________ 价,W位于周期表的第___________ 族,X基态原子核外有___________ 个未成对电子。
(2)A物质中含有的化学键有___________ (填序号)。
a.离子键 b.金属键 c.非极性共价键 d.极性共价键 e.氢键
(3)比较电负性:Y___________ Z(填“>”“<”或“=”),Z原子的杂化方式为___________ 。
(4)镍的氧化物也常用作催化剂,晶胞结构如图所示,该晶体的化学式为___________ 。该晶体中Ni周围与其等距离且最近的Ni有___________ 个,原子坐标参数表示晶胞内部各原子的相对位置,若该晶胞中原子坐标参数A为(0,0,0),B为( ,0,0),则C的原子坐标参数为
,0,0),则C的原子坐标参数为___________ 。
(5)该晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值,则晶胞中镍原子与氧原子的最短核间距为___________ pm。
回答下列问题:

(1)在该物质中,Y的化合价为
(2)A物质中含有的化学键有
a.离子键 b.金属键 c.非极性共价键 d.极性共价键 e.氢键
(3)比较电负性:Y
(4)镍的氧化物也常用作催化剂,晶胞结构如图所示,该晶体的化学式为
 ,0,0),则C的原子坐标参数为
,0,0),则C的原子坐标参数为
(5)该晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值,则晶胞中镍原子与氧原子的最短核间距为
您最近一年使用:0次
名校
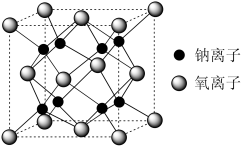
9 . 钠离子电池(Sodiurmionbatry), 是一种二次电池(充电电池),主要依靠钠离子在正极和负极之间移动来工作,与锂离子电池工作原理相似。该电池的负极材料为Na2Co2TeO6,电解液中含NaClO4.回答下列问题:
(1)Co是___________ 区元素,Co的价层电子排布图为___________ 。
(2)C、 N、O是第二周期非金属元素,它们的第一电离能由大到小的排序是___________ (用元素符号表示)。
(3)NaClO4中ClO 的几何构型为
的几何构型为___________ , 其中氯原子的杂化轨道类型为___________ 。
(4)氯酸(HClO3) 酸性___________ (填“大于”或“小于”)高氯酸(HClO4) 的酸性,从结构的角度解释原因是___________
(5)实验室的硅胶干燥剂中常添加CoCl2因为无水CoCl2为蓝色,但吸水后变粉红色[ Co( H2O)6]3+。[Co( H2O)6]3+包含的作用力有___________(填序号)。
(6)Na和O形成的离子化合物的晶胞结构如图所示,若钠离子和氧离子的最短间距为apm,阿伏加德罗常数的值为NA该晶胞的密度为___________ g/cm3(用含a、NA的代数式表示)。
(1)Co是
(2)C、 N、O是第二周期非金属元素,它们的第一电离能由大到小的排序是
(3)NaClO4中ClO
 的几何构型为
的几何构型为(4)氯酸(HClO3) 酸性
(5)实验室的硅胶干燥剂中常添加CoCl2因为无水CoCl2为蓝色,但吸水后变粉红色[ Co( H2O)6]3+。[Co( H2O)6]3+包含的作用力有___________(填序号)。
| A.离子键 | B.极性键 | C.配位键 | D.金属键 |

您最近一年使用:0次
10 . 核安全与放射性污染防治已引起世界核大国的广泛重视。在爆炸的核电站周围含有放射性物质碘-131和铯-137。碘-131一旦被人体吸入,可能会引发甲状腺等疾病。
(1)铯(Cs)的价电子排布式为_______ ,与铯同属“碱金属元素”的三种元素X、Y、Z位于周期表的前四周期,它们的第一电离能如下表,则三种元素中Y的元素符号为_______ 。
(2)与碘同主族的氟(F)具有很强的活性,BF3常温下是气体,其分子的空间构型为_______ ;BF3有强烈的接受孤电子对的倾向。BF3与NH3相遇,立即生成白色固体。写出该白色固体的结构式,并标注出其中的配位键:_______ 。
(3)碘(I)与氯(Cl)同主族。BeCl2室温下为白色易升华的固体,BeCl2属于_______ 晶体(填“分子”“离子”或“原子”),中心原子的杂化方式为_______ ,与BeCl2互为等电子体的分子为_______ 。
(4)钠钾合金属于金属晶体,某种合金的晶胞结构如图所示,晶体中K原子的配位数为_______ ;已知金属原子半径r(Na)、r(K),计算晶体的空间利用率:_______ (假设原子是刚性球体)。

(1)铯(Cs)的价电子排布式为
| 元素代号 | X | Y | Z |
| 第一电离能(kJ∙mol-1) | 520 | 496 | 419 |
(2)与碘同主族的氟(F)具有很强的活性,BF3常温下是气体,其分子的空间构型为
(3)碘(I)与氯(Cl)同主族。BeCl2室温下为白色易升华的固体,BeCl2属于
(4)钠钾合金属于金属晶体,某种合金的晶胞结构如图所示,晶体中K原子的配位数为

您最近一年使用:0次



