解题方法
1 . 离子液体有独特的优良性能。某离子液体 的结构如图所示,下列说法正确的是
的结构如图所示,下列说法正确的是
 的结构如图所示,下列说法正确的是
的结构如图所示,下列说法正确的是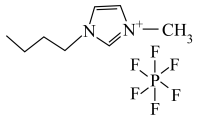
A.第一电离能: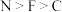 | B. 原子的杂化轨道类型均为 原子的杂化轨道类型均为 |
C. 中所含 中所含 键的数目为 键的数目为 | D.最简单氢化物的沸点: |
您最近一年使用:0次
名校
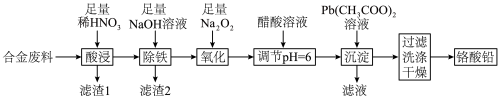
2 . 铬酸铅(PbCrO4)是黄色涂料“铬黄”的主要成分,实验室由某合金废料(主要成分为Fe、C、Cr2O3)制备PbCrO4的流程如图:
回答下列问题:
(1)基态82Pb2+的价层电子排布图为_______ 。
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是_______ (用化学方程式解释)。
(3)“滤渣2”中电负性最大的元素是_______ (填元素符号)。
(4)“氧化”时发生反应的离子方程式为_______ 。
(5)“调节pH=6”的目的是_______ 。
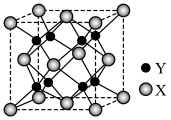
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
①结合PbX2的熔点变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______ (填“增强”“不变”或“减弱”,后同)、共价性_______ 。
②PbF2的立方晶胞如图所示,其中X代表的离子是_______ (填离子符号);若该晶胞参数为anm,则正、负离子的最小核间距为_______ pm。
回答下列问题:
(1)基态82Pb2+的价层电子排布图为
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是
(3)“滤渣2”中电负性最大的元素是
(4)“氧化”时发生反应的离子方程式为
(5)“调节pH=6”的目的是
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
| 二卤化铅 | PbF2 | PbCl2 | PbBr2 | PbI2 |
| 熔点/℃ | 824 | 501 | 373 | 402 |
②PbF2的立方晶胞如图所示,其中X代表的离子是
您最近一年使用:0次
2024-05-12更新
|
93次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三下学期适应性月考(九)理综试卷-高中化学
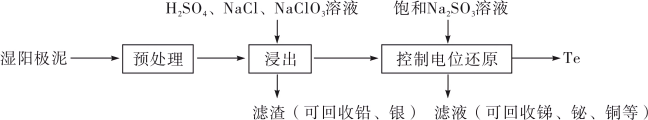
3 . 碲(Te)是一种重要的稀有分散元素,广泛应用于冶金、石油、化工、航空、电子等领域。以某冶炼厂的湿阳极泥(含水26%,主要含锑、砷、铅、铋、银和少量铜、碲等)为原料回收碲的流程如下:
请回答下列问题:
(1)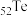 的基态原子的电子排布式为
的基态原子的电子排布式为___________ 。
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是___________ ;氧化后的原料还需粉碎、过筛,目的是___________ 。
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为___________ 、___________ ;添加 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、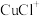 而被浸出的离子方程式
而被浸出的离子方程式___________ 。
(4)电解时为防止除Te以外的单质生成,需控制电位的范围为___________ ;加入饱和 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成___________ (填化学式)。
(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为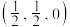 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为___________ 。若Te的原子半径为rpm,碲化锌晶胞中面心与顶点的碲原子相切,晶体的密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
___________  (列出计算式)。
(列出计算式)。
| 物质 | 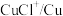 | 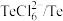 | 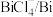 | 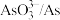 | 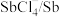 |
| 氧化还原电位(E)/V | 0.342 | 0.568 | 0.16 | 小于0.16 | 小于0.16 |
(1)
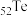 的基态原子的电子排布式为
的基态原子的电子排布式为(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为
 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、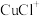 而被浸出的离子方程式
而被浸出的离子方程式(4)电解时为防止除Te以外的单质生成,需控制电位的范围为
 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为
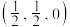 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为 ,则阿伏加德罗常数
,则阿伏加德罗常数
 (列出计算式)。
(列出计算式)。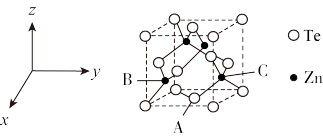
您最近一年使用:0次
4 . 废弃电脑的CPU中含有贵重金属Cu、Ag、Au,可回收利用,部分流程如下:

(1)铜元素在周期表中位于______ ,基态铜原子的核外电子排布式为______ 。
(2)电脑CPU在使用时会涂抹一层散热硅脂(一种液体橡胶,主要成分为聚二甲基硅氧烷和聚甲基硅氧烷),可用______洗去;
(3)用Zn粉还原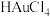 的化学反应方程式为
的化学反应方程式为______ ;
(4)试剂1为______ (填名称,下同),试剂2为______ ;
(5)加入过其铁粉的原因是______ ;
(6)滤渣2溶于试剂2的原因是______ ;(用离子反应方程式表示)
(7)金属铜的晶胞结构如图所示,铜原子之间的最小距离为apm,则铜晶胞的密度为______  (
( 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。

(1)铜元素在周期表中位于
(2)电脑CPU在使用时会涂抹一层散热硅脂(一种液体橡胶,主要成分为聚二甲基硅氧烷和聚甲基硅氧烷),可用______洗去;
| A.NaOH溶液 | B.纯碱溶液 | C.稀硫酸 | D.酒精 |
(3)用Zn粉还原
 的化学反应方程式为
的化学反应方程式为(4)试剂1为
(5)加入过其铁粉的原因是
(6)滤渣2溶于试剂2的原因是
(7)金属铜的晶胞结构如图所示,铜原子之间的最小距离为apm,则铜晶胞的密度为
 (
( 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
您最近一年使用:0次
名校
5 . 下列解释不正确的是
| 选项 | 物质的结构或性质或者实验目的 | 解释 |
| A | 键角: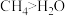 | CH4中C原子与H2O中O原子杂化不同 |
| B | CH4、SiH4、GeH4熔点逐渐升高 | 相对分子质量逐渐增大 |
| C | 一氟乙酸的 大于一溴乙酸 大于一溴乙酸 |  的电负性比 的电负性比 的大 的大 |
| D | 水中溶解性;苯<吡啶( | 吡啶能与水形成分子间氢键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
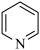
6 . 尿素 可与正烷烃形成超分子,原理如图所示。下列说法错误的是
可与正烷烃形成超分子,原理如图所示。下列说法错误的是
 可与正烷烃形成超分子,原理如图所示。下列说法错误的是
可与正烷烃形成超分子,原理如图所示。下列说法错误的是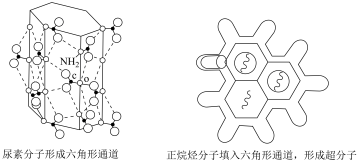
| A.尿素分子中各元素的电负性:O>N>C>H |
| B.尿素分子通过分子间氢键形成六角形通道结构 |
| C.依据分子直径的大小差异可分离同碳数正烷烃和支链烷烃 |
| D.该超分子能稳定存在的原因是尿素分子和正烷烃分子通过共价键结合使能量降低、熵减小 |
您最近一年使用:0次
2024-04-18更新
|
152次组卷
|
2卷引用:2024届”3+3+3“高考备考诊断性联考卷(二)理综试题-高中化学
解题方法
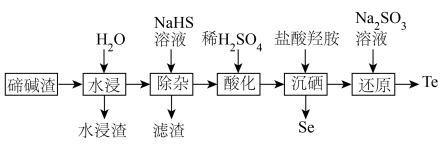
7 . 硒、碲广泛应用于传感、光学器件、红外探测等领域。以下是利用碲碱渣(主要含Na2TeO3、Na2SeO3,还有微量的Cu2+、Pb2+及部分不溶性杂质)为原料分离硒、回收碲的流程图:
已知:① 时溶度积常数:
时溶度积常数:
②当c(Mn+)≤1.0×10-5mol/L时认为 离子已经沉淀完全
离子已经沉淀完全
③盐酸羟胺(NH2OH·HCl)是一种还原剂,其氧化产物是
回答下列问题:
(1)基态硒原子的价电子排布式为___________ ,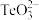 的中心原子的孤电子对数为
的中心原子的孤电子对数为___________ 。
(2)当 完全沉淀时,
完全沉淀时, 的浓度≤
的浓度≤___________ mol/L。
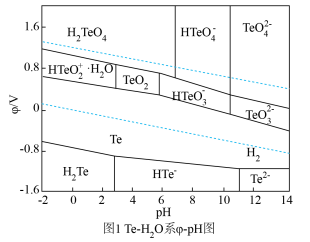
(3)下图是Te—H2O系电位(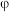 )—pH图,“酸化”步骤中,当pH为5时,在体系中Te(Ⅳ)主要以
)—pH图,“酸化”步骤中,当pH为5时,在体系中Te(Ⅳ)主要以___________ 形式存在,Te(Ⅳ)可被氧化形成相应的高价Te(Ⅵ)离子,氧化电位随pH值的变化规律为___________ 。
(4)“沉硒”步骤中加入盐酸羟胺,反应的化学方程式为___________ 。
(5)工业上可用电解法制备高纯碲,同时回收工业造纸废液中的NaOH,工作原理如图所示,装置中采用___________ 离子交换膜(填“阳”或“阴”),写出B电极的电极反应式___________ ,若电解8小时,获得1.28吨高纯碲,则电流强度I=___________ C·h-1(已知:一个电子的电荷量e=1.6×10-19C,用含NA的式子表示)。


已知:①
 时溶度积常数:
时溶度积常数:
②当c(Mn+)≤1.0×10-5mol/L时认为
 离子已经沉淀完全
离子已经沉淀完全③盐酸羟胺(NH2OH·HCl)是一种还原剂,其氧化产物是

回答下列问题:
(1)基态硒原子的价电子排布式为
 的中心原子的孤电子对数为
的中心原子的孤电子对数为(2)当
 完全沉淀时,
完全沉淀时, 的浓度≤
的浓度≤(3)下图是Te—H2O系电位(
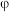 )—pH图,“酸化”步骤中,当pH为5时,在体系中Te(Ⅳ)主要以
)—pH图,“酸化”步骤中,当pH为5时,在体系中Te(Ⅳ)主要以
(4)“沉硒”步骤中加入盐酸羟胺,反应的化学方程式为
(5)工业上可用电解法制备高纯碲,同时回收工业造纸废液中的NaOH,工作原理如图所示,装置中采用

您最近一年使用:0次
8 . 某种双核钴配合物阳离子的结构如图。X的第一电离能在第二周期主族元素中位居第二,Y的核外电子只有一种运动状态,Z的一种同素异形体是极性分子。下列说法错误的是
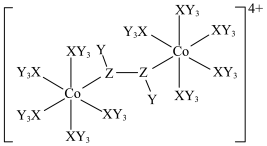
| A.简单氢化物的稳定性:Z>X |
| B.电负性:Z>X>Y |
| C.Co位于元素周期表ds区,在该阳离子中呈+2价 |
| D.从结构推测该配合物阳离子不稳定,且具有一定的氧化性 |
您最近一年使用:0次
2024-04-02更新
|
575次组卷
|
4卷引用:2024届东北三省三校高三下学期第二次联合模拟考试理综重组卷-高中化学
9 . 硒化锌(ZnSe)常用作荧光粉、电子工业掺杂材料和高纯试剂,也是一种重要的半导体材料。其中以锌矿(主要成分是ZnS,含少量 、CuS、NiS、
、CuS、NiS、 等)为原料制备ZnSe的工艺流程如下图所示:
等)为原料制备ZnSe的工艺流程如下图所示:
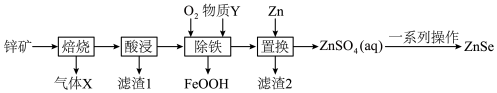
已知:pH较高时,FeOOH沉淀会转化成胶体。
(1)Se元素在周期表中的位置是_______ ,基态Zn原子的价层电子排布式为_______ 。
(2)写出气体X的一种用途_______ 。
(3)浸出液中含有 ,“除铁”步骤中通入氧气时发生反应的离子方程式为
,“除铁”步骤中通入氧气时发生反应的离子方程式为_______ ,同时需补充适量物质Y,Y是_______ (写出一种即可)。“除铁”最佳pH为3.0,如果pH过高,会导致溶液中 的含量降低,其主要原因是
的含量降低,其主要原因是_______ 。
(4)“置换”时滤渣2的主要成分为_______ 。也可以在酸性含 的溶液中加入锌粉和
的溶液中加入锌粉和 ,生成
,生成 ,其离子方程式为
,其离子方程式为_______ 。
(5) 晶体与NaCl晶体的结构相似,
晶体与NaCl晶体的结构相似, 晶胞为正方体,边长为apm。其结构如图所示:
晶胞为正方体,边长为apm。其结构如图所示:
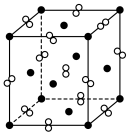
晶胞的密度ρ=_______ g· 列出计算式,阿伏加德罗常数的值为
列出计算式,阿伏加德罗常数的值为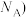 。
。
 、CuS、NiS、
、CuS、NiS、 等)为原料制备ZnSe的工艺流程如下图所示:
等)为原料制备ZnSe的工艺流程如下图所示:
已知:pH较高时,FeOOH沉淀会转化成胶体。
(1)Se元素在周期表中的位置是
(2)写出气体X的一种用途
(3)浸出液中含有
 ,“除铁”步骤中通入氧气时发生反应的离子方程式为
,“除铁”步骤中通入氧气时发生反应的离子方程式为 的含量降低,其主要原因是
的含量降低,其主要原因是(4)“置换”时滤渣2的主要成分为
 的溶液中加入锌粉和
的溶液中加入锌粉和 ,生成
,生成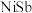 ,其离子方程式为
,其离子方程式为(5)
 晶体与NaCl晶体的结构相似,
晶体与NaCl晶体的结构相似, 晶胞为正方体,边长为apm。其结构如图所示:
晶胞为正方体,边长为apm。其结构如图所示:
晶胞的密度ρ=
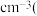 列出计算式,阿伏加德罗常数的值为
列出计算式,阿伏加德罗常数的值为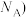 。
。
您最近一年使用:0次
名校
解题方法
10 . 碲具有独特的理化性质,被广泛应用于军工、航天、石油化工、冶金等领域。从碲铜渣[主要成分为 ,含Bi(Ⅲ)、Sb(Ⅲ)、Pb(Ⅱ)、Se等杂质]中分离提纯碲的一种流程如下图所示。
,含Bi(Ⅲ)、Sb(Ⅲ)、Pb(Ⅱ)、Se等杂质]中分离提纯碲的一种流程如下图所示。
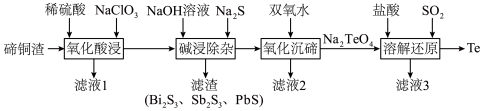
回答下列问题:
(1)“氧化酸浸”时,
 发生反应生成难溶的
发生反应生成难溶的 ,该反应的化学方程式为
,该反应的化学方程式为(2)已知“碱浸除杂”所得浸出液中硒和碲的化合价相同,“氧化沉碲”的目的是利用钠盐的溶解性差异分离硒和碲,推测滤液2中硒的存在形式是
 表面吸附的杂质,将其置于氢氧化钠溶液中进行常温漂洗,漂洗液与滤液2合并,经煮沸后可返回上述流程中的
表面吸附的杂质,将其置于氢氧化钠溶液中进行常温漂洗,漂洗液与滤液2合并,经煮沸后可返回上述流程中的(3)
 在“溶解还原”工序中生成单质Te的总反应的离子方程式为
在“溶解还原”工序中生成单质Te的总反应的离子方程式为(4)滤液1、2、3中,含铜量较高,可用于回收铜的是
(5)碲是第五周期氧族元素,其基态原子的价层电子排布式为
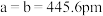 、
、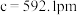 ,
, ,
,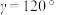 ,碲晶体的密度为
,碲晶体的密度为 (列出计算式即可)。
(列出计算式即可)。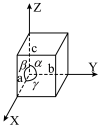
您最近一年使用:0次

 )
)

