1 . 某种双核钴配合物阳离子的结构如图。X的第一电离能在第二周期主族元素中位居第二,Y的核外电子只有一种运动状态,Z的一种同素异形体是极性分子。下列说法错误的是
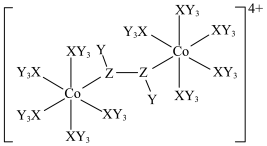
| A.简单氢化物的稳定性:Z>X |
| B.电负性:Z>X>Y |
| C.Co位于元素周期表ds区,在该阳离子中呈+2价 |
| D.从结构推测该配合物阳离子不稳定,且具有一定的氧化性 |
您最近一年使用:0次
2024-04-02更新
|
609次组卷
|
4卷引用:2024届东北三省三校高三下学期第二次联合模拟考试理综重组卷-高中化学
2 . 硒化锌(ZnSe)常用作荧光粉、电子工业掺杂材料和高纯试剂,也是一种重要的半导体材料。其中以锌矿(主要成分是ZnS,含少量 、CuS、NiS、
、CuS、NiS、 等)为原料制备ZnSe的工艺流程如下图所示:
等)为原料制备ZnSe的工艺流程如下图所示:
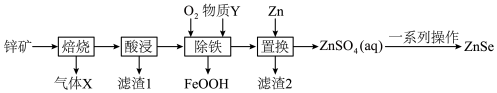
已知:pH较高时,FeOOH沉淀会转化成胶体。
(1)Se元素在周期表中的位置是_______ ,基态Zn原子的价层电子排布式为_______ 。
(2)写出气体X的一种用途_______ 。
(3)浸出液中含有 ,“除铁”步骤中通入氧气时发生反应的离子方程式为
,“除铁”步骤中通入氧气时发生反应的离子方程式为_______ ,同时需补充适量物质Y,Y是_______ (写出一种即可)。“除铁”最佳pH为3.0,如果pH过高,会导致溶液中 的含量降低,其主要原因是
的含量降低,其主要原因是_______ 。
(4)“置换”时滤渣2的主要成分为_______ 。也可以在酸性含 的溶液中加入锌粉和
的溶液中加入锌粉和 ,生成
,生成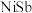 ,其离子方程式为
,其离子方程式为_______ 。
(5) 晶体与NaCl晶体的结构相似,
晶体与NaCl晶体的结构相似, 晶胞为正方体,边长为apm。其结构如图所示:
晶胞为正方体,边长为apm。其结构如图所示:
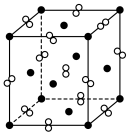
晶胞的密度ρ=_______ g·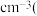 列出计算式,阿伏加德罗常数的值为
列出计算式,阿伏加德罗常数的值为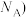 。
。
 、CuS、NiS、
、CuS、NiS、 等)为原料制备ZnSe的工艺流程如下图所示:
等)为原料制备ZnSe的工艺流程如下图所示:
已知:pH较高时,FeOOH沉淀会转化成胶体。
(1)Se元素在周期表中的位置是
(2)写出气体X的一种用途
(3)浸出液中含有
 ,“除铁”步骤中通入氧气时发生反应的离子方程式为
,“除铁”步骤中通入氧气时发生反应的离子方程式为 的含量降低,其主要原因是
的含量降低,其主要原因是(4)“置换”时滤渣2的主要成分为
 的溶液中加入锌粉和
的溶液中加入锌粉和 ,生成
,生成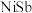 ,其离子方程式为
,其离子方程式为(5)
 晶体与NaCl晶体的结构相似,
晶体与NaCl晶体的结构相似, 晶胞为正方体,边长为apm。其结构如图所示:
晶胞为正方体,边长为apm。其结构如图所示:
晶胞的密度ρ=
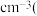 列出计算式,阿伏加德罗常数的值为
列出计算式,阿伏加德罗常数的值为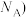 。
。
您最近一年使用:0次
名校
解题方法
3 . 碲具有独特的理化性质,被广泛应用于军工、航天、石油化工、冶金等领域。从碲铜渣[主要成分为 ,含Bi(Ⅲ)、Sb(Ⅲ)、Pb(Ⅱ)、Se等杂质]中分离提纯碲的一种流程如下图所示。
,含Bi(Ⅲ)、Sb(Ⅲ)、Pb(Ⅱ)、Se等杂质]中分离提纯碲的一种流程如下图所示。
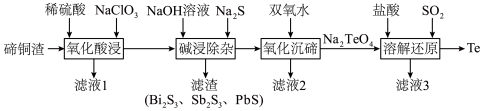
回答下列问题:
(1)“氧化酸浸”时,
 发生反应生成难溶的
发生反应生成难溶的 ,该反应的化学方程式为
,该反应的化学方程式为(2)已知“碱浸除杂”所得浸出液中硒和碲的化合价相同,“氧化沉碲”的目的是利用钠盐的溶解性差异分离硒和碲,推测滤液2中硒的存在形式是
 表面吸附的杂质,将其置于氢氧化钠溶液中进行常温漂洗,漂洗液与滤液2合并,经煮沸后可返回上述流程中的
表面吸附的杂质,将其置于氢氧化钠溶液中进行常温漂洗,漂洗液与滤液2合并,经煮沸后可返回上述流程中的(3)
 在“溶解还原”工序中生成单质Te的总反应的离子方程式为
在“溶解还原”工序中生成单质Te的总反应的离子方程式为(4)滤液1、2、3中,含铜量较高,可用于回收铜的是
(5)碲是第五周期氧族元素,其基态原子的价层电子排布式为
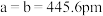 、
、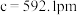 ,
, ,
,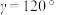 ,碲晶体的密度为
,碲晶体的密度为 (列出计算式即可)。
(列出计算式即可)。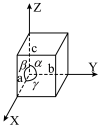
您最近一年使用:0次
名校
4 . 按要求完成下列小题。
(1)Cu2+基态核外电子排布式为_______ 。
(2)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①基态Mn原子未成对的电子数为_______ 。
②第三电离能I3(Fe)<I3(Mn),原因是_______ 。
(3)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为_______
②H2O分子的空间结构分别是_______ ,键角H2O_______ NH3。(填>、<或=)
(1)Cu2+基态核外电子排布式为
(2)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①基态Mn原子未成对的电子数为
②第三电离能I3(Fe)<I3(Mn),原因是
(3)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为
②H2O分子的空间结构分别是
您最近一年使用:0次
5 . N、P、As为第VA族元素,该族元素及其化合物在生产、生活中有广泛应用。回答下列问题:
(1)基态As原子核外有______ 个未成对电子,N、P、As电负性由大到小的顺序为______ 。
(2)已知:4AsH3 As4+6H2↑,AsH3的空间结构为
As4+6H2↑,AsH3的空间结构为______ ,已知As4为正四面体结构,则1molAs4中含______ molσ键。
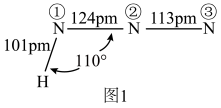
(3)氨、肼(N2H4)和叠氮酸(HN3)都是氮元素的重要氢化物,肼的相对分子质量与乙烷(C2H6)接近,但沸点远高于乙烷的原因是______ 。叠氮酸的结构如图1所示,分子中②号N原子的杂化方式为_______ 。_______ ,该晶体的密度为______ g cm3。
cm3。
(1)基态As原子核外有
(2)已知:4AsH3
 As4+6H2↑,AsH3的空间结构为
As4+6H2↑,AsH3的空间结构为(3)氨、肼(N2H4)和叠氮酸(HN3)都是氮元素的重要氢化物,肼的相对分子质量与乙烷(C2H6)接近,但沸点远高于乙烷的原因是
 cm3。
cm3。
您最近一年使用:0次
2024-03-20更新
|
167次组卷
|
2卷引用:云南省文山州广南县第十中学校2023-2024学年高二下学期3月考试化学试题
名校
6 . 香花石是我国地质学家发现的新矿物,其化学式为 。已知X、Y、Z、W、M、N为原子序数依次增大的前20号元素;其中X、Y、N为金属元素,且Y与N同主族;Z原子的s能级电子总数等于P能级的电子总数,W原子核外有1个未成对电子,M的最外层电子数是最内层的2倍。下列说法正确的是
。已知X、Y、Z、W、M、N为原子序数依次增大的前20号元素;其中X、Y、N为金属元素,且Y与N同主族;Z原子的s能级电子总数等于P能级的电子总数,W原子核外有1个未成对电子,M的最外层电子数是最内层的2倍。下列说法正确的是
 。已知X、Y、Z、W、M、N为原子序数依次增大的前20号元素;其中X、Y、N为金属元素,且Y与N同主族;Z原子的s能级电子总数等于P能级的电子总数,W原子核外有1个未成对电子,M的最外层电子数是最内层的2倍。下列说法正确的是
。已知X、Y、Z、W、M、N为原子序数依次增大的前20号元素;其中X、Y、N为金属元素,且Y与N同主族;Z原子的s能级电子总数等于P能级的电子总数,W原子核外有1个未成对电子,M的最外层电子数是最内层的2倍。下列说法正确的是A.原子半径: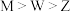 | B.第一电离能: |
C.电负性: | D.简单氢化物的沸点: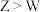 |
您最近一年使用:0次
2024-03-19更新
|
489次组卷
|
4卷引用:云南省文山州广南县第十中学校2023-2024学年高二下学期3月考试化学试题
7 . 下列有关说法正确的是
A.元素的电负性: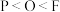 |
B.因为二氧化硅的相对分子质量比二氧化碳大,所以沸点: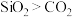 |
C. 、 、 、 、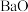 三种离子晶体的熔点: 三种离子晶体的熔点: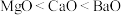 |
D.稳定性: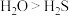 ,是因为水分子间存在氢键的缘故 ,是因为水分子间存在氢键的缘故 |
您最近一年使用:0次
名校
8 . 短周期元素组成的化合物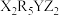 和
和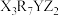 ,相对分子质量相差14,质子数相差8,都能与盐酸或氢氧化钠反应生成盐,其中
,相对分子质量相差14,质子数相差8,都能与盐酸或氢氧化钠反应生成盐,其中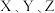 位于同周期。下列说法正确的是
位于同周期。下列说法正确的是
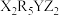 和
和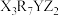 ,相对分子质量相差14,质子数相差8,都能与盐酸或氢氧化钠反应生成盐,其中
,相对分子质量相差14,质子数相差8,都能与盐酸或氢氧化钠反应生成盐,其中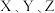 位于同周期。下列说法正确的是
位于同周期。下列说法正确的是A.原子半径: |
B.电负性: |
C.最高价氧化物对应水化物的酸性: |
| D.X和Z都存在同素异形体 |
您最近一年使用:0次
名校
9 . 2023年的诺贝尔化学奖授予了“发现和合成量子点”的三位科学家。下图是一种量子点的结构,下列说法不正确的是

A.基态原子第一电离能: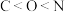 |
B.基态Se原子的价层电子排布式为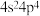 |
| C.该结构中C和N原子轨道的杂化类型相同 |
D.该结构中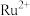 提供空轨道,N原子提供孤电子对 提供空轨道,N原子提供孤电子对 |
您最近一年使用:0次
2024-02-25更新
|
188次组卷
|
2卷引用:云南省保山市2023-2024学年高三上学期期末质量监测理综化学试题
10 . 元素周期表被认为是“科学共同的语言”,它的发现使化学学习和研究变得有规律可循。其简洁有序的背后,是众多科学家艰苦奋斗的结果。下图是元素周期表的一部分,请按要求回答下列问题:

(1)317年左右,东晋炼丹家葛洪在炼丹时分离出了砷。砷的原子结构示意图为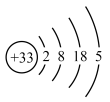 ,砷在周期表中的位置是
,砷在周期表中的位置是___________ 。我国“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。原子半径:Ga___________ As(填“>”或“<”)。
(2)1787年,法国化学家拉瓦锡首次发现硅存在于岩石中。硅元素位于元素周期表金属与非金属的分界处,请写出硅单质的一种用途___________ 。
(3)1817年瑞典化学家贝采利乌斯发现硒元素。硫化硒(SeS)可用于治疗脂溢性皮炎。硫元素和硒元素简单气态氢化物热稳定性较强的为___________ (填化学式)。
(4)1825年,丹麦化学家奥斯特首次分离出了铝的单质。铝是地壳中含量最高的金属元素,但铝的利用却比铜和铁晚得多,可能的原因是___________ 。
(5)目前,世界上还有许多科学家为发现新元素孜孜不倦地努力着。可能存在的第119号元素,有人称“类钫”,位于元素周期表第八周期ⅠA族,有关“类钫”的预测说法正确的是
(6)小赵同学在研究元素周期表时发现,碳元素有“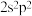 ”这一信息,观察元素周期表后,寻找规律,推测某元素“
”这一信息,观察元素周期表后,寻找规律,推测某元素“ ”中
”中 可能的含义是
可能的含义是___________ 。

(1)317年左右,东晋炼丹家葛洪在炼丹时分离出了砷。砷的原子结构示意图为
 ,砷在周期表中的位置是
,砷在周期表中的位置是(2)1787年,法国化学家拉瓦锡首次发现硅存在于岩石中。硅元素位于元素周期表金属与非金属的分界处,请写出硅单质的一种用途
(3)1817年瑞典化学家贝采利乌斯发现硒元素。硫化硒(SeS)可用于治疗脂溢性皮炎。硫元素和硒元素简单气态氢化物热稳定性较强的为
(4)1825年,丹麦化学家奥斯特首次分离出了铝的单质。铝是地壳中含量最高的金属元素,但铝的利用却比铜和铁晚得多,可能的原因是
(5)目前,世界上还有许多科学家为发现新元素孜孜不倦地努力着。可能存在的第119号元素,有人称“类钫”,位于元素周期表第八周期ⅠA族,有关“类钫”的预测说法正确的是
| A.“类钫”在化合物中显+1价 |
| B.“类钫”单质具有强氧化性 |
| C.“类钫”最高价氧化物对应的水化物为弱碱 |
| D.“类钫”单质能与冷水剧烈反应 |
(6)小赵同学在研究元素周期表时发现,碳元素有“
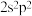 ”这一信息,观察元素周期表后,寻找规律,推测某元素“
”这一信息,观察元素周期表后,寻找规律,推测某元素“ ”中
”中 可能的含义是
可能的含义是
您最近一年使用:0次



