名校
解题方法
1 . SiH4与NH3制备氮化硅(熔点1900℃)的反应为 ,下列说法错误的是
,下列说法错误的是
 ,下列说法错误的是
,下列说法错误的是| A.熔点:单晶硅>氮化硅 | B.未成对电子数:Si<N |
| C.键角:SiH4>NH3 | D.NH3是由极性键构成的三角锥形分子 |
您最近一年使用:0次
名校
解题方法
2 . 我们的生活离不开材料。我国在新材料领域的研究有了较大的发展,“卡脖子”的技术问题取得了许多方面的突破,新材料的发展也将由原材料、基础化工材料逐步过渡到新型材料、半导体材料、新能量材料、节能材料等中。“天宫”空间站使用的材料中含有Li、Be、B、C、N、O、Al、Fe、Co、Ni、Cu、Zn等元素。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是_______ (填标号,下同),用光谱仪可捕捉到发射光谱的是_______ 。
A.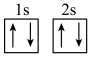 B.
B. 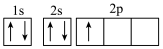
C.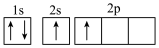 D.
D. 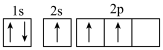
(2)Be、B、C、N、O的第一电离能由大到小的顺序是_______ 。(用元素符号表示)
(3)Cu与Zn相比,第二电离能与第一电离能差值更大的是_______ ,原因是_______ 。
(4)第四周期基态原子中未配对电子数最多的原子的价电子轨道表示式_______ 。
(5)FeSO4·7H2O的结构如下图所示。
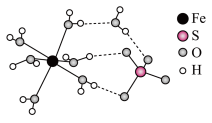
①FeSO4·7H2O中H2O与Fe2+的作用力类型是_______ 。
②H2O中O和SO 中S均为sp3杂化,H2O中
中S均为sp3杂化,H2O中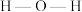 的键角
的键角_______ SO 中的
中的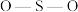 键角(填“>”“<”或“=”)。
键角(填“>”“<”或“=”)。
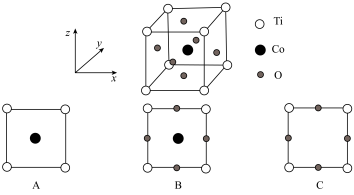
(6)一种掺钴催化剂的晶胞如图所示,则该晶体沿z轴的投影图为_______ (填标号),设阿伏加德罗常数的值为NA,晶胞参数为anm,则该晶胞的密度为_______ g•cm (用含a、NA的代数式表示)。
(用含a、NA的代数式表示)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A.
 B.
B. 
C.
 D.
D. 
(2)Be、B、C、N、O的第一电离能由大到小的顺序是
(3)Cu与Zn相比,第二电离能与第一电离能差值更大的是
(4)第四周期基态原子中未配对电子数最多的原子的价电子轨道表示式
(5)FeSO4·7H2O的结构如下图所示。

①FeSO4·7H2O中H2O与Fe2+的作用力类型是
②H2O中O和SO
 中S均为sp3杂化,H2O中
中S均为sp3杂化,H2O中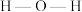 的键角
的键角 中的
中的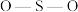 键角(填“>”“<”或“=”)。
键角(填“>”“<”或“=”)。(6)一种掺钴催化剂的晶胞如图所示,则该晶体沿z轴的投影图为
 (用含a、NA的代数式表示)。
(用含a、NA的代数式表示)。
您最近一年使用:0次
名校
解题方法
3 . 硼元素的某种氢化物能与NH3作用得到化合物M,M是一种新的储氢材料,加热M会缓慢释放出H2,并转化为化合物N,M、N分别与乙烷、乙烯的结构相似。下列有关说法正确的是
| A.基态11B原子中,核外存在2对自旋相反的电子,有5种不同空间运动状态的电子 |
| B.M分子中存在配位键,B原子的杂化类型为sp2杂化 |
| C.M分子能与水分子之间形成氢键 |
| D.N分子中的π键和σ键数目之比为5:1 |
您最近一年使用:0次
4 . B、N、F、Ti、Fe、As、Se等元素及其化合物的研究对工农业生产意义重大,回答下列问题:
(1)写出Ti基态原子的电子排布式_____ 。
(2)基态Fe2+与Fe3+离子中未成对的电子数之比为_____ 。
(3)VIA族元素中O、S、Se的电负性由大到小的顺序为_____ 。
(4)BF3的空间构型为_____ ;其中B原子采用_____ 杂化,根据对角线规则,B的一些化学性质与元素_____ 的相似。
(5)元素As与N同族。As的氢化物的沸点比NH3的_____ (填“高”或“低”),其判断理由是_____ 。
(1)写出Ti基态原子的电子排布式
(2)基态Fe2+与Fe3+离子中未成对的电子数之比为
(3)VIA族元素中O、S、Se的电负性由大到小的顺序为
(4)BF3的空间构型为
(5)元素As与N同族。As的氢化物的沸点比NH3的
您最近一年使用:0次
2023-05-04更新
|
284次组卷
|
2卷引用:云南省丽江市2022-2023学年高二上学期期末考试化学试题
2023·全国·模拟预测
名校
5 . 短周期主族元素X、Y、Z、W的原子序数依次增大,其中基态X原子核外电子只有一种运动状态,Y、Z、W位于X的下一周期,四种元素形成的化合物(结构如图)可用于检验 ;M位于元素周期表第四周期第VIII族,且基态M原子价层含有2个未成对电子。下列说法正确的是
;M位于元素周期表第四周期第VIII族,且基态M原子价层含有2个未成对电子。下列说法正确的是

 ;M位于元素周期表第四周期第VIII族,且基态M原子价层含有2个未成对电子。下列说法正确的是
;M位于元素周期表第四周期第VIII族,且基态M原子价层含有2个未成对电子。下列说法正确的是
| A.原子半径:X<Y<Z<W |
| B.第一电离能:Y<W<Z |
| C.电负性:Y<W<Z |
| D.基态M原子核外电子占据最高能级的电子云轮廓图为哑铃形 |
您最近一年使用:0次
2023-04-21更新
|
553次组卷
|
4卷引用:云南师范大学附属中学2023-2024学年高二上学期10月月考化学试题
云南师范大学附属中学2023-2024学年高二上学期10月月考化学试题(已下线)2023年普通高中学业水平选择性考试化学押题卷(一)河南省南阳市第一中学校2022-2023学年高二下学期5月月考化学试题福建省厦门第二中学2022-2023学年高二下学期5月月考化学试题
解题方法
6 . X、Y、Z、W是原子序数依次增大的前四周期元素,X元素的简单氢化物能与其最高价氧化物对应水化物反应生成盐; Y元素原子的核外电子只有8种运动状态;Z为短周期金属元素,其简单离子的半径在同周期中最小;基态W原子的未成对电子数为6。下列说法错误的是
| A.第一电离能: X>Y> Z |
B.键角 > > |
| C.W为第四周期d区元素 |
| D.X和Y的最简单气态氢化物中,前者更易液化 |
您最近一年使用:0次
名校
7 . 抗癌药阿霉素与环糊精在水溶液中形成超分子包合物,增大了阿霉素的水溶性,控制了阿霉素的释放速度,从而提高其药效。下列说法错误的是

| A.阿霉素分子中碳原子的杂化方式为sp2、sp3 |
| B.红外光谱法可推测阿霉素分子中的官能团 |
| C.阿霉素分子含有羟基、羧基和氨基 |
| D.阿霉素分子中,基态原子的第一电离能最大的元素为N |
您最近一年使用:0次
2023-04-03更新
|
1950次组卷
|
11卷引用:云南省凤庆县第一中学2022-2023学年高二下学期期中考试化学试题
云南省凤庆县第一中学2022-2023学年高二下学期期中考试化学试题黑龙江省哈尔滨第三中学2023届高三第二次模拟考试化学试题山东省菏泽市曹县第一中学2022-2023学年高二下学期3月月考化学试题 湖南省邵东市第一中学2022-2023学年高二下学期4月期中考试化学试题辽宁省凌源市实验中学2022-2023学年高二下学期4月月考化学试题广东省潮州市2022-2023学年高二下学期期末考试化学试题河南省焦作市博爱县第一中学2022-2023学年高二下学期6月期末考试化学试题辽宁省大连市第八中学2022-2023学年高二4月阶段测试化学试题湖南省长沙市雅礼中学2024届高三上学期月考试卷(一)化学试题辽宁省丹东市凤城市第一中学2023-2024学年高二下学期4月月考化学试题湖南省平江县颐华高级中学2023-2024学年高三下学期入学考试化学试题
名校
解题方法
8 . 结合物质结构与性质相关知识,回答下列问题。
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为_______ 。
(2) 分子中的N原子杂化类型为
分子中的N原子杂化类型为_______ ,分子的空间构型为_______ ,属于_______ (填“极性”或“非极性”)分子。
(3)吡啶(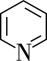 )在水中的溶解度远大于苯,可能原因是①吡啶和
)在水中的溶解度远大于苯,可能原因是①吡啶和 均为极性分子相似相溶,而苯为非极性分子;②
均为极性分子相似相溶,而苯为非极性分子;②_______ 。
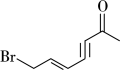
(4)①如图所示,该有机物中 和
和 键的数目比为
键的数目比为_______ 。
②比较 、P、S的第一电离能的大小:
、P、S的第一电离能的大小:_______ (从大到小排序)。
(5)钛的某配合物可用于催化环烯烃聚合,其结构如图所示:
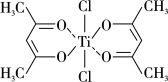
该配合物中存在的化学键有_______ (填序号)。
a.离子键 b.配位键 c.金属键 d.共价键 e.氢键
(6)氮化钛晶体的晶胞结构如图所示,该晶体结构中所含N、 原子个数比为
原子个数比为_______ 。

(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为(2)
 分子中的N原子杂化类型为
分子中的N原子杂化类型为(3)吡啶(
 )在水中的溶解度远大于苯,可能原因是①吡啶和
)在水中的溶解度远大于苯,可能原因是①吡啶和 均为极性分子相似相溶,而苯为非极性分子;②
均为极性分子相似相溶,而苯为非极性分子;②(4)①如图所示,该有机物中
 和
和 键的数目比为
键的数目比为
②比较
 、P、S的第一电离能的大小:
、P、S的第一电离能的大小:(5)钛的某配合物可用于催化环烯烃聚合,其结构如图所示:

该配合物中存在的化学键有
a.离子键 b.配位键 c.金属键 d.共价键 e.氢键
(6)氮化钛晶体的晶胞结构如图所示,该晶体结构中所含N、
 原子个数比为
原子个数比为
您最近一年使用:0次
2023-04-01更新
|
269次组卷
|
3卷引用:云南省保山市高(完)中C、D类学校2022~2023学年高二下学期3月份联考化学试题
9 . 配合物XY(ZW)5的结构如图所示,Y位于第四周期且基态原子中含5个单电子,Z与W位于第二周期的p区,ZW结构与N2相似,Z的电负性小于W。下列说法错误的是
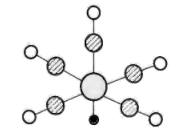

| A.第一电离能: W>Z |
| B.XY(ZW)5中Y的配位数是5 |
| C.W3的熔点低于YW2 |
| D.Z的某种同素异形体具有良好导电性,其中Z原子的杂化方式均为sp2 |
您最近一年使用:0次
名校
解题方法
10 . 卡塔尔世界杯是2022年全球范围内的体育盛事。世界杯中有不少化学材料的应用,如卡塔尔世界杯比赛用球“Al Rihla”外皮由20块无缝的热黏合聚氨酯板制成。在场馆建筑领域更是离不开中国设计与中国钢材料,如卡塔尔世界杯卢塞尔体育场的“钢筋铁骨”。
(1)聚氨酯,又称聚氨基甲酸酯,简称“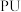 ”,是指主链中含有氨基甲酸酯特征单元(
”,是指主链中含有氨基甲酸酯特征单元(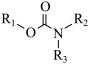 )的一类高分子化合物。基态O原子的价层电子轨道表示式为
)的一类高分子化合物。基态O原子的价层电子轨道表示式为_______ ,基态N原子核外电子的空间运动状态有_______ 种。
(2)氨基甲酸甲酯(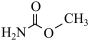 )可由氯代甲酸甲酯(
)可由氯代甲酸甲酯( )与氨制得,氨基甲酸甲酯易溶于水。
)与氨制得,氨基甲酸甲酯易溶于水。
①氨基甲酸甲酯中碳原子的杂化类型为_______ 。
②解释氨基甲酸甲酯易溶于水的主要原因:_______ 。
(3)为提高中国钢材料的性能,往往会在钢材料中添加锰和钴元素。 与
与 元素均能形成八面体的五氨基配合物
元素均能形成八面体的五氨基配合物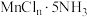 和
和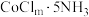 。已知
。已知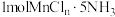 和
和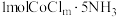 分别与足量
分别与足量 溶液反应生成
溶液反应生成 和
和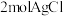 。则配合物中
。则配合物中
_______ ,
_______ 。
(4)铁有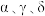 三种典型的立方体晶胞,其中
三种典型的立方体晶胞,其中 型的立方晶胞如图所示。
型的立方晶胞如图所示。
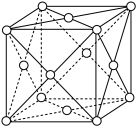
①该晶胞中含有的 原子数为
原子数为_______ 。
②若该晶胞边长为 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为_______  。
。
(1)聚氨酯,又称聚氨基甲酸酯,简称“
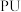 ”,是指主链中含有氨基甲酸酯特征单元(
”,是指主链中含有氨基甲酸酯特征单元( )的一类高分子化合物。基态O原子的价层电子轨道表示式为
)的一类高分子化合物。基态O原子的价层电子轨道表示式为(2)氨基甲酸甲酯(
 )可由氯代甲酸甲酯(
)可由氯代甲酸甲酯( )与氨制得,氨基甲酸甲酯易溶于水。
)与氨制得,氨基甲酸甲酯易溶于水。①氨基甲酸甲酯中碳原子的杂化类型为
②解释氨基甲酸甲酯易溶于水的主要原因:
(3)为提高中国钢材料的性能,往往会在钢材料中添加锰和钴元素。
 与
与 元素均能形成八面体的五氨基配合物
元素均能形成八面体的五氨基配合物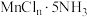 和
和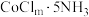 。已知
。已知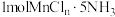 和
和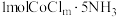 分别与足量
分别与足量 溶液反应生成
溶液反应生成 和
和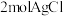 。则配合物中
。则配合物中

(4)铁有
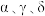 三种典型的立方体晶胞,其中
三种典型的立方体晶胞,其中 型的立方晶胞如图所示。
型的立方晶胞如图所示。
①该晶胞中含有的
 原子数为
原子数为②若该晶胞边长为
 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 。
。
您最近一年使用:0次
2023-03-18更新
|
315次组卷
|
4卷引用:云南省昆明师范专科学校附属中学2022-2023学年高二下学期4月月考化学试题
云南省昆明师范专科学校附属中学2022-2023学年高二下学期4月月考化学试题河南省洛阳市创新发展联盟2022-2023学年高二下学期3月联考化学试题(已下线)河南省湘豫名校2023届高三下学期第一次模拟化学试题变式题(结构与性质)陕西省西安中学2023-2024学年高三上学期8月月考化学试题



