2018高三上·全国·专题练习
名校
1 . 人们通常将在同一原子轨道上运动、自旋方向相反的2个电子,称为“电子对”,将在某一原子轨道上运动的单个电子,称为“未成对电子”。下列基态原子的电子排布式中,未成对电子数最多的是
| A.1s22s22p63s23p6 | B.1s22s22p63s23p63d54s2 |
| C.1s22s22p63s23p63d54s1 | D.1s22s22p63s23p63d104s1 |
您最近一年使用:0次
2018-11-24更新
|
778次组卷
|
16卷引用:云南省昭通市巧家县第四中学2019-2020学年高二上学期期末考试化学试题
云南省昭通市巧家县第四中学2019-2020学年高二上学期期末考试化学试题(已下线)2018年11月22日 《每日一题》人教版一轮复习-原子(或离子)的核外电子排布贵州省习水县一中2018-2019学年高二上学期12月份月考化学试题鲁科版高中化学选修3模块综合测评卷内蒙古包头市包钢第四中学2018-2019学年高二下学期4月月考化学试题辽宁省凌源市第二高级中学2019-2020学年高二第四次网上测试化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题宁夏海原县第一中学2019-2020学年高二下学期期末考试化学试题(已下线)第34讲 原子结构与性质-2021年高考化学一轮复习名师精讲练山西省朔州市怀仁县大地学校2019-2020学年高二下学期期末考试化学试题安徽省蚌埠第三中学2019-2020学年高二下学期期末考试化学试题(已下线)第30讲 原子结构与性质(练) — 2022年高考化学一轮复习讲练测(新教材新高考)云南省玉溪市通海县第二中学2021-2022学年高二上学期12月月考化学试题(已下线)第29讲 原子结构与性质(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第1讲 原子结构 核外电子排布广东省广州市广雅中学2023-2024学年高二下学期学科综合素养评估化学试卷
12-13高二下·河南许昌·阶段练习
名校
2 . 已知某元素的+2价离子的电子排布式为1s22s22p63s23p6,则该元素在周期表中的位置正确的是( )
| A.第三周期ⅣA族,p区 |
| B.第四周期ⅡB族,s区 |
| C.第四周期Ⅷ族,d区 |
| D.第四周期ⅡA族,s区 |
您最近一年使用:0次
2018-09-28更新
|
434次组卷
|
12卷引用:云南省大关县一中2018-2019学年高二上学期12月考试化学试题
云南省大关县一中2018-2019学年高二上学期12月考试化学试题(已下线)2012-2013学年河南省许昌市五校高二下学期第一次联考化学试卷云南省玉溪市华宁二中2018-2019学年9月份考试高二化学试题云南省楚雄州南华县民族中学2018-2019学年高二上学期期中考试化学试题【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二下学期期中考试化学试题新疆疏勒八一中2018-2019学年高二4月月考化学试题云南省元阳县第三中学2019-2020学年高二上学期期末考试化学试题辽宁省朝阳市凌源市2019-2020学年高二下学期期末联考化学试题吉林省松原市扶余市第一中学2019-2020学年高二下学期期中考试化学试题新疆维吾尔自治区喀什巴楚县第一中学2020-2021学年高二上学期第一次月考化学试题四川省平昌县驷马中学2020-2021学年高二上学期10月月考化学试题四川省巴中市平昌县驷马中学2020-2021学年高二上学期 十一月月考化学试题
名校
3 . 为揭示原子光谱是线状光谱这一事实,玻尔提出了核外电子的分层排布理论。下列说法中,不符合这一理论的是( )
| A.电子绕核运动具有特定的半径和能量 |
| B.电子在特定半径的轨道上运动时不辐射能量 |
| C.电子跃迁时,会吸收或放出特定的能量 |
| D.揭示了氢原子光谱存在多条谱线 |
您最近一年使用:0次
2018-09-28更新
|
146次组卷
|
3卷引用:云南省盐津县三中2018-2019学年高二第一学期12月份考试化学试题
名校
4 . 氯元素的原子结构示意图为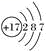 ,下列说法正确的是( )
,下列说法正确的是( )
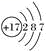 ,下列说法正确的是( )
,下列说法正确的是( )| A.氯原子在化学反应中易失去电子 |
| B.氯原子易得到电子形成稳定的氯离子 |
| C.氯元素的化合价只有-1价 |
| D.氯的原子核外有7个电子 |
您最近一年使用:0次
2018-08-02更新
|
211次组卷
|
9卷引用:云南省盐津县第一中学2020-2021学年高一下学期6月份考试化学试题
云南省盐津县第一中学2020-2021学年高一下学期6月份考试化学试题云南省曲靖市沾益二中2017-2018学年高一下学期期末考试化学试题云南省文山壮族苗族自治州富宁县第二中学2019-2020学年高一上学期期末考试化学试题2020年春季人教版高中化学必修2第一章《物质结构 元素周期律》测试卷广西壮族自治区崇左市扶绥县第二中学2019-2020学年高一上学期期末考试化学试题(已下线)3.1.2 氯气的性质与应用练习(1)——《高中新教材同步备课》(苏教版 必修第一册)湖北省沙市中学2020-2021学年高一上学期期中考试化学(学考)试题云南省玉溪市江川区第二中学2020-2021学年高一下学期期中考试化学试题云南省腾冲市第一中学2021-2022学年高一下学期3月份考试化学试题
名校
5 . 下列各原子或离子的电子排布式错误的是( )
| A.Na+:1s22s22p6 | B.F:1s22s22p5 |
| C.Cl-:1s22s22p63s23p5 | D.Mn:1s22s22p63s23p63d54s2 |
您最近一年使用:0次
2018-06-25更新
|
153次组卷
|
4卷引用:云南省巧家县四中2018-2019学年高二上学期12月份考试化学试题
名校
6 . 有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素。X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子层排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G原子最外电子层只有未成对电子,其内层所有轨道全部充满,但并不是第ⅠA族元素。回答下列问题:
(1)基态G原子的价电子排布式为____________ ,写出第三周期基态原子未成对电子数与G相同且电负性最大的元素是________ (填元素名称)。GQ受热分解生成G2Q和Q2,请从G的原子结构来说明GQ受热易分解的原因:___________________________ 。
(2)Z、Q、M三种元素的第一电离能从大到小的顺序为____________ (用元素符号表示)。
(3)X与Q形成的化合物的化学式为________ 。
(4)Z、M、E所形成的简单离子的半径由大到小顺序为____________ (用离子符号表示)。
(5)X、Y、Z、Q的电负性由大到小的顺序为____________ (用元素符号表示)。
(1)基态G原子的价电子排布式为
(2)Z、Q、M三种元素的第一电离能从大到小的顺序为
(3)X与Q形成的化合物的化学式为
(4)Z、M、E所形成的简单离子的半径由大到小顺序为
(5)X、Y、Z、Q的电负性由大到小的顺序为
您最近一年使用:0次
2018-04-24更新
|
388次组卷
|
11卷引用:云南省昭通市大关县第二中学2019-2020学年高二上学期期末考试化学试题
云南省昭通市大关县第二中学2019-2020学年高二上学期期末考试化学试题宁夏银川市唐徕回民中学2017-2018学年高二4月月考化学试题云南省玉溪市华宁二中2018-2019学年9月份考试高二化学试题四川省遂宁二中2018-2019学年高二上学期半期考试化学试题云南省镇康县第一中学2019-2020学年高二12月月考化学试题云南省陇川县第一中学2019-2020学年高二上学期期末考试化学试题云南省梁河县第一中学2019-2020学年高二上学期期末考试化学试题云南省普洱市普洱第二中学2019—2020学年高二上学期期末考试化学试题贵州省罗甸县第一中学2019-2020学年高二上学期期末考试化学试题安徽省安庆市第一中学2022-2023学年高二下学期第一次月考化学试题安徽省合肥市第一中学2022-2023学年高二下学期第一次质量检测化学试题
解题方法
7 . 有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p轨道的电子数等于次外层的电子总数,B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。根据以上条件,回答下列问题:
(1)画出C的原子结构示意图:________ 。
(2)写出D原子的外围电子排布式:________ 。
(3)写出A元素单质在B中完全燃烧的化学方程式:______________ 。
(4)指出E元素在元素周期表中的位置:____________ 。
(5)比较A、B、C三种元素的第一电离能的大小顺序:________________ (按由大到小的顺序排列,用元素符号表示)。
(6)比较元素D和E的电负性的相对大小:__________ 。
(1)画出C的原子结构示意图:
(2)写出D原子的外围电子排布式:
(3)写出A元素单质在B中完全燃烧的化学方程式:
(4)指出E元素在元素周期表中的位置:
(5)比较A、B、C三种元素的第一电离能的大小顺序:
(6)比较元素D和E的电负性的相对大小:
您最近一年使用:0次
2018-04-06更新
|
299次组卷
|
3卷引用:云南省昭通市永善县第二中学2019—2020学年高二上学期期末考试化学试题
解题方法
8 . 下列各基态原子的核外电子排布表示正确的是( )
| A.钠原子:1s22s22p7 | B.铜原子:1s22s22p63s23p63d94s2 |
| C.铁原子:1s22s22p63s23p63d8 | D.氪原子:1s22s22p63s23p63d104s24p6 |
您最近一年使用:0次
2018-02-15更新
|
420次组卷
|
7卷引用:云南省彝良县民族中学2018-2019学年高二上学期12月份考试化学试题
9 . 第N能层所含能级数、原子轨道数和最多容纳电子数分别为
| A.3、9、18 | B.4、12、24 |
| C.5、16、32 | D.4、16、32 |
您最近一年使用:0次
2018-02-11更新
|
197次组卷
|
5卷引用:云南省盐津县第二中学2018-2019学年高二上学期12月份考试化学试题
名校
解题方法
10 . 纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1价和+2价的化合物。
(1)写出基态Cu+的核外电子排布式___________________________________ 。
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为________ 。
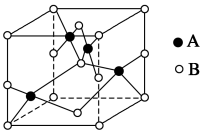
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过________ 键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是____ 。与NH3分子互为等电子体的一种微粒是________ 。
(4)CuO的熔点比CuCl的熔点____ (填“高”或“低”)。
(1)写出基态Cu+的核外电子排布式
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为

(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过
(4)CuO的熔点比CuCl的熔点
您最近一年使用:0次
2018-02-11更新
|
206次组卷
|
7卷引用:云南省昭通市彝良县第一中学2018-2019学年高二上学期12月考试化学试题



