1 . 据Nature Energy报道,最近科研人员研制出一种低浓度锂盐水系电解质溶液,充放电过程中锂离子具有较高的扩散速率,使得锂离子电池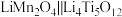 表现出优异的稳定性和放电容量。
表现出优异的稳定性和放电容量。
(1)对电极材料组成元素的分析。
①O原子核外电子有___________ 种运动状态。
②Mn元素位于元素周期表的___________ 区。
③基态Ti原子的核外电子排布式为___________ 。
(2)将 和
和 按
按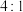 的物质的量比配料,经研磨后升温至600~750℃可制得电极材料
的物质的量比配料,经研磨后升温至600~750℃可制得电极材料 。
。
①该反应的化学方程式为___________ 。
② 中锰元素的平均价态为+3.5。不同温度下,合成的
中锰元素的平均价态为+3.5。不同温度下,合成的 中
中 、
、 和
和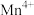 的含量与温度的关系见下表。
的含量与温度的关系见下表。
在上述温度范围内,锰元素平均价态的变化趋势为___________ 。
(3)以某种Ti的氧化物为原料,可制备正极材料尖晶石型钛酸锂(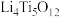 )。
)。
①Ti的氧化物晶胞结构如图所示,其化学式为___________ 。
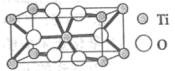
②电池放电过程中,钛酸锂(难溶于水)由尖晶石型转变为岩盐型(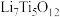 ),则正极的电极反应式为
),则正极的电极反应式为___________ 。
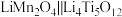 表现出优异的稳定性和放电容量。
表现出优异的稳定性和放电容量。(1)对电极材料组成元素的分析。
①O原子核外电子有
②Mn元素位于元素周期表的
③基态Ti原子的核外电子排布式为
(2)将
 和
和 按
按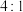 的物质的量比配料,经研磨后升温至600~750℃可制得电极材料
的物质的量比配料,经研磨后升温至600~750℃可制得电极材料 。
。①该反应的化学方程式为
②
 中锰元素的平均价态为+3.5。不同温度下,合成的
中锰元素的平均价态为+3.5。不同温度下,合成的 中
中 、
、 和
和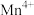 的含量与温度的关系见下表。
的含量与温度的关系见下表。| T/℃ | 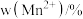 | 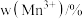 | 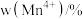 |
| 700 | 5.56 | 44.58 | 49.86 |
| 750 | 2.56 | 44.87 | 52.57 |
| 800 | 5.50 | 44.17 | 50.33 |
| 850 | 6.22 | 44.40 | 49.38 |
(3)以某种Ti的氧化物为原料,可制备正极材料尖晶石型钛酸锂(
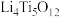 )。
)。①Ti的氧化物晶胞结构如图所示,其化学式为

②电池放电过程中,钛酸锂(难溶于水)由尖晶石型转变为岩盐型(
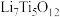 ),则正极的电极反应式为
),则正极的电极反应式为
您最近一年使用:0次
2022-06-29更新
|
233次组卷
|
2卷引用:江苏省常州市教育学会2021-2022学年高二下学期期末学业水平监测化学试题
2 . 铅的合金可作轴承、电缆外皮之用,还可做体育器材铅球等。
(1)铅元素位于元素周期表第六周期IVA族,该族中原子序数最小的元素的原子有_______ 种 能量不同的电子,其次外层的电子云有_______ 种不同的伸展方向。
(2)与铅同主族的短周期元素中,其最高价氧化物对应水化物酸性最强的是_______ (填化学式),气态氢化物沸点最低的是_______ (填电子式)。
(3)配平下列化学方程式,把系数以及相关物质填写在空格上,并标出电子转移的方向和数目______ 。
_______PbO2+_______MnSO4+______HNO3→_______HMnO4+______Pb(NO3)2+_______PbSO4↓+_______
(4)把上述反应后的溶液稀释到1L,测出其中的Pb2+的浓度为0.6mol·L-1,则反应中转移的电子数为_______ 个,该反应中被氧化的元素是_______ 。 若将该反应设计成一原电池,则_______ 极 (填电极名称)附近溶液出现紫红色。
(5)根据上述反应,判断二氧化铅与浓盐酸反应的化学方程式正确的是_______。
(6)已知如下热化学方程式:
Ca(s)+Cl2(g)→CaCl2(s)+ 795kJ
Sr(s)+Cl2(g)→SrCl2(s) + 828kJ
Ba(s)+ Cl2(g) → BaCl2(s) + 860kJ
则①CaCl2、②SrCl2、③BaCl2三种氯化物的稳定性由大到小的排列为_______ (填序号)。从能量的角度解释理由是_______ 。
(1)铅元素位于元素周期表第六周期IVA族,该族中原子序数最小的元素的原子有
(2)与铅同主族的短周期元素中,其最高价氧化物对应水化物酸性最强的是
(3)配平下列化学方程式,把系数以及相关物质填写在空格上,并标出电子转移的方向和数目
_______PbO2+_______MnSO4+______HNO3→_______HMnO4+______Pb(NO3)2+_______PbSO4↓+_______
(4)把上述反应后的溶液稀释到1L,测出其中的Pb2+的浓度为0.6mol·L-1,则反应中转移的电子数为
(5)根据上述反应,判断二氧化铅与浓盐酸反应的化学方程式正确的是_______。
| A.PbO2+4HCl →PbCl4+2H2O | B.PbO2+4HCl →PbCl2+ Cl2↑+2H2O |
| C.PbO2+2HCl+2H+→PbCl2+2H2O | D.PbO2+4HCl→PbCl2+2OH- |
Ca(s)+Cl2(g)→CaCl2(s)+ 795kJ
Sr(s)+Cl2(g)→SrCl2(s) + 828kJ
Ba(s)+ Cl2(g) → BaCl2(s) + 860kJ
则①CaCl2、②SrCl2、③BaCl2三种氯化物的稳定性由大到小的排列为
您最近一年使用:0次
3 . 如图为元素周期表的一部分。请回答下列问题。
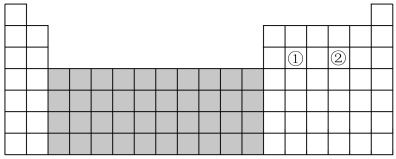
(1)图中阴影部分所示区域的元素称为____ 元素,下列元素属于该区域的是____ (填字母)。
A.Ba B.Fe C.Br D.Rb
(2)已知A、B、C、D、E、F六种短周期元素的原子半径和某些化合价如表:
写出D元素在元素周期表中的位置____ 。
(3)C的最高价氧化物与E的单质在点燃条件下发生反应的化学方程式为____ ;由F的化合物生成A的单质的化学方程式为____ 。
(4)C与氢元素可组成一种气体,该气体在标准状况下的密度为1.25g•L-1,该气体的摩尔质量为____ 。
(5)下列说法不正确 的是____ 。
(6)BrCl属于卤素互化物,性质与Cl2相似。写出BrCl与氢氧化钠溶液反应的化学方程式____ 。

(1)图中阴影部分所示区域的元素称为
A.Ba B.Fe C.Br D.Rb
(2)已知A、B、C、D、E、F六种短周期元素的原子半径和某些化合价如表:
| 元素 | A | B | C | D | E | F |
| 化合价 | -2 | +5、-3 | +4、-4 | +6、-2 | +2 | +1 |
| 原子半径/nm | 0.074 | 0.075 | 0.077 | 0.102 | 0.160 | 0.186 |
(3)C的最高价氧化物与E的单质在点燃条件下发生反应的化学方程式为
(4)C与氢元素可组成一种气体,该气体在标准状况下的密度为1.25g•L-1,该气体的摩尔质量为
(5)下列说法
| A.元素最高正价与最低负价绝对值相等的元素一定处于第ⅣA族 |
| B.第5周期第ⅤA族元素的原子序数为65 |
| C.②形成的最简单氢化物比①形成的最简单氢化物的稳定性高 |
| D.周期表中当某元素的周期序数大于其族序数时,该元素可能属于金属或非金属 |
您最近一年使用:0次
4 . 废锂离子电池回收是对“城市矿产”的资源化利用,可促进新能源产业链闭环。废磷酸铁锂粉主要成分为LiFePO4,还含有的杂质为Al、Cu、Mg.回收LiCl的工艺流程如下:
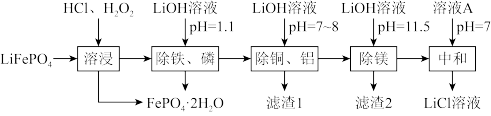
已知:①LiFePO4难溶于水;
②Ksp(FePO4)=1.0×10-22,Ksp(Li3PO4)=2.5×10-3,Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)LiFePO4中Fe的化合价为_______ ,Fe在周期表中的位置为_______ 。
(2)“溶浸”可得到含氯化锂的浸出液,材料中的铝、铜、镁等金属杂质也会溶入浸出液,生成CuCl2的离子反应方程式:_______ ;生成FePO4·2H2O的离子反应方程式:_______ 。
(3)该法实现了定向除杂,溶浸后不可直接将浸出液的pH调至11.5,其原因之一是:FePO4(s)+3Li+(aq)+3OH—(aq)=Fe(OH)3(s)+Li3PO4(s),该反应的平衡常数表达式为K=_______ ,若溶液中的c(Li+)=1mol/L,不考虑其他离子参与反应,为使Li+不转化为Li3PO4沉淀,则pH需小于_______ 。
(4)溶液A为_______ ,若最终获得LiCl溶液的体积为aL,其中Li+的密度为pg·L-1,废磷酸铁锂粉中Li元素的质量为mg,三次加入的LiOH溶液中溶质LiOH的总质量为m1g,其利用率为α,求废磷酸铁锂粉中Li元素的回收率x(Li)=_______ ×100%。(列出计算式即可,不用化简)

已知:①LiFePO4难溶于水;
②Ksp(FePO4)=1.0×10-22,Ksp(Li3PO4)=2.5×10-3,Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)LiFePO4中Fe的化合价为
(2)“溶浸”可得到含氯化锂的浸出液,材料中的铝、铜、镁等金属杂质也会溶入浸出液,生成CuCl2的离子反应方程式:
(3)该法实现了定向除杂,溶浸后不可直接将浸出液的pH调至11.5,其原因之一是:FePO4(s)+3Li+(aq)+3OH—(aq)=Fe(OH)3(s)+Li3PO4(s),该反应的平衡常数表达式为K=
(4)溶液A为
您最近一年使用:0次
5 . 短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是


| A.X、Y、Z三种元素中,X的非金属性最强 |
| B.Y的氢化物的稳定性比Z的氢化物的稳定性弱 |
| C.Y的最高正化合价为+6 |
| D.X的单质的熔点比Z的单质的熔点低 |
您最近一年使用:0次
2021-08-13更新
|
561次组卷
|
2卷引用:第24届(2010年)全国高中学生化学竞赛(安徽赛区)初赛试题
解题方法
6 . 为纪念DmitriMendeleev(德米特里·门德列夫)发明的元素周期表诞生150周年。联合国大会宣布2019年是“国际化学元素周期表年”。以下是元素周期表的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是___________ 。
(2)最高价氧化物的水化物中酸性最强的是___________ 。
(3)元素B原子核外有___________ 种能量不同的电子,基态C原子最高能级电子云形状是___________ 。
(4)比较元素的金属性:B___________ C(填“>”或“<”),从原子结构的角度说明理由___________ 。
(5)A分别与E、G、H形成的化合物中,最稳定的是___________
(6)检验B元素的方法是___________ ,请用原子结构的知识解释产生此现象的原因:___________ 。
(7)元素B的单质在空气中点燃生成X,X中的化学键除离子键,还有___________ (填“极性”或“非极性”)共价键,若将其投入硫酸亚铁溶液中,预测主要的反应现象是___________ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 1 | A | ||||||||
| 2 | D | E | G | ||||||
| 3 | B | C | J | H | I |
(2)最高价氧化物的水化物中酸性最强的是
(3)元素B原子核外有
(4)比较元素的金属性:B
(5)A分别与E、G、H形成的化合物中,最稳定的是
(6)检验B元素的方法是
(7)元素B的单质在空气中点燃生成X,X中的化学键除离子键,还有
您最近一年使用:0次
名校
7 . 如表是元素周期表的一部分,针对表中①~⑩种元素,填写下列空白:
(1)同位素在生活生产和科学研究中有着重要的用途。例如,考古时利用___________ (填核素符号)测定一些文物的年代。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是___________ ,碱性最强的化合物的化学式是___________ 。
(3)写出⑤和⑦的最高价氧化物的水化物反应的离子方程式___________ 。
(4)元素①与⑧形成的化合物属于___________ (填“共价”或“离子”)化合物。
(5)若要比较⑤比⑥的金属性强弱,下列实验方法可行的是___________ 。
A.将单质⑤置于⑥的盐溶液中,如果⑤不能置换出单质⑥,说明⑤的金属性弱
B.比较⑤和⑥的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C.将⑤和⑥的单质分别投入到水中,观察到⑤与水反应更剧烈,说明⑤的金属性强
D.将⑤和⑥的单质分别在O2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是
(3)写出⑤和⑦的最高价氧化物的水化物反应的离子方程式
(4)元素①与⑧形成的化合物属于
(5)若要比较⑤比⑥的金属性强弱,下列实验方法可行的是
A.将单质⑤置于⑥的盐溶液中,如果⑤不能置换出单质⑥,说明⑤的金属性弱
B.比较⑤和⑥的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C.将⑤和⑥的单质分别投入到水中,观察到⑤与水反应更剧烈,说明⑤的金属性强
D.将⑤和⑥的单质分别在O2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强
您最近一年使用:0次
解题方法
8 . 现有四种短周期元素的有关信息如表所示:
则甲、乙、丙、丁四种元素的原子序数从大到小的排列顺序为( )
| 元素 | 结构特点及在周期表中的位置 | 单质及化合物的部分性质与用途 |
| 甲 | 在元素周期表中,主族序数等于周期序数 | 工业上用电解法冶炼该金属 |
| 乙 | 原子最外层电子数是次外层电子数的一半 | 单质是重要的半导体材料 |
| 丙 | 原子最外层电子数是最内层电子数的2倍 | 单质存在多种同素异形体 |
| 丁 | 元素能形成两种不同的单质 | 丁的一种单质与KI溶液反应生成丁的另一种单质 |
| A.甲、乙、丙、丁 | B.丁、甲、乙、丙 |
| C.丙、丁、甲、乙 | D.乙、甲、丁、丙 |
您最近一年使用:0次
2020-10-07更新
|
1548次组卷
|
4卷引用:高一必修第一册(苏教2019版)专题5 高考挑战区
高一必修第一册(苏教2019版)专题5 高考挑战区四川省泸州合江县利城高级中学校2021-2022学年高一下学期第三次月考化学试题(已下线)第四章《物质结构 元素周期律》能力提升单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)陕西省西安市蓝田县乡镇学校联考2023-2024学年高一上学期1月期末化学试题
名校
9 . X、Y、Z是周期表中位置相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为16,核内质子数之和为30,则X、Y、Z分别是( )
| A.O、N、P | B.S、P、N | C.N、O、S | D.Cl、S、O |
您最近一年使用:0次
2020-09-23更新
|
1993次组卷
|
5卷引用:鲁科版(2019)高一必修第二册 第1章 原子结构 元素周期律第2节 元素周期律和元素周期表
鲁科版(2019)高一必修第二册 第1章 原子结构 元素周期律第2节 元素周期律和元素周期表(已下线)4.1.2 元素周期表(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)河南省平顶山一中新区学校2020-2021学年高一上学期教学质量评估(二)化学试题云南省曲靖市会泽县实验高级中学校2022-2023学年高一下学期月考(四)化学试题天津市第五十四中学2023-2024学年高一上学期第二次月考(12月考)化学试题
名校
解题方法
10 . 下列说法错误的是( )
| A.X和Y两种元素为同一周期第IIA族和第IIIA族元素,若X的原子序数为x,则Y的原子序数可能为x+1,x+11, x+25 |
| B.短周期元素Z和W组成化合物ZW3,若W的原子序数为x,Z的原子序数不可能是x+14 |
| C.短周期元素Q和M组成化合物Q2M,Q和M所在的族序数可能为VA和第VIA |
| D.利用元素周期表中氟、氯、硫、磷附近的元素研制新型农药 |
您最近一年使用:0次
2020-09-15更新
|
1383次组卷
|
6卷引用:吉林省长春市东北师范大学附属中学2019-2020学年高一下学期阶段考试化学试题
吉林省长春市东北师范大学附属中学2019-2020学年高一下学期阶段考试化学试题(已下线)解密05 物质结构元素周期律(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密05 物质结构元素周期律(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)专题16 元素周期律和元素周期表(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练山东省实验中学2022-2023学年高一下学期3月月考化学试题山东省青岛市平度第一中学2023-2024学年高一下学期4月月考化学试题



