1 . 钴是一种重要的过渡金属元素,常见化合价有+2、+3价。实验室利用 固体进行如下实验。下列说法正确的是
固体进行如下实验。下列说法正确的是
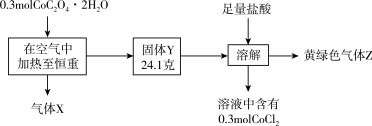
 固体进行如下实验。下列说法正确的是
固体进行如下实验。下列说法正确的是
| A.Co在元素周期表中位于第四周期Ⅷ族 |
B.固体Y为 |
C.酸性条件下氧化性: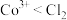 |
D.结合上述流程信息,若有0.1 mol 与足量盐酸充分反应,理论上可以得到0.1 mol 与足量盐酸充分反应,理论上可以得到0.1 mol  |
您最近一年使用:0次
解题方法
2 . 砷 在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗
在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗 ,流程如下:
,流程如下:
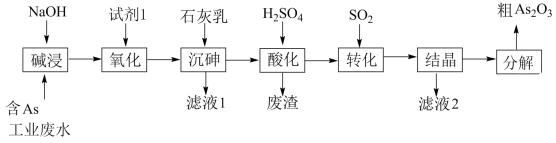
已知:
①含 工业废水主要以亚砷酸(
工业废水主要以亚砷酸( )形式存在,
)形式存在, 为三元弱酸,受热分解为
为三元弱酸,受热分解为 ;
;
② 微溶于水,
微溶于水, 难溶于水。
难溶于水。
回答下列问题:
(1)砷元素在元素周期表中的位置为_______ 。
(2)“碱浸”中发生反应的离子方程式为_______ 。
(3)从绿色化学角度考虑,“试剂1”可以选择_______ (填化学式)。
(4)“沉砷”在流程中的目的是_______ ;“沉砷”的最佳温度是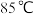 ,温度高于
,温度高于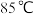 时,随温度升高转化率下降,可能的原因是
时,随温度升高转化率下降,可能的原因是_______ 。
(5)“废渣”的主要成分是_______ ,“转化”中发生反应的化学方程式为_______ 。
(6)从综合利用的角度考虑“滤液2”可返回_______ 步骤中循环再利用。
 在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗
在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗 ,流程如下:
,流程如下:
已知:
①含
 工业废水主要以亚砷酸(
工业废水主要以亚砷酸( )形式存在,
)形式存在, 为三元弱酸,受热分解为
为三元弱酸,受热分解为 ;
;②
 微溶于水,
微溶于水, 难溶于水。
难溶于水。回答下列问题:
(1)砷元素在元素周期表中的位置为
(2)“碱浸”中发生反应的离子方程式为
(3)从绿色化学角度考虑,“试剂1”可以选择
(4)“沉砷”在流程中的目的是
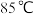 ,温度高于
,温度高于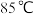 时,随温度升高转化率下降,可能的原因是
时,随温度升高转化率下降,可能的原因是(5)“废渣”的主要成分是
(6)从综合利用的角度考虑“滤液2”可返回
您最近一年使用:0次
3 . 如下是科学家们预期的一种含硒催化剂对亲电卤化的催化机理,NBS反应后转变为X。下列说法错误的是
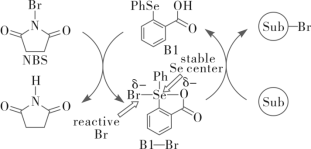

A.反应方程式为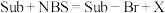 | B.B1到B1—Br发生了氧化 |
C.Br—Br中的Se为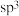 杂化 杂化 | D.Se为p区元素 |
您最近一年使用:0次
4 . 已知第四周期过渡金属元素M,其六氨合M盐与氨化钾溶液在液氨中反应生成棕色非晶态的A[含三种元素,其中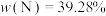 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
(1)请计算推断出M______ 、A______ 、B______ ;
(2)写出反应方程式(Ⅰ)______ 、(Ⅱ)______ 。(提示:可以从最简单的情况开始考虑)
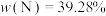 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。(1)请计算推断出M
(2)写出反应方程式(Ⅰ)
您最近一年使用:0次
名校
解题方法
5 . 已知X、Y、Z三种主族元素在元素周期表中的位置如图所示。设X的原子序数为a,则下列说法不正确的是
| Y | ||
| X | ||
| Z |
| A.Y的原子序数可能为a-17 | B.Y与Z的原子序数之和可能为2a |
| C.Z的原子序数可能为a+31 | D.X、Y、Z可能均为短周期元素 |
您最近一年使用:0次
2023-06-18更新
|
987次组卷
|
8卷引用:【全国校级联考】湖北省部分重点中学2017-2018学年高一下学期期中考试化学试题
真题
解题方法
6 .  是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)Co位于元素周期表第_______ 周期,第_______ 族。
(2)烧渣是LiCl、 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因_______ 。
(3)鉴别洗净的“滤饼3”和固体 常用方法的名称是
常用方法的名称是_______ 。
(4)已知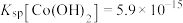 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为_______  。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为_______ 。
(5)导致 比
比 易水解的因素有
易水解的因素有_______ (填标号)。
a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
 是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下: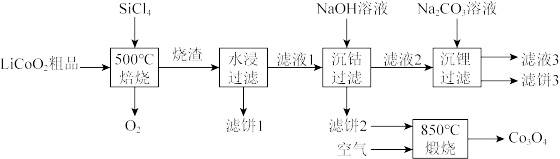
(1)Co位于元素周期表第
(2)烧渣是LiCl、
 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因(3)鉴别洗净的“滤饼3”和固体
 常用方法的名称是
常用方法的名称是(4)已知
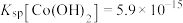 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为 。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为(5)导致
 比
比 易水解的因素有
易水解的因素有a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
您最近一年使用:0次
2023-06-14更新
|
10949次组卷
|
13卷引用:2023年高考湖北卷化学真题
2023年高考湖北卷化学真题(已下线)专题18 工艺流程题(已下线)T16-工业流程题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第32讲难溶电解质的溶解平衡(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题06 沉淀溶解平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)题型四 无机化工流程题解题策略-备战2024年高考化学答题技巧与模板构建
解题方法
7 . 下表列出了A~M 13种元素在周期表中的位置:
(1)这些元素中,金属性最强的元素是_______ (填元素符号,下同),非金属性最强的是_______ 。
(2)写出H元素的最高价氧化物与F元素最高价氧化物对应水化物反应的离子方程式_______ 。
(3)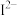 、
、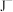 、
、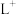 、
、 等微粒中,半径最大的是
等微粒中,半径最大的是_______ ,最小的是_______ 。
(4)A与D形成的化合物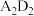 是
是_______ 化合物,其电子式为_______ 。
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | ||
| 4 | L | M |
(2)写出H元素的最高价氧化物与F元素最高价氧化物对应水化物反应的离子方程式
(3)
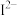 、
、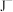 、
、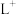 、
、 等微粒中,半径最大的是
等微粒中,半径最大的是(4)A与D形成的化合物
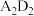 是
是
您最近一年使用:0次
名校
8 . 元素周期表反映元素之间的内在联系,是研究物质性质的重要工具。如表是元素周期表的一部分。请回答下列问题:
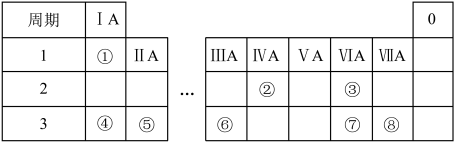
(1)画出④的原子结构示意图_____ 。
(2)①的单质在盛满⑧的单质的集气瓶中燃烧,反应现象为_____ 。
(3)③和④组成的一种物质中含有两种类型的化学键,该物质的化学式为_____ 。
(4)⑥的单质和④的最高价氧化物的水化物反应的化学方程式为_____ 。
(5)已知⑤的单质与②的最高价氧化物A在点燃条件下能反应生成黑色单质,推测④的单质_____ (填“能不能”)与A反应。
(6)为比较⑦和⑧ 非金属性,某小组同学设计实验进行探究。
非金属性,某小组同学设计实验进行探究。
【理论依据】氧化性较强的单质能置换出氧化性较弱的单质
【实验方案】
【实验过程】
按照实验方案操作,观察到的现象与预测的一致,写出该反应的化学方程式_____ 。
【实验结论】非金属性:⑦<⑧

(1)画出④的原子结构示意图
(2)①的单质在盛满⑧的单质的集气瓶中燃烧,反应现象为
(3)③和④组成的一种物质中含有两种类型的化学键,该物质的化学式为
(4)⑥的单质和④的最高价氧化物的水化物反应的化学方程式为
(5)已知⑤的单质与②的最高价氧化物A在点燃条件下能反应生成黑色单质,推测④的单质
(6)为比较⑦和⑧
 非金属性,某小组同学设计实验进行探究。
非金属性,某小组同学设计实验进行探究。【理论依据】氧化性较强的单质能置换出氧化性较弱的单质
【实验方案】
| 实验操作 | 预测现象 |
| 取Na2S溶液于试管中,滴入少量新制氯水 |
按照实验方案操作,观察到的现象与预测的一致,写出该反应的化学方程式
【实验结论】非金属性:⑦<⑧
您最近一年使用:0次
9 . 钒基笼目金属在超导电性方面有广阔的应用前最。某钒基笼目金属(M)的晶体结构如图所示。
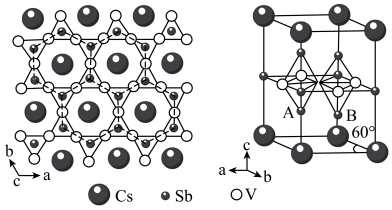
(1)Sb在元素周期表中的位置是___________ 。
(2)基态V原子的价电子中,未成对电子数与成对电子数之比为___________ 。
(3)钒化合物在药物化学及催化化学等领域应用广泛。基态钒原子的价电子排布图为___________ ,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是_________ ,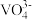 的空间结构为
的空间结构为________ 。
(4)SbH3的键角比NH3的键角小,原因是___________ 。
(5)该钒基笼目金属(M)的化学式为___________ ,与V原子距离最近且等距的V原子________ 个。
(6)已知,该晶胞中距离最近的两个V原子间的距离为2.75 Å,则晶胞体内A、B原子之间的距离为___________ Å ( ≈1.73, 保留两位小数)。
≈1.73, 保留两位小数)。

(1)Sb在元素周期表中的位置是
(2)基态V原子的价电子中,未成对电子数与成对电子数之比为
(3)钒化合物在药物化学及催化化学等领域应用广泛。基态钒原子的价电子排布图为
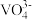 的空间结构为
的空间结构为(4)SbH3的键角比NH3的键角小,原因是
(5)该钒基笼目金属(M)的化学式为
(6)已知,该晶胞中距离最近的两个V原子间的距离为2.75 Å,则晶胞体内A、B原子之间的距离为
 ≈1.73, 保留两位小数)。
≈1.73, 保留两位小数)。
您最近一年使用:0次
22-23高一下·上海浦东新·期中
名校
解题方法
10 . 元素周期表是元素周期律的具体表现,是学习和研究化学的一种重要工具。下图是元素周期表的一部分:
回答下列问题:
(1)As元素在周期表中的位置是:___________ 。
(2)元素①气态氢化物分子的空间构型是___________ 。请用一个方程式比较元素①和元素②的非金属性强弱:___________ 。
(3)元素③、④、⑤的简单离子半径由大到小排序为:___________ (用离子符号表示)。
(4)元素⑤、⑥非金属性更强的是:___________ (用元素符号表示),请从原子结构的角度解释:___________ 。
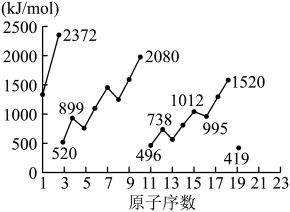
电离能是指由气态原子失去电子形成阳离子需要的能量。从中性原子中失去第一个电子所需要的能量为第一电离能( ),失去第二个电子所需要的能量为第二电离能(
),失去第二个电子所需要的能量为第二电离能( ),依次类推。下图为1-19号元素第一电离能
),依次类推。下图为1-19号元素第一电离能 。
。
回答下列问题:
(5)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常,预测下列关系式中正确的是___________(填编号)。
(6)10号元素Ne的 值较大的原因是
值较大的原因是___________ 。
| ① | ② | ③ | ||
| ④ | P | ⑤ | ⑥ | |
| Ga | Ge | As | Se | Br |
回答下列问题:
(1)As元素在周期表中的位置是:
(2)元素①气态氢化物分子的空间构型是
(3)元素③、④、⑤的简单离子半径由大到小排序为:
(4)元素⑤、⑥非金属性更强的是:
电离能是指由气态原子失去电子形成阳离子需要的能量。从中性原子中失去第一个电子所需要的能量为第一电离能(
 ),失去第二个电子所需要的能量为第二电离能(
),失去第二个电子所需要的能量为第二电离能( ),依次类推。下图为1-19号元素第一电离能
),依次类推。下图为1-19号元素第一电离能 。
。
回答下列问题:
(5)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常,预测下列关系式中正确的是___________(填编号)。
A.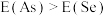 | B. | C. | D.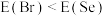 |
 值较大的原因是
值较大的原因是
您最近一年使用:0次



