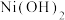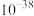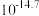名校
解题方法
1 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 、
、 )实现镍、钴、镁元素的回收。
)实现镍、钴、镁元素的回收。 )的电离第一步完全,第二步微弱。
)的电离第一步完全,第二步微弱。
2.25℃时,相关物质的 如下:
如下:
回答下列问题:
(1)Ni属于元素周期表的________ 区。
(2)混合气在“氧化”中,产生 ,其中S的化合价为
,其中S的化合价为________ 。
(3)“滤渣”的成分之一是软锰矿的主要成分,由 氧化产生,该反应的离子方程式为
氧化产生,该反应的离子方程式为________ ;其可用于实验室制取氯气,该反应的离子方程式为________ 。
(4)若使 沉淀完全(浓度
沉淀完全(浓度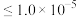 ),需调节pH不低于
),需调节pH不低于________ 。
(5)上述表格中a________ b(填“大于”、“小于”或“无法确定”)。
(6)“沉钴镍”后需将钴镍渣洗涤干净,实验室检验其是否洗净的方法是________ 。
(7)滤液2中含有的金属阳离子是________ 。
 、
、 、
、 、
、 、
、 、
、 )实现镍、钴、镁元素的回收。
)实现镍、钴、镁元素的回收。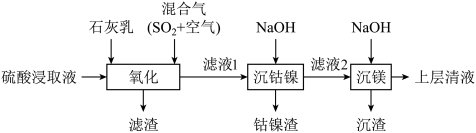
 )的电离第一步完全,第二步微弱。
)的电离第一步完全,第二步微弱。2.25℃时,相关物质的
 如下:
如下:物质 |
|
|
|
|
|
|
| a | b |
(1)Ni属于元素周期表的
(2)混合气在“氧化”中,产生
 ,其中S的化合价为
,其中S的化合价为(3)“滤渣”的成分之一是软锰矿的主要成分,由
 氧化产生,该反应的离子方程式为
氧化产生,该反应的离子方程式为(4)若使
 沉淀完全(浓度
沉淀完全(浓度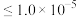 ),需调节pH不低于
),需调节pH不低于(5)上述表格中a
(6)“沉钴镍”后需将钴镍渣洗涤干净,实验室检验其是否洗净的方法是
(7)滤液2中含有的金属阳离子是
您最近一年使用:0次
2024-06-06更新
|
318次组卷
|
2卷引用:辽宁省大连市2023-2024学年高三下学期第二次模拟考试化学试卷
名校
2 . 铷和铯在电子器件、催化剂、特种玻璃、生物化学及医药等应用领域有重要作用。自然界中的铷、铯储量丰富,但是含量偏低,常和其他碱金属共生。一种由钾铷铯混合矾(含少量 、
、 、
、 等硫酸盐)制备铯盐和碳酸铷的部分工艺流程如下:
等硫酸盐)制备铯盐和碳酸铷的部分工艺流程如下:
(1)铷位于元素周期表中的第_______ 周期。
(2)“滤渣Ⅰ”中有Al(OH)3和一种重要的硫酸盐,该硫酸盐在医疗上的主要用途为_______ 。工艺流程中分两次调pH的主要目的为_______ 。
(3)“萃铯余液”进行“碳化”的目的是除去溶液中的 等杂质离子。
等杂质离子。
①“碳化”过程中除去 时,发生反应的离子方程式为
时,发生反应的离子方程式为_______ 。
②继续通入CO2至过量,“碳化”后溶液中含有大量 ,
, 的分解温度约为175℃,从溶液中制得碳酸铷的操作是蒸发浓缩、
的分解温度约为175℃,从溶液中制得碳酸铷的操作是蒸发浓缩、_______ 、过滤、洗涤、_______ 。
(4)利用叠氮酸(HN3)和Rb2CO3两步制取少量金属铷,每一步都会生成一种无色无味气体,已知叠氮酸的酸性大于碳酸的酸性。该制备过程的化学方程式为_______ 、_______ 。
 、
、 、
、 等硫酸盐)制备铯盐和碳酸铷的部分工艺流程如下:
等硫酸盐)制备铯盐和碳酸铷的部分工艺流程如下: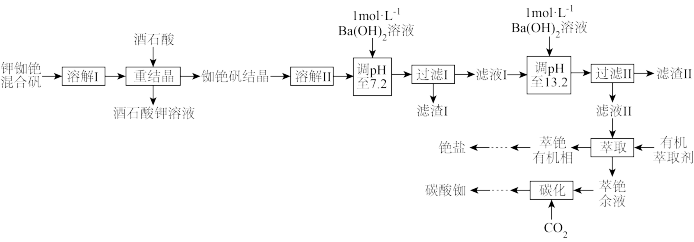
(1)铷位于元素周期表中的第
(2)“滤渣Ⅰ”中有Al(OH)3和一种重要的硫酸盐,该硫酸盐在医疗上的主要用途为
(3)“萃铯余液”进行“碳化”的目的是除去溶液中的
 等杂质离子。
等杂质离子。①“碳化”过程中除去
 时,发生反应的离子方程式为
时,发生反应的离子方程式为②继续通入CO2至过量,“碳化”后溶液中含有大量
 ,
, 的分解温度约为175℃,从溶液中制得碳酸铷的操作是蒸发浓缩、
的分解温度约为175℃,从溶液中制得碳酸铷的操作是蒸发浓缩、(4)利用叠氮酸(HN3)和Rb2CO3两步制取少量金属铷,每一步都会生成一种无色无味气体,已知叠氮酸的酸性大于碳酸的酸性。该制备过程的化学方程式为
您最近一年使用:0次
2024-05-31更新
|
202次组卷
|
4卷引用:2024届华大新高考联盟名校高考预测卷理综试题-高中化学
3 . 全无机卤化物钙钛矿因其独特的晶体结构展现出优异的光学与电学特性。某 钙钛矿的晶胞结构如图所示,晶胞边长为anm,
钙钛矿的晶胞结构如图所示,晶胞边长为anm, 表示阿伏加德罗常数的值,下列说法错误的是
表示阿伏加德罗常数的值,下列说法错误的是
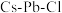 钙钛矿的晶胞结构如图所示,晶胞边长为anm,
钙钛矿的晶胞结构如图所示,晶胞边长为anm, 表示阿伏加德罗常数的值,下列说法错误的是
表示阿伏加德罗常数的值,下列说法错误的是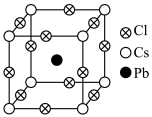
| A.图中Cs原子的配位数为6 |
B.该卤化物钙钛矿的化学式为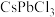 |
C.晶体密度为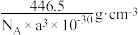 |
| D.Pb和Cl均属于p区元素 |
您最近一年使用:0次
2024-05-24更新
|
161次组卷
|
3卷引用:湖南省2024届普通高中高三下学期学业水平选择性考试临考预测押题密卷化学试题(A卷)
4 . 一种超导材料(仅由Cs、Ag、F三种元素组成)的长方体晶胞结构如图所示(已知 ),下列说法错误的是
),下列说法错误的是
 ),下列说法错误的是
),下列说法错误的是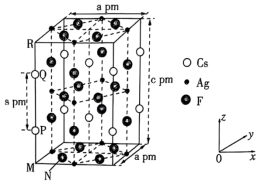
| A.基态47Ag位于元素周期表的ds区 |
B.若N点原子分数坐标为(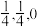 ),则P点原子分数坐标为( ),则P点原子分数坐标为(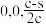 ) ) |
C.M、N之间的距离为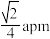 |
D.该化合物的密度为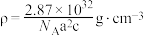 |
您最近一年使用:0次
2024-05-13更新
|
193次组卷
|
2卷引用:东北三省四市教研联合体2024届高三下学期高考模拟(二)化学试题
名校
5 . 钨(W)常用于制造白炽灯、碘钨灯等。工业上以黑钨矿(主要成分是 、
、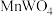 ,含少量
,含少量 、
、 )为原料冶炼钨的流程如图所示。
)为原料冶炼钨的流程如图所示。
请回答下列问题:
(1)基态 核外电子占据能量最高的能级符号是
核外电子占据能量最高的能级符号是__________ ;Mn位于元素周期表__________ 区。
(2)“粉碎”的目的是__________ ;从“浸取”得到的浸渣中分离出 的操作方法是
的操作方法是__________ 、过滤、洗涤、干燥。
(3)根据“转化”,判断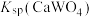
__________ 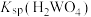 (填“>”或“<”)。
(填“>”或“<”)。
(4)“灼烧”中盛装固体的仪器是__________ (填名称);发生反应的化学方程式为______________________________ 。
(5)碳化钨是一种耐磨、耐高温、高硬度材料。碳化钨晶胞如图所示。已知:晶胞底边长为apm,高为bpm, 为阿伏加德罗常数的值。碳化钨晶体密度为
为阿伏加德罗常数的值。碳化钨晶体密度为__________  (列出计算式即可)。
(列出计算式即可)。
 、
、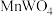 ,含少量
,含少量 、
、 )为原料冶炼钨的流程如图所示。
)为原料冶炼钨的流程如图所示。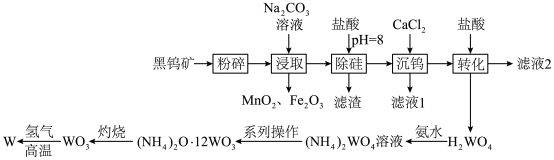
请回答下列问题:
(1)基态
 核外电子占据能量最高的能级符号是
核外电子占据能量最高的能级符号是(2)“粉碎”的目的是
 的操作方法是
的操作方法是(3)根据“转化”,判断
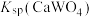
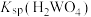 (填“>”或“<”)。
(填“>”或“<”)。(4)“灼烧”中盛装固体的仪器是
(5)碳化钨是一种耐磨、耐高温、高硬度材料。碳化钨晶胞如图所示。已知:晶胞底边长为apm,高为bpm,
 为阿伏加德罗常数的值。碳化钨晶体密度为
为阿伏加德罗常数的值。碳化钨晶体密度为 (列出计算式即可)。
(列出计算式即可)。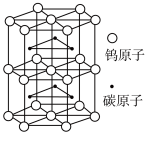
您最近一年使用:0次
2024-05-11更新
|
81次组卷
|
2卷引用:江西省部分学校2023-2024学年高三下学期二轮复习联考验收化学试卷
名校
解题方法
6 . 新型储氢合金材料的研究和开发将为氢气作为能源的实际应用起到重要的推动作用。两种常见储氢合金的晶胞结构如图所示。设阿伏加德罗常数为 ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是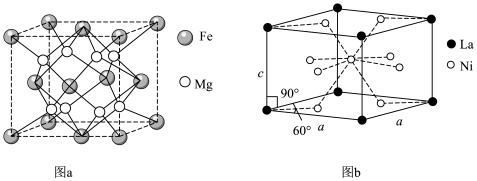
| A.图中涉及的四种元素均为d区元素 |
B.图b晶体的化学式为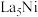 |
C.图a晶体晶胞边长为dpm,该合金的密度为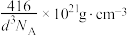 |
D.图a晶体储氢时,储存的氢相当于 分子在晶胞的体心和棱心位置,则含24g Mg的该储氢合金储存的 分子在晶胞的体心和棱心位置,则含24g Mg的该储氢合金储存的 在标准状况下的体积约为11.2L 在标准状况下的体积约为11.2L |
您最近一年使用:0次
2024-05-09更新
|
399次组卷
|
4卷引用:辽宁省凌源市2024届高三下学期第三次模拟考试化学试卷
名校
7 . 镓(Ga)是非常重要的稀土金属,其化合物广泛应用于诸多领域。
(1)镓元素在元素周期表中的位置是___________ 。
(2)GaN作为第三代半导体材料,广泛应用于大功率充电器和5G通讯技术。工业上利用炼锌矿渣[主要含可溶性铁酸镓 、铁酸锌
、铁酸锌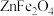 ]制备并提取GaN,工艺流程如下:
]制备并提取GaN,工艺流程如下:
①“酸浸”过程中 发生的反应的离子方程式为
发生的反应的离子方程式为___________ 。
②利用上述工艺,酸浸后的酸浸液应加入___________ 固体充分反应后再进行萃取。
③“反萃取”后,溶液中镓元素的存在形式为___________ (填离子符号)。
④回收金属元素时,锌主要从___________ 中回收。
A.浸出渣 B.酸浸液 C.水相 D.有机相
(3)MOCVD法是通过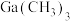 与
与 反应得到GaN和另一种产物,该反应的化学方程式为
反应得到GaN和另一种产物,该反应的化学方程式为___________ 。
(4)该流程中,可以循环使用的物质是___________ 。
(1)镓元素在元素周期表中的位置是
(2)GaN作为第三代半导体材料,广泛应用于大功率充电器和5G通讯技术。工业上利用炼锌矿渣[主要含可溶性铁酸镓
 、铁酸锌
、铁酸锌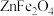 ]制备并提取GaN,工艺流程如下:
]制备并提取GaN,工艺流程如下: 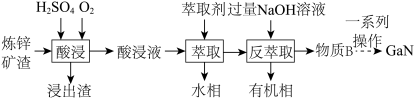
| 金属离子 |  |  |  |  |
| 萃取率/% | 0 | 0 | 99 | 97~98.5 |
 发生的反应的离子方程式为
发生的反应的离子方程式为②利用上述工艺,酸浸后的酸浸液应加入
③“反萃取”后,溶液中镓元素的存在形式为
④回收金属元素时,锌主要从
A.浸出渣 B.酸浸液 C.水相 D.有机相
(3)MOCVD法是通过
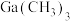 与
与 反应得到GaN和另一种产物,该反应的化学方程式为
反应得到GaN和另一种产物,该反应的化学方程式为(4)该流程中,可以循环使用的物质是
您最近一年使用:0次
名校
8 . 1869年,俄国化学家门捷列夫提出了元素周期律,并在此基础上发表了第一张元素周期表。为了纪念元素周期表诞生150年,联合国将2019年定为“国际化学元素周期表年”,并认为元素周期表是“科学共同的语言”。
(1)认识元素周期表的结构:___________ 区。
②2017年5月9日我国发布了113号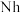 、115号
、115号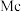 、117号
、117号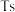 、118号
、118号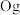 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是___________ (填字母序号)。
a.113号元素在周期表中的位置是第七周期 族
族
b.117号元素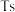 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:
(2)认识原子结构与元素周期表的关系:见表中元素 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的___________ ,该元素 能层上具有
能层上具有___________ 种不同运动状态的电子。
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D_______ E(填“>” “<”或“=”)。
②气态氢化物的沸点:B_____ F (填“>”“<”或“=”),理由是___________ 。B的另一种氢化物可以作为火箭推进剂的燃料之一,其电子式为___________ 。
(1)认识元素周期表的结构:
②2017年5月9日我国发布了113号
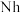 、115号
、115号 、117号
、117号 、118号
、118号 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是a.113号元素在周期表中的位置是第七周期
 族
族b.117号元素
 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:

(2)认识原子结构与元素周期表的关系:见表中元素
 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的 能层上具有
能层上具有(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D
②气态氢化物的沸点:B
您最近一年使用:0次
2024-04-26更新
|
70次组卷
|
2卷引用:安徽省淮南第二中学2023-2024学年高二下学期期中测试化学试题
名校
解题方法
9 . 实验室中可用 或
或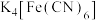 来检验
来检验 ,下列说法正确的是
,下列说法正确的是
 或
或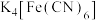 来检验
来检验 ,下列说法正确的是
,下列说法正确的是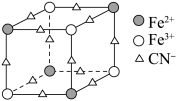
A.铁元素位于周期表第四周期第ⅧB族,属于 区 区 |
B. 与 与 溶液混合,得到的配合物 溶液混合,得到的配合物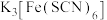 中,提供空轨道的是 中,提供空轨道的是 ,配位原子是 ,配位原子是 ,配位数是6 ,配位数是6 |
C.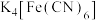 中含有离子键、极性共价键和非极性共价键 中含有离子键、极性共价键和非极性共价键 |
D.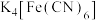 与 与 反应可得到一种蓝色沉淀,该沉淀物质晶胞的 反应可得到一种蓝色沉淀,该沉淀物质晶胞的 结构如图所示( 结构如图所示( 未画出),则一个晶胞中的 未画出),则一个晶胞中的 个数为4 个数为4 |
您最近一年使用:0次
2024-04-15更新
|
196次组卷
|
2卷引用:四川省绵阳中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
10 . 反应 ,可用于去除氮氧化物。
,可用于去除氮氧化物。 催化该反应的过程如图所示。下列说法正确的是
催化该反应的过程如图所示。下列说法正确的是
 ,可用于去除氮氧化物。
,可用于去除氮氧化物。 催化该反应的过程如图所示。下列说法正确的是
催化该反应的过程如图所示。下列说法正确的是
A. 位于元素周期表 位于元素周期表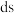 区 区 |
B.反应过程中, 参与反应,降低了反应的焓变 参与反应,降低了反应的焓变 |
C.该反应的平衡常数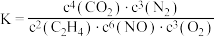 |
D.其他条件不变时,增大 , , 的平衡转化率下降 的平衡转化率下降 |
您最近一年使用:0次