名校
解题方法
1 . 氟及其化合物在生产生活中被广泛使用,造福人类。
(1)氟在元素周期表中的位置是___________ 。
(2)氢氟酸具有刻蚀玻璃的特性,写出该反应的化学方程式____________ 。已知25℃时,氢氟酸的电离平衡常数Ka=3.6×10-4,若将0.01 mol·L-1的HF溶液与pH=12的NaOH溶液等体积混合,则溶液中离子浓度由大到小的顺序为_____ 。
(3)次氟酸(HOF)由科学家在1971年首次制得,次氟酸的电子式为_______ 。
(4)四氟肼(N2F4)用作高能燃料的氧化剂,1 mol N2F4分子中含有的共价键数目是________ NA。N2F4气体可用Fe3+氧化二氟胺(HNF2)制得,写出该反应的离子方程式______________ 。
(5)六氟化铀(UF6)是铀的稳定气态化合物,用作核燃料,由U3O8制取UF6的三步反应原理如下:
①U3O8+H2 →UO2+H2O (未配平) ②UO2+4HF=UF4+2H2O ③UF4+ F2 = UF6
则下列说法正确的是_____________ 。
A.反应①②③都是氧化还原反应
B.反应③中U元素被氧化
C.反应①中氧化剂和还原剂的物质的量之比为2:1
(6)六氟磷酸锂(LiPF6)是锂离子电池广泛使用的电解质。LiPF6与极少量水反应可生成POF3等三种含氟化合物,写出该反应的化学方程式:________ 。
(1)氟在元素周期表中的位置是
(2)氢氟酸具有刻蚀玻璃的特性,写出该反应的化学方程式
(3)次氟酸(HOF)由科学家在1971年首次制得,次氟酸的电子式为
(4)四氟肼(N2F4)用作高能燃料的氧化剂,1 mol N2F4分子中含有的共价键数目是
(5)六氟化铀(UF6)是铀的稳定气态化合物,用作核燃料,由U3O8制取UF6的三步反应原理如下:
①U3O8+H2 →UO2+H2O (未配平) ②UO2+4HF=UF4+2H2O ③UF4+ F2 = UF6
则下列说法正确的是
A.反应①②③都是氧化还原反应
B.反应③中U元素被氧化
C.反应①中氧化剂和还原剂的物质的量之比为2:1
(6)六氟磷酸锂(LiPF6)是锂离子电池广泛使用的电解质。LiPF6与极少量水反应可生成POF3等三种含氟化合物,写出该反应的化学方程式:
您最近一年使用:0次
2020-01-23更新
|
243次组卷
|
4卷引用:福建省宁德市2019-2020学年高三上学期期末质量检测理综化学试题
福建省宁德市2019-2020学年高三上学期期末质量检测理综化学试题(已下线)2020届高三《新题速递·化学》2月第01期(考点01-06)(已下线)考点05 元素周期表和元素周期律-2020年高考化学命题预测与模拟试题分类精编河南省郑州市第一中学2021届高三上学期开学测试化学试题
2 . 为纪念元素周期表诞生150周年,IUPAC等从世界范围征集优秀青年化学家提名,形成一张“青年化学家元素周期表”,向世界介绍118位优秀青年化学家,有8位中国青年化学家成为“N、Hg、U”等元素的代言人。回答下列问题:
(1)N在周期表中的位置是__ 。
(2)下列有关性质的比较,能用元素周期律解释的是__ 。
a.酸性:HCl>H2SO3 b.非金属性:O>S
c.碱性:NaOH>Mg(OH)2 d.热稳定性:Na2CO3>NaHCO3
(3)非金属性:Cl>Br,用原子结构解释原因__ ,用一个离子方程式证明__ 。
(4)科学家合成了一种新化合物(如图所示),其中R、X、Y、Z为同一短周期元素,Z核外最外层电子数是Y核外电子数的一半。

①Y的元素符号为__ 。②X的氢化物的电子式__ 。
(1)N在周期表中的位置是
(2)下列有关性质的比较,能用元素周期律解释的是
a.酸性:HCl>H2SO3 b.非金属性:O>S
c.碱性:NaOH>Mg(OH)2 d.热稳定性:Na2CO3>NaHCO3
(3)非金属性:Cl>Br,用原子结构解释原因
(4)科学家合成了一种新化合物(如图所示),其中R、X、Y、Z为同一短周期元素,Z核外最外层电子数是Y核外电子数的一半。

①Y的元素符号为
您最近一年使用:0次
3 . 氧、硫、硒(Se)、碲(Te)、钋(Po)是元素周期表中原子序数依次增大的同主族元素。回答下列问题:
(1)硒在元素周期表中的位置________ 。
(2) Po的中子数为
Po的中子数为________ 。
(3)某温度时,该族单质与H2反应生成气态H2X的热化学方程式如下:
O2(g)+2H2(g)=2H2O(g) △H1=-484 kJ/mol
S(g)+H2(g) H2S(g) △H2=-20 kJ/mol
H2S(g) △H2=-20 kJ/mol
Se(g)+H2(g) H2Se(g) △H3=+81kJ/mol
H2Se(g) △H3=+81kJ/mol
①硫和硒氢化物的热稳定性:H2S________ H2Se(填“>”、“=”或“<”);判断依据是________ 。
②写出O2(g)与H2S(g)反应生成H2O(g)和S(g)的热化学方程式________ 。
(1)硒在元素周期表中的位置
(2)
 Po的中子数为
Po的中子数为(3)某温度时,该族单质与H2反应生成气态H2X的热化学方程式如下:
O2(g)+2H2(g)=2H2O(g) △H1=-484 kJ/mol
S(g)+H2(g)
 H2S(g) △H2=-20 kJ/mol
H2S(g) △H2=-20 kJ/molSe(g)+H2(g)
 H2Se(g) △H3=+81kJ/mol
H2Se(g) △H3=+81kJ/mol①硫和硒氢化物的热稳定性:H2S
②写出O2(g)与H2S(g)反应生成H2O(g)和S(g)的热化学方程式
您最近一年使用:0次
4 . 碳及其化合物在生产、生活中有广泛的用途。
I.金刚砂SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与同周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子,则Q元素在周期表中的位置为____________ ,R的电子式为______________ ;
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收CCl4的实验操作名称为_____________ ,除去粗产品中少量钠的试剂为______________ ;
(3)碳还原制取SiC,其粗产品中杂质为Si和SiO2。先将20.0g SiC粗产品加入到过量NaOH溶液中充分反应,收集到0.1 mol氢气,过滤SiC固体11.4g,滤液稀释到1L。Si与NaOH溶液反应的离子方程式为____________________ ,硅酸盐的物质的量浓度为____________ 。
II.工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如图所示。已知CaSO4的KSP=9.1×10-4,CaCO3的KSP=2.8×10-4。请回答:
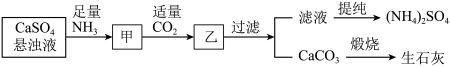
(1)向甲中通入过量CO2__________ (填“有”或“不”)利于CaCO3和(NH4)2SO4的生成,原因是_________________ 。
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是____________ (填含量最多的一种)。
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为___________________________ ;
②请分析CaSO4转化为CaCO3的原理:___________________________ 。
I.金刚砂SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与同周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子,则Q元素在周期表中的位置为
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收CCl4的实验操作名称为
(3)碳还原制取SiC,其粗产品中杂质为Si和SiO2。先将20.0g SiC粗产品加入到过量NaOH溶液中充分反应,收集到0.1 mol氢气,过滤SiC固体11.4g,滤液稀释到1L。Si与NaOH溶液反应的离子方程式为
II.工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如图所示。已知CaSO4的KSP=9.1×10-4,CaCO3的KSP=2.8×10-4。请回答:

(1)向甲中通入过量CO2
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为
②请分析CaSO4转化为CaCO3的原理:
您最近一年使用:0次
名校
解题方法
5 . 与氯元素同族的短周期元素的原子,其核外能量最高的电子所处的电子亚层是________ ;碘元素在元素周期表中的位置是___________ ;液溴的保存通常采取的方法是__________ 。
您最近一年使用:0次
名校
6 . (1)现有下列10种物质:①O2;②H2;③NH4NO3;④Na2O2;⑤Ba(OH)2;⑥CH4;⑦CO2;⑧NaF;⑨NH3;⑩I2。其中既含离子键又含非极性键的是________ (填序号,下同);既含离子键又含极性键的是________ ;。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子。若XY2为常见元素形成的离子化合物,则其电子式为______________________________________________ ;若XY2为共价化合物,则其结构式为_________________________________________ 。
(3)氯化铝的物理性质非常特殊,如氯化铝的熔点为190℃,但在180℃就开始升华。据此判断,氯化铝是______________ (填“共价化合物”或“离子化合物”),可以证明该判断正确的实验依据是_______________________________________ 。
(4)现有a~g七种短周期元素,它们在元素周期表中的位置如图所示,请据此回答下列问题:
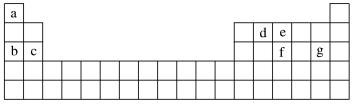
元素的原子间最容易形成离子键的是____ (填字母,下同),容易形成共价键的是____ 。
A.c和f B.b和g C.d和g D.b和e
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子。若XY2为常见元素形成的离子化合物,则其电子式为
(3)氯化铝的物理性质非常特殊,如氯化铝的熔点为190℃,但在180℃就开始升华。据此判断,氯化铝是
(4)现有a~g七种短周期元素,它们在元素周期表中的位置如图所示,请据此回答下列问题:

元素的原子间最容易形成离子键的是
A.c和f B.b和g C.d和g D.b和e
您最近一年使用:0次
7 . 溴和氯在元素周期表中均属于___ 族。
您最近一年使用:0次
名校
8 . 砷(As)是第四周期ⅤA族元素,可以形成As2S3、H3AsO3、H3AsO4等化合物,用途广泛。完成下列填空:
(1)砷原子核外有____ 个电子层,最外层有_____ 个电子。
(2)将砷与ⅤA族所有短周期元素的原子半径,按从小到大的顺序排列_____ (用元素符号表示)
(3)溴位于ⅦA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:_____ 强于____ (填物质的化学式)
(4)周期表中,铝和砷都在金属和非金属过渡线附近。若向AlCl3溶液中逐滴加入NaOH溶液,先生成沉淀,然后沉淀逐渐消失,请用电离平衡移动的原理解释沉淀会消失的原因______ 。
(1)砷原子核外有
(2)将砷与ⅤA族所有短周期元素的原子半径,按从小到大的顺序排列
(3)溴位于ⅦA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:
(4)周期表中,铝和砷都在金属和非金属过渡线附近。若向AlCl3溶液中逐滴加入NaOH溶液,先生成沉淀,然后沉淀逐渐消失,请用电离平衡移动的原理解释沉淀会消失的原因
您最近一年使用:0次
9 . 砷(As)是第四周期VA族元素,可以形成As2S3、H3AsO3、H3AsO4等化合物,用途广泛。
完成下列填空:
(1)砷原子核外有__ 个电子层,最外层有__ 个电子,写出砷原子最外层电子的轨道表示式:__ 。
(2)将砷与VA族所有短周期元素的原子半径,按从小到大的顺序排列:__ (用元素符号表示)。
(3)溴位于VIIA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:__ 强于__ (填物质的化学式)。
(4)周期表中,铝和砷都在金属和非金属过渡线附近,举一例说明铝元素具有非金属性:__ 。
(5)已知:稀Na3AsO3溶液、稀碘水和稀NaOH溶液混合,发生如下反应:AsO33-(aq)+I2(aq)+2OH- AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
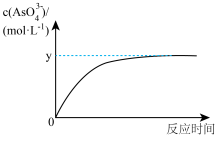
①写出该反应平衡常数的表达式K=___ 。
②不能判断反应达到平衡状态的是___ (选填编号)。
A.溶液的pH不再变化
B.v(I-)=2v(AsO33-)
C.c(AsO33-)/c(I-)不再变化
D.c(I-)=2ymol·L-1
完成下列填空:
(1)砷原子核外有
(2)将砷与VA族所有短周期元素的原子半径,按从小到大的顺序排列:
(3)溴位于VIIA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:
(4)周期表中,铝和砷都在金属和非金属过渡线附近,举一例说明铝元素具有非金属性:
(5)已知:稀Na3AsO3溶液、稀碘水和稀NaOH溶液混合,发生如下反应:AsO33-(aq)+I2(aq)+2OH-
 AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
①写出该反应平衡常数的表达式K=
②不能判断反应达到平衡状态的是
A.溶液的pH不再变化
B.v(I-)=2v(AsO33-)
C.c(AsO33-)/c(I-)不再变化
D.c(I-)=2ymol·L-1
您最近一年使用:0次
2019-11-08更新
|
164次组卷
|
3卷引用:上海市杨浦区2017-2018学年度高三第一学期高中等级考模拟调研化学试题
上海市杨浦区2017-2018学年度高三第一学期高中等级考模拟调研化学试题上海市民星中学2019—2020学年高三上学期期中考试化学试题(已下线)专题35 磷、砷及其化合物-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
10 . 如表为元素周期表中的一部分,表中列出了10种元素在周期表中的位置,按要求完成下列各小题。
I.(1)这10种元素中,化学性质最不活泼的元素是____ (填元素符号,下同),非金属性最强的元素是___ 。
(2)①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的电子式是_____ 。
(3)①②③三种元素的原子半径由大到小的顺序是____ 。
(4)某元素的最高价氧化物对应的水化物既能与酸反应生成盐和水又能和碱反应生成盐和水,向该元素和⑨号元素形成的化合物的溶液中,缓慢滴加氢氧化钠溶液至过量,产生的实验现象是____ ,有关反应的离子方程式为_____ 。
II.下列物质:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩Ar
(1)既含有极性键又含有非极性键的是____ ;(填序号,下同)
(2)含有非极性键的离子化合物是____ ;
(3)不含化学键的是____ ;
(4)用电子式表示Na2O的形成过程_____ 。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | Ⅵ A | Ⅶ A | 0 |
| 2 | ⑥ | ⑦ | ⑧ | |||||
| 3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
| 4 | ② | ④ |
I.(1)这10种元素中,化学性质最不活泼的元素是
(2)①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的电子式是
(3)①②③三种元素的原子半径由大到小的顺序是
(4)某元素的最高价氧化物对应的水化物既能与酸反应生成盐和水又能和碱反应生成盐和水,向该元素和⑨号元素形成的化合物的溶液中,缓慢滴加氢氧化钠溶液至过量,产生的实验现象是
II.下列物质:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩Ar
(1)既含有极性键又含有非极性键的是
(2)含有非极性键的离子化合物是
(3)不含化学键的是
(4)用电子式表示Na2O的形成过程
您最近一年使用:0次



