1 . 结合元素周期表,用化学用语回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界。_______

(2)表中所列元素,属于短周期元素的有____ ,属于主族元素的有___ 种;i元素位于第_____ 周期第______ 族。
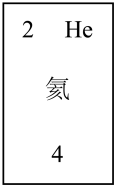
(3)元素f是第____ 周期____ 族元素,请在如图方框中按氮元素的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量。______
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是_______ (填标号)。
A. He和Ne B. B和Mg C. Al和Si D. F和Cl
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界。

(2)表中所列元素,属于短周期元素的有
(3)元素f是第

(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是
A. He和Ne B. B和Mg C. Al和Si D. F和Cl
您最近一年使用:0次
2 . 下表为元素周期表中的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题。
I. (1)化学性质最不活泼的元素是_____ (填元素符号,下同),非金属性最强的元素是_____ 。金属性最强的单质与水反应的离子方程式是________ 。
(2)①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的化学式是____ 。
(3)①②③三种元素的原子半径由大到小的顺序是____ >____ >_____ 。
(4)某元素的最高价氧化物对应的水化物既能与酸反应生成盐和水又能和碱反应生成盐和水,该元素为_____ 。在这两种盐中该元素的化合价为_____ ,该元素的最高价氧化物和盐酸反应的离子方程式为_______ 。向该元素和⑧号元素形成的化合物的溶液中,缓慢滴加氢氧化钠溶液至过量,产生的实验现象是_______ ,有关反应的化学方程式为_______ 。
II.下列物质:①N2②CO2③NH3④Na2O⑤Na2O2⑥ NaOH ⑦CaBr2⑧H2O2⑨NH4Cl⑩Ar
(1)既含有极性键又含有非极性键的是_______ ;(填序号,下同)
(2)含有非极性键的离子化合物是___________
(3)不含化学键的是___________
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑪ | |||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(2)①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的化学式是
(3)①②③三种元素的原子半径由大到小的顺序是
(4)某元素的最高价氧化物对应的水化物既能与酸反应生成盐和水又能和碱反应生成盐和水,该元素为
II.下列物质:①N2②CO2③NH3④Na2O⑤Na2O2⑥ NaOH ⑦CaBr2⑧H2O2⑨NH4Cl⑩Ar
(1)既含有极性键又含有非极性键的是
(2)含有非极性键的离子化合物是
(3)不含化学键的是
您最近一年使用:0次
3 . 下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题:
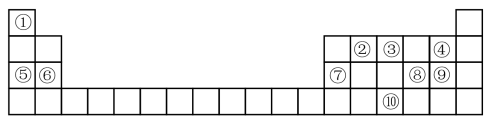
(1)元素⑩在周期表中的位置是_____ ,⑦的原子结构示意图为_____ 。
(2)④、⑤、⑥的简单离子半径由大到小的顺序为______ (用离子符号和“>”表示)。
(3)④⑧⑨的气态氢化物中,最稳定的是______ (用化学式表示),最高价氧化物对应水化物中,酸性最强的是_____ (用化学式表示)。
(4)⑤的最高价氧化物对应的水化物与⑦的最高价氧化物对应的水化物发生反应的离子方程式___ 。
(5)由①③⑨组成的离子化合物的化学式为____ ,其中含有的化学键类型是______ 。

(1)元素⑩在周期表中的位置是
(2)④、⑤、⑥的简单离子半径由大到小的顺序为
(3)④⑧⑨的气态氢化物中,最稳定的是
(4)⑤的最高价氧化物对应的水化物与⑦的最高价氧化物对应的水化物发生反应的离子方程式
(5)由①③⑨组成的离子化合物的化学式为
您最近一年使用:0次
2019-06-10更新
|
263次组卷
|
2卷引用:江苏省南通市启东市吕四中学2019-2020学年高二下学期期初考试化学试题
名校
4 . 下表是元素周期表短周期的一部分:
请按要求用化学用语回答下列问题:
(1)元素④、⑥、⑨的离子半径由大到小的顺序为________________ ;
(2)元素②、③、④的简单氢化物的沸点由低到高的顺序:_____________________ ;
(3)用电子式表示元素④与元素⑥形成的化合物的形成过程____________ ;
(4)比元素⑦的原子序数多17的元素在周期表的位置为________________ ;
(5)写出由①④⑤三种元素组成的一种离子化合物的电子式_______________ ,若将其溶于水,破坏了其中的__________ (填“离子键”、“共价键”或“离子键和共价键”);
(6)元素①和元素④形成的化合物及元素①和元素⑧形成的化合物均为18电子分子,请写出这两种化合物按物质的量之比4 :1反应的离子方程式________ 。

请按要求用化学用语回答下列问题:
(1)元素④、⑥、⑨的离子半径由大到小的顺序为
(2)元素②、③、④的简单氢化物的沸点由低到高的顺序:
(3)用电子式表示元素④与元素⑥形成的化合物的形成过程
(4)比元素⑦的原子序数多17的元素在周期表的位置为
(5)写出由①④⑤三种元素组成的一种离子化合物的电子式
(6)元素①和元素④形成的化合物及元素①和元素⑧形成的化合物均为18电子分子,请写出这两种化合物按物质的量之比4 :1反应的离子方程式
您最近一年使用:0次
2019-05-09更新
|
2348次组卷
|
3卷引用:四川省彭州市濛阳中学2019-2020学年高二下学期开学考试化学试题
名校
5 . 下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。

完成下列填空(填元素符号或化学式):
(1)元素B在元素周期表中的位置是第____ 周期第_____ 族,A、B、C三种元素原子半径从大到小的顺序是_________________ ;
(2)D简单离子的结构示意图为_____________ ,D、E中金属性较强的元素是________ 。D单质在空气中燃烧可生成淡黄色粉末X(D2O2),X常用作呼吸面具和潜水艇中的供氧剂,可选用合适的化学试剂和下图所示实验装置证明X有提供氧气的作用。
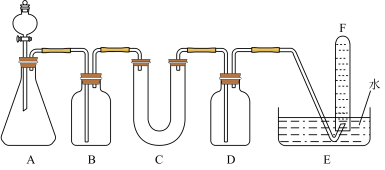
(3)装置A使用石灰石与浓盐酸反应制取CO2,装置B中饱和NaHCO3溶液的作用是除去_____________ ;
(4)装置C中X与CO2反应的化学方程式是_____________________ ,装置D盛放NaOH溶液的作用是除去____________ ;
(5)为检验试管F收集的气体,进行____________ 操作,出现_________ 现象,即证明X可作供氧剂。

完成下列填空(填元素符号或化学式):
(1)元素B在元素周期表中的位置是第
(2)D简单离子的结构示意图为

(3)装置A使用石灰石与浓盐酸反应制取CO2,装置B中饱和NaHCO3溶液的作用是除去
(4)装置C中X与CO2反应的化学方程式是
(5)为检验试管F收集的气体,进行
您最近一年使用:0次
2019-03-25更新
|
2348次组卷
|
8卷引用:湖南省株洲市炎陵县湘山高级中学等2校2022-2023学年高一下学期开学考试化学试题
名校
6 . 元素在周期表中的位置反映了元素的原子结构和性质。请回答下列有关硼(B)元素的问题:
(1)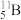 原子核内的中子数为
原子核内的中子数为________ 。
(2)硼元素在元素周期表中的位置为___________ 。
(3)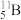 的原子半径
的原子半径__________ 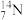 的原子半径(填“大于”或“小于”)。
的原子半径(填“大于”或“小于”)。
(4)硼元素的最高价氧化物对应的水化物酸性比氮元素的最高价氧化物对应的水化物酸性_______ (填“强”或“弱”)。
(5)四氢硼锂(LiBH4)是一种重要的化学试剂,低温下可与HCl气体发生如下反应:2 LiBH4 + 2 HCl = 2 LiCl + B2H6 + 2H2该反应中,LiBH4和B2H6中的氢元素均显-1价。请回答下列问题。LiBH4中硼元素的化合价为__________ ;该反应的还原剂为____________ ;4 mol LiBH4完全反应后共失去_____ mol电子。
(1)
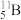 原子核内的中子数为
原子核内的中子数为(2)硼元素在元素周期表中的位置为
(3)
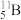 的原子半径
的原子半径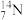 的原子半径(填“大于”或“小于”)。
的原子半径(填“大于”或“小于”)。(4)硼元素的最高价氧化物对应的水化物酸性比氮元素的最高价氧化物对应的水化物酸性
(5)四氢硼锂(LiBH4)是一种重要的化学试剂,低温下可与HCl气体发生如下反应:2 LiBH4 + 2 HCl = 2 LiCl + B2H6 + 2H2该反应中,LiBH4和B2H6中的氢元素均显-1价。请回答下列问题。LiBH4中硼元素的化合价为
您最近一年使用:0次
名校
7 . 第三周期第ⅣA族的元素原子序数是________ ,硫元素的原子序数是________ ,与硫相邻的同族元素的原子序数是____________ ;短周期元素中,族序数等于周期序数的元素有____ , 族序数等于周期序数2倍的元素有_________ ,周期序数等于族序数2倍的元素有____ 。
您最近一年使用:0次
8 . 原子序数大于4的主族元素A和B的离子分别为Am+和Bn﹣, 已知它们的核外电子排布相同,据此推断:
①A和B所属周期数之差为(填具体数字)________ ,
②A和B的核电荷数之差为(用含m或n的式子表示)________ ,
③B和A的族序数之差为________ .
①A和B所属周期数之差为(填具体数字)
②A和B的核电荷数之差为(用含m或n的式子表示)
③B和A的族序数之差为
您最近一年使用:0次
名校
解题方法
9 . 下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白。
(1)在这些元素中,化学性质最不活泼的元素的原子结构示意图为___ 。
(2)④与⑤两种元素相比较,原子半径较大的是___ (填元素符号);在非金属元素的最高价氧化物所对应的水化物中,酸性最强的化合物是___ (填化学式)。在金属元素氧化物所对应的水化物中,碱性最强的化合物是___ (填化学式),具有两性的化合物是___ (填化学式)。
(3)④,⑤,⑥,⑦四种元素形成的简单离子,半径由大到小的顺序为___ (填化学式)。
(4)元素①和元素⑦形成化合物属于___ 化合物(填“离子”或者“共价”)。请用电子式表示⑥和④组成化合物的形成过程:________ 。
(5)由②和氢元素形成的两种多原子分子,A为10电子结构B为18电子结构,B可由A与次氯酸钠反应制得,该反应的离子方程式为:______________ 。
| 主族\周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | O |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)④与⑤两种元素相比较,原子半径较大的是
(3)④,⑤,⑥,⑦四种元素形成的简单离子,半径由大到小的顺序为
(4)元素①和元素⑦形成化合物属于
(5)由②和氢元素形成的两种多原子分子,A为10电子结构B为18电子结构,B可由A与次氯酸钠反应制得,该反应的离子方程式为:
您最近一年使用:0次
名校
10 . 下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
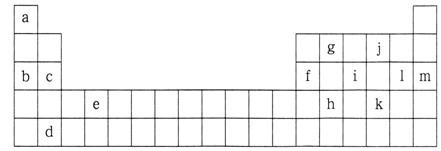
(1)表中所列元素中:
属于短周期元素的有__________ ;属于主族元素的有_________ ;e元素在元素周期表中的位置是________ 周期,_______ 族。
(2)下列___________ 组元素的单质可能都是电的良导体。
A.b,c,i B.a,g,k C.c,g,l D.d,e,f
(3)将元素a,b,c,f,1的原子半径按从小到大的顺序排列:________
(4) i元素属于_________ (填“金属”或“非金属”)元素,它的最高化合价是________ ,最低化合价是________ 。它能与氧气反应,生成一种吸水性很强的物质,这种物质在实验室里常用做干燥剂,写出i的单质与氧气反应的化学方程式:_____________

(1)表中所列元素中:
属于短周期元素的有
(2)下列
A.b,c,i B.a,g,k C.c,g,l D.d,e,f
(3)将元素a,b,c,f,1的原子半径按从小到大的顺序排列:
(4) i元素属于
您最近一年使用:0次



