1 . 人体必需的一些元素在周期表中的分布情况如下:

(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是___________ 。H2O2是一种绿色氧化剂,电子式为___________ 。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为___________ 。
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是___________ ,原子序数为___________ 。
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为___________ 。
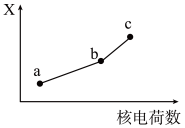
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是___________(填字母)。

(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是___________(填字母)。

| A.若a、b、c表示氧族元素,则X表示对应氢化物的稳定性 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第IA族元素,则X表示对应离子的氧化性 |
| D.若a、b、c表示第IIA族元素,则X表示最高价氧化物对应水化物的碱性 |
您最近一年使用:0次
2023-12-05更新
|
264次组卷
|
3卷引用:湖北省宜城市第一中学等六校2023-2024学年高二上学期期中考试化学试题
名校
解题方法
2 . 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
(1)②的最高价氧化物的分子式为_______ ;⑦的最高价氧化物对应水化物的分子式为_______ 。
(2)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:_______ 。
(3)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是_______(填字母)。
(4)已知Cs元素位于元素周期表中第六周期第IA族,请回答下列问题:
①铯的原子序数为_______ 。
②铯单质与 反应的化学反应方程式为
反应的化学反应方程式为_______ 。
③预测铯单质的还原性比钠单质的还原性_______ (填“弱”或“强”)。
④下列推断正确的是_______ (填字母)。
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(5)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为_______ 。
族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:
(3)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是_______(填字母)。
| A.在化合物中最高正化合价为+6 | B.单质可以与 气体反应并置换出单质S 气体反应并置换出单质S |
| C.最高价氧化物对应水化物的酸性比硫酸弱 | D.单质在常温下可与氢气化合 |
①铯的原子序数为
②铯单质与
 反应的化学反应方程式为
反应的化学反应方程式为③预测铯单质的还原性比钠单质的还原性
④下列推断正确的是
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(5)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为
您最近一年使用:0次
2023-11-10更新
|
895次组卷
|
2卷引用:广西柳州铁一中学2022-2023学年高一上学期期末考试化学试题
名校
3 . 在一百多种化学元素中,非金属占了23种。80%的非金属元素在社会中占重要位置。如C、N、Si、Cl等。
(1)氯元素最外电子层上有___________ 种能量不同的电子,该元素的简单阴离子核外电子排布式是___________ 。
(2)由氮元素与硅元素组成的物质,可用于制造发动机的耐热部件,因为它属于___________ 晶体,请写出该化合物的化学式___________ 。
(3)下列事实能说明氯与氧两元素非金属性相对强弱的有___________ (选填编号)。
a.Cl原子最外层电子数比氧多 b.酸性:HCl>H2O
c.ClO2中氯元素为+4价,氧元素为-2价 d.沸点:H2O>HCl
(1)氯元素最外电子层上有
(2)由氮元素与硅元素组成的物质,可用于制造发动机的耐热部件,因为它属于
(3)下列事实能说明氯与氧两元素非金属性相对强弱的有
a.Cl原子最外层电子数比氧多 b.酸性:HCl>H2O
c.ClO2中氯元素为+4价,氧元素为-2价 d.沸点:H2O>HCl
您最近一年使用:0次
名校
解题方法
4 . 中国高铁对实现“一带一路”的战略构想有重要的作用。
(1)建设高铁轨道需要大量的水泥,生产水泥的主要原材料是___________ 。
(2)高铁上的信息传输系统使用了光导纤维,其主要成分是___________ ;乘务员使用的无线通话机的芯片材料所含元素在元素周期中的位置___________ 。
(3)高铁上安装有许多玻璃,氢氟酸可以处理玻璃表面的微裂纹,氢氟酸与玻璃中的二氧化硅反应的化学方程式___________ 。
(4)高铁上的卫生间没有任何异味,是由于所使用的马桶、地漏和洗手盆下水口都是纳米硅胶的高科技产品,向硅酸钠溶液中加入稀盐酸可产生硅酸胶体,该反应的离子方程式___________ 。
(5)硅酸盐材料具有硬度高、难溶于水、耐高温等特点。硅酸盐中常含有Al、K等元素,如钾长石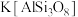 和钠长石
和钠长石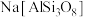 等,
等,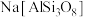 用氧化物形式表示为
用氧化物形式表示为___________ 。
(1)建设高铁轨道需要大量的水泥,生产水泥的主要原材料是
(2)高铁上的信息传输系统使用了光导纤维,其主要成分是
(3)高铁上安装有许多玻璃,氢氟酸可以处理玻璃表面的微裂纹,氢氟酸与玻璃中的二氧化硅反应的化学方程式
(4)高铁上的卫生间没有任何异味,是由于所使用的马桶、地漏和洗手盆下水口都是纳米硅胶的高科技产品,向硅酸钠溶液中加入稀盐酸可产生硅酸胶体,该反应的离子方程式
(5)硅酸盐材料具有硬度高、难溶于水、耐高温等特点。硅酸盐中常含有Al、K等元素,如钾长石
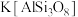 和钠长石
和钠长石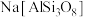 等,
等,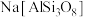 用氧化物形式表示为
用氧化物形式表示为
您最近一年使用:0次
名校
5 . 元素周期表反映元素之间的内在联系,是研究物质性质的重要工具。如表是元素周期表的一部分,请回答下列问题:
(1)元素②、③、⑥的简单离子半径由大到小的排序为___________ (填离子符号)。
(2)②和④组成的物质中含有___________ 键,可以证明该化合物含有此类型化学键的实验事实为___________ 。
(3)⑤的氧化物和⑥的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(4)已知④的单质与①的最高价氧化物A在点燃条件下能反应生成黑色单质,推测③的单质___________ (填“能”或“不能”)与A反应,说明推测的理由___________ 。
| 周期 | IA | 0 | |||||||
| 1 | IIA | … | IIIA | IVA | VA | VIA | VIIA | ||
| 2 | ① | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | |||||
(2)②和④组成的物质中含有
(3)⑤的氧化物和⑥的最高价氧化物对应的水化物反应的离子方程式为
(4)已知④的单质与①的最高价氧化物A在点燃条件下能反应生成黑色单质,推测③的单质
您最近一年使用:0次
名校
6 . 生活中处处有化学。请回答下列问题:
(1)苏打水是很多人喜爱的饮品,请写出小苏打在水中的电离方程式_______ 。
(2)“84消毒液”与洁厕灵(主要成分是浓盐酸)不能混用,混合会产生黄绿色的有毒气体,请用离子方程式解释原因_______ 。
(3)Na2O2常用作呼吸面罩供氧剂,请写出Na2O2的电子式_______ 。
(4)硅是太阳能电池板的主要原材料,请写出硅元素在周期表的位置_______ 。
(5)4gCO在氧气中燃烧生成CO2,放出9.6kJ热量,写出CO燃烧的热化学方程式_______ 。
(6)已知:①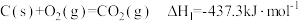
②H2(g)+1/2O2(g)=H2O(g) ∆H2=-285.8kJ·mol-1
③CO(g)+1/2O2(g)=CO2(g) ∆H3=-283.0kJ·mol-1
写出煤气化(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式_______ 。
(1)苏打水是很多人喜爱的饮品,请写出小苏打在水中的电离方程式
(2)“84消毒液”与洁厕灵(主要成分是浓盐酸)不能混用,混合会产生黄绿色的有毒气体,请用离子方程式解释原因
(3)Na2O2常用作呼吸面罩供氧剂,请写出Na2O2的电子式
(4)硅是太阳能电池板的主要原材料,请写出硅元素在周期表的位置
(5)4gCO在氧气中燃烧生成CO2,放出9.6kJ热量,写出CO燃烧的热化学方程式
(6)已知:①
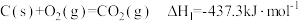
②H2(g)+1/2O2(g)=H2O(g) ∆H2=-285.8kJ·mol-1
③CO(g)+1/2O2(g)=CO2(g) ∆H3=-283.0kJ·mol-1
写出煤气化(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式
您最近一年使用:0次
解题方法
7 . “价类二维图”是学习元素化合物的重要工具。下图是氮及其主要化合物的价类二维图。
(1)氮元素在元素周期表中的位置是___________ 。液态a可用作制冷剂的原因是___________ 。
(2)c、d、e三种物质中,属于酸性氧化物的是___________ (填化学式),判断理由是___________ (用离子方程式表示)。
(3)将充满d的大试管倒立于水槽中并轻轻晃动(如图),可观察到的实验现象为___________ 。
(5)为提高氮元素原子利用率,并减少环境污染,工业上用废铜屑、 溶液和稀硝酸制备
溶液和稀硝酸制备 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(6) 是一种高效氮肥,受热易分解。反应
是一种高效氮肥,受热易分解。反应 中,每生成
中,每生成 转移电子
转移电子___________ mol。
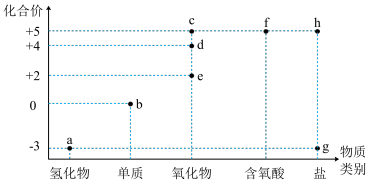
(1)氮元素在元素周期表中的位置是
(2)c、d、e三种物质中,属于酸性氧化物的是
(3)将充满d的大试管倒立于水槽中并轻轻晃动(如图),可观察到的实验现象为

| A.镁 | B.铝 | C.铜 | D.铂 |
 溶液和稀硝酸制备
溶液和稀硝酸制备 ,该反应的离子方程式为
,该反应的离子方程式为(6)
 是一种高效氮肥,受热易分解。反应
是一种高效氮肥,受热易分解。反应 中,每生成
中,每生成 转移电子
转移电子
您最近一年使用:0次
名校
8 . 元素周期律
基于元素之间具有内在联系的思想,通过对元素性质及其关系的探寻,元素周期律已成为将物质组成元素性质以及原子结构建立联系的连接点。
(1)下列不属于主族元素的是________
(2) 的电子式正确的是________
的电子式正确的是________
(3)有关N、O两种元素,下列排序错误的是________
(4)甲~戊均为短周期元素,在元素周期表中的相对位置如图所示。戊的最高价氧化物对应的水化物为强酸。下列说法不正确的是________
基于元素之间具有内在联系的思想,通过对元素性质及其关系的探寻,元素周期律已成为将物质组成元素性质以及原子结构建立联系的连接点。
(1)下列不属于主族元素的是________
A. | B. | C. | D. |
 的电子式正确的是________
的电子式正确的是________A.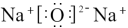 | B. |
C.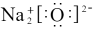 | D. |
| A.元素的最高化合价:O>N | B.简单氢化物的稳定性: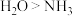 |
| C.元素的电负性:O>N | D.离子半径: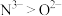 |
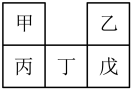
| A.原子半径:丁>戊>乙 |
| B.非金属性:戊>丁>丙 |
| C.甲的氢化物遇氯化氢一定有白烟产生 |
| D.丙的最高价氧化物对应的水化物一定能与强碱反应 |
您最近一年使用:0次
名校
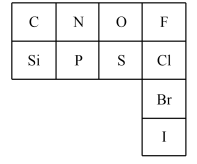
9 . 元素周期表是指导我们系统学习化学的重要工具。下图是元素周期表的一部分。___________ 相同。
(2)氮元素的最低化合价为___________ ,其气态氢化物的电子式为___________ 。在表中所列元素的最高价氧化物对应水化物中酸性最强的是___________ (写化学式)。
(3)Cl的非金属性___________ (填“强于”、“弱于”或“等于”)Br的非金属性。(海水提溴的原理是用氯气将溴离子氧化,请写出氯气与溴化钠溶液反应的化学方程式,并标出电子转移的方向和数目。___________ 。
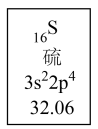
(4)元素周期表中每种元素的具体信息如图示例,从中你可以获取硫元素的哪些信息,请简要阐述。___________ (任写一个)。
(2)氮元素的最低化合价为
(3)Cl的非金属性
(4)元素周期表中每种元素的具体信息如图示例,从中你可以获取硫元素的哪些信息,请简要阐述。
您最近一年使用:0次
名校
10 . 德米特里·伊万诺维奇·门捷列夫是著名的俄国化学家,他对化学的发展作出了卓越的贡献。请回答下列问题:
(1)门捷列夫的突出贡献是________
(2)某元素的原子L层电子数比K层电子数多3个,与该元素同一主族的短周期元素是___________ 。
(3)C、O、Na的原子半径从大到小的顺序为___________ 。
(4)请你根据原子结构示意图,分别指出这些原子所含的质子数、元素周期表中的位置。___________ ,周期表中位置:___________ 。
(5)请将短周期元素或其化合物填入下列表格
①金属性最强的元素是___________ (填元素符号);
②形成化合物种类最多的元素是___________ (填元素符号);
③第三周期中,简单气态氢化物热稳定性最好的是___________ (填写分子式)。
(1)门捷列夫的突出贡献是________
| A.提出原子学说 | B.发现元素周期律 |
| C.提出分子学说 | D.发现氧气 |
(3)C、O、Na的原子半径从大到小的顺序为
(4)请你根据原子结构示意图,分别指出这些原子所含的质子数、元素周期表中的位置。

(5)请将短周期元素或其化合物填入下列表格
①金属性最强的元素是
②形成化合物种类最多的元素是
③第三周期中,简单气态氢化物热稳定性最好的是
您最近一年使用:0次



