解题方法
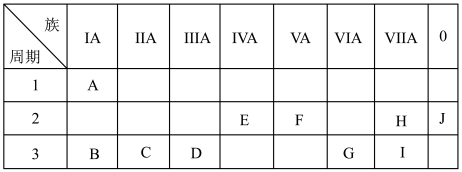
1 . 如图是元素周期表中的一部分。
(1)化学性质最不活泼的元素是_________ ,氧化性最强的单质是__________ 。
(2)最高价氧化物对应的水化物中,碱性最强的是_________ ,呈两性的是_________ 。
(3)在B、C、D、G、I中,原子半径最大的是_________ ,它们的离子半径最大是_________ (填离子符号)。
(4)B的最高价氧化物的水化物与G的最高价氧化物的水化物反应的化学方程式为___________________ 。
(1)化学性质最不活泼的元素是
(2)最高价氧化物对应的水化物中,碱性最强的是
(3)在B、C、D、G、I中,原子半径最大的是
(4)B的最高价氧化物的水化物与G的最高价氧化物的水化物反应的化学方程式为
您最近一年使用:0次
名校
2 . 硫酸亚铁铵[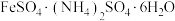 ,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
第一步:在圆底烧瓶中称取mg铁屑,再用量筒量取15mL 的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。
的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。 溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
第三步:冷却至室温,待有大量晶体析出时,减压过滤,用试剂N少量多次洗涤,干燥后,称得晶体质量为11.8g。计算产率。
回答下列问题:
(1)硫酸亚铁铵中组成元素的原子半径由大到小的顺序为___________ 。
(2)已知:Cr的3d比4p能量低得多,重铬酸钾具有二聚结构,它由两个通过氧原子键合在一起的铬原子组成,中心Cr为正四面体形,结构为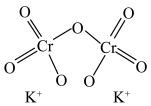 ,其中Cr原子的杂化方式为___________(填标号)。
,其中Cr原子的杂化方式为___________(填标号)。
(3)圆底烧瓶中生成 的离子方程式为
的离子方程式为___________ 。
(4)第二步中需要称量剩余铁屑质量的原因为___________ ,写出制备硫酸亚铁铵晶体的化学方程式:___________ 。
(5)试剂N是___________ 。
(6)准确称取0.8g硫酸亚铁铵晶体三份,分别放入三个250mL锥形瓶中,加入100mL水,20mL 的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用
的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用 重铬酸钾标准液进行滴定。
重铬酸钾标准液进行滴定。
①重铬酸钾在酸性条件下的还原产物为 ,写出该滴定反应的离子方程式:
,写出该滴定反应的离子方程式:___________ 。
②三次实验消耗标准液的体积分别是16.75mL、16.80mL、16.85mL,则硫酸亚铁铵晶体的纯度为___________ (写出含M的表达式)。
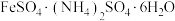 ,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:第一步:在圆底烧瓶中称取mg铁屑,再用量筒量取15mL
 的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。
的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。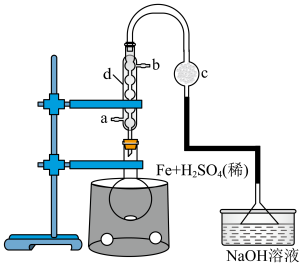
 溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。第三步:冷却至室温,待有大量晶体析出时,减压过滤,用试剂N少量多次洗涤,干燥后,称得晶体质量为11.8g。计算产率。
回答下列问题:
(1)硫酸亚铁铵中组成元素的原子半径由大到小的顺序为
(2)已知:Cr的3d比4p能量低得多,重铬酸钾具有二聚结构,它由两个通过氧原子键合在一起的铬原子组成,中心Cr为正四面体形,结构为
 ,其中Cr原子的杂化方式为___________(填标号)。
,其中Cr原子的杂化方式为___________(填标号)。A. | B. | C.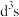 | D.sp |
(3)圆底烧瓶中生成
 的离子方程式为
的离子方程式为(4)第二步中需要称量剩余铁屑质量的原因为
(5)试剂N是
(6)准确称取0.8g硫酸亚铁铵晶体三份,分别放入三个250mL锥形瓶中,加入100mL水,20mL
 的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用
的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用 重铬酸钾标准液进行滴定。
重铬酸钾标准液进行滴定。①重铬酸钾在酸性条件下的还原产物为
 ,写出该滴定反应的离子方程式:
,写出该滴定反应的离子方程式:②三次实验消耗标准液的体积分别是16.75mL、16.80mL、16.85mL,则硫酸亚铁铵晶体的纯度为
您最近一年使用:0次
2024-05-26更新
|
112次组卷
|
2卷引用:2024届重庆市渝西中学高三下学期模拟预测化学试题
解题方法
3 . 下表为元素周期表的一部分。请回答下列问题:
(1)写出X元素的元素符号:______ 。
(2)C、N两种元素中,原子半径较小的是______ (填元素符号)。
(3)元素Y在元素周期表中的位置为______ 。
(4)写出Z的气态氢化物的电子式:______ 。
碳 | 氮 | Y | |
X | 硫 | Z |
(2)C、N两种元素中,原子半径较小的是
(3)元素Y在元素周期表中的位置为
(4)写出Z的气态氢化物的电子式:
您最近一年使用:0次
名校
解题方法
4 . X、Y、Z、M、Q、R是元素周期表前四周期元素,且原子序数依次增大,根据下表相关信息完成以下问题:
(1)请写出Q元素基态原子的价电子排布图:_______ 。
(2)X、Y、Z、M四种元素的原子半径由小到大的顺序是_______ (用元素符号表示)。
(3)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是_______ 。
(4)X、Y、Q三种元素简单气态氢化物稳定性由大到小_______ (用物质符号表示)。
(5)Z的氯化物比M的氯化物熔点高原因是_______ 。
(6)实验发现M的氯化物处于熔融状态时常以二聚态(M2Cl6)形式存在。其球棍模型如图。

①该分子中M原子采取_______ 杂化。
②M2Cl6与过量NaOH溶液反应生成Na[M(OH)4],[M(OH)4]-中存在的化学键类型有_______ (填标号)。
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
| 元素 | 相关信息 |
| X | 原子核外有6种不同运动状态的电子 |
| Y | 基态原子中s电子总数与p电子总数相等 |
| Z | 原子半径在同周期元素中最大 |
| M | 逐级电离能(kJ·mol-1)依次为578、1817、2745、11575、14830、18376 |
| Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
| R | 基态原子核外有4个未成对电子 |
(2)X、Y、Z、M四种元素的原子半径由小到大的顺序是
(3)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是
(4)X、Y、Q三种元素简单气态氢化物稳定性由大到小
(5)Z的氯化物比M的氯化物熔点高原因是
(6)实验发现M的氯化物处于熔融状态时常以二聚态(M2Cl6)形式存在。其球棍模型如图。

①该分子中M原子采取
②M2Cl6与过量NaOH溶液反应生成Na[M(OH)4],[M(OH)4]-中存在的化学键类型有
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
您最近一年使用:0次
2023-08-26更新
|
246次组卷
|
2卷引用:辽宁省大连市第八中学2022-2023学年高三上学期10月月考化学试题
解题方法
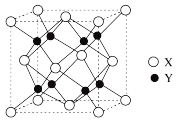
5 . Li3OX(图a)和Li2OHX(图b)的晶胞结构,如图所示。
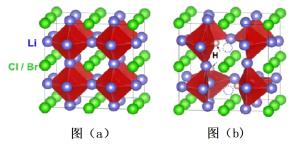
请回答下列问题:
(1)基态氯原子的价层电子排布式为_____ 。基态溴原子核外电子有_____ 种不同的空间运动状态。
(2)离子半径,r(Li+)=76pm,r(H-)=208pm,H-半径大于Li+的原因是_____ 。
(3)下列含锂的粒子中,失去1个电子需要的能量最低的是_____。
(4)已知几种元素的电负性数据如下:
①PBr3分子的空间结构是_____ 。在H2O、HCl、HBr、PH3中,共价键极性最弱的是_____ (填化学式)。。
②已知PCl5分子中P原子的s、p、d轨道参与杂化。试解释存在PCl5,不存在NCl5的主要原因可能是_____ 。
③在LiH、Li2O、LiCl、LiBr中,离子键百分率最高的是_____ (填化学式)。
(5)1个图b(Li2OHCl)晶胞的质量为_____ g(只列计算式)。
(6)如图a,晶胞参数为Apm,NA为阿伏加德罗常数的值。Li3OBr晶体密度为_____ g·cm-3(只列计算式)。

请回答下列问题:
(1)基态氯原子的价层电子排布式为
(2)离子半径,r(Li+)=76pm,r(H-)=208pm,H-半径大于Li+的原因是
(3)下列含锂的粒子中,失去1个电子需要的能量最低的是_____。
| A.1s22s1 | B.1s2 | C.1s12s1 | D.1s23s1 |
| 元素 | O | H | Cl | Br | P |
| 电负性 | 3.5 | 2.1 | 3.0 | 2.8 | 2.1 |
②已知PCl5分子中P原子的s、p、d轨道参与杂化。试解释存在PCl5,不存在NCl5的主要原因可能是
③在LiH、Li2O、LiCl、LiBr中,离子键百分率最高的是
(5)1个图b(Li2OHCl)晶胞的质量为
(6)如图a,晶胞参数为Apm,NA为阿伏加德罗常数的值。Li3OBr晶体密度为
您最近一年使用:0次
解题方法
6 .  是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
(1) 与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为
与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为___________ 。
(2) 可形成
可形成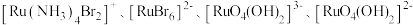 四种配离子且配离子中不存在非极性键,其中
四种配离子且配离子中不存在非极性键,其中 离子半径最小的配离子是
离子半径最小的配离子是___________ ,具有对称结构的 中
中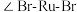 为
为___________ 。图1中通过螯合作用形成配位键的N原子的杂化方式为___________ , 离子配体中N原子与中心
离子配体中N原子与中心 离子配位的原因是
离子配位的原因是___________ 。

(3) 的晶体结构如图2所示。
的晶体结构如图2所示。
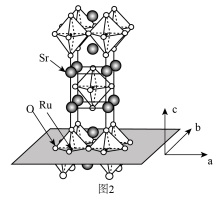
① 和
和 的电负性:
的电负性:
___________  (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为
(填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为___________ 形。
②用 表示阿伏伽德罗常数的值,晶胞参数为
表示阿伏伽德罗常数的值,晶胞参数为 ,
, ,则其密度为
,则其密度为___________  (列出计算式即可)。
(列出计算式即可)。
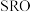 是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:(1)
 与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为
与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为(2)
 可形成
可形成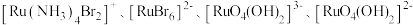 四种配离子且配离子中不存在非极性键,其中
四种配离子且配离子中不存在非极性键,其中 离子半径最小的配离子是
离子半径最小的配离子是 中
中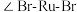 为
为 离子配体中N原子与中心
离子配体中N原子与中心 离子配位的原因是
离子配位的原因是
(3)
 的晶体结构如图2所示。
的晶体结构如图2所示。
①
 和
和 的电负性:
的电负性:
 (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为
(填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为②用
 表示阿伏伽德罗常数的值,晶胞参数为
表示阿伏伽德罗常数的值,晶胞参数为 ,
, ,则其密度为
,则其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
名校
解题方法
7 . W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,请用对应的的化学用语回答下列问题:
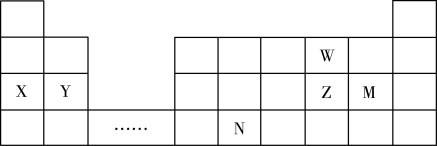
(1)N元素在周期表中的位置___________ ,根据周期表,推测N原子序数为___________
(2)比较Y、Z、W三种元素形成简单离子的半径由大到小的顺序___________ (用元素符号表示)
(3)M最高价氧化物的水化物在水中的电离方程式:___________
(4)以下说法正确的是___________
(5)由X、W元素构成的原子个数比为1:1的化合物所含化学键类型为___________ ,将一定量此化合物投入到足量的水中,产生2.24L气体(标准状况下),转移电子的物质的量为________ 。

(1)N元素在周期表中的位置
(2)比较Y、Z、W三种元素形成简单离子的半径由大到小的顺序
(3)M最高价氧化物的水化物在水中的电离方程式:
(4)以下说法正确的是___________
| A.单质的还原性:X>Y,可以用X与YM2溶液发生反应置换出Y来证明 |
| B.Y与同周期的ⅢA元素的原子序数相差1 |
| C.硅主要用于半导体器件的研制,目前用硅研发出的太阳能光伏电池,如我校的路灯 |
| D.元素N位于金属与非金属的分界线附近,可以推断N元素的单质可与氨水反应放出氢气 |
您最近一年使用:0次
解题方法
8 . 硼化合物在工农业和医药方面用途广泛。请回答:
(1) B(OH)3分子的空间结构(以B为中心)名称是_______ ,硼原子的杂化轨道类型是_______ 。B(OH)3的水溶液呈酸性的原因是_______
(2)Li、Be、B在元素周期表上处于相邻位置,正确的是_______。
(3)B与La形成的某化合物晶体结构如下图。立方体的每一个顶点上都有一个由硼原子框架形成的八面体,八面体又以顶点互相连接。该化合物的化学式为_______ ,该晶体中La的配位数是_______ 。

(1) B(OH)3分子的空间结构(以B为中心)名称是
(2)Li、Be、B在元素周期表上处于相邻位置,正确的是_______。
A.基态原子半径: | B.电负性: |
C.第一电离能: | D.第二电离能: |

您最近一年使用:0次
名校
解题方法
9 . 三卤化氮( )如
)如 、
、 等有广泛的用途。
等有广泛的用途。 是液晶显示器生产过程中常用的化学清洗剂,
是液晶显示器生产过程中常用的化学清洗剂, 可用于面粉的漂白和杀菌。回答下面问题:
可用于面粉的漂白和杀菌。回答下面问题:
(1)锑是制造液晶显示器的一种原材料,基态锑的价层电子排布式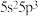 ,可知锑在元素周期表的位置是
,可知锑在元素周期表的位置是___________ 。基态锑原子中有___________ 个未成对电子,这些未成对电子具有___________ (填“相同”或“不同”)的自旋状态。
(2)元素F、O、N位于同一周期,其第一电离能由大到小的顺序是___________ ,原子半径由大到小的顺序是___________ 。
(3)液晶显示器材料因含微量杂质元素铬(Cr)而呈浅红色。基态铬原子的价层电子排布式为___________ 。液晶在放电过程中会产生 和
和 离子,其中N原子的杂化类型分别是
离子,其中N原子的杂化类型分别是___________ ,键角:
___________  (填“<”或“=”或“>”)。
(填“<”或“=”或“>”)。
(4)已知热稳定性 高于
高于 ,解释其原因是
,解释其原因是___________ 。常温常压下 为无色气体,
为无色气体, 为黄色油状液体,
为黄色油状液体, 和
和 价层电子对互斥模型均为
价层电子对互斥模型均为___________ , 和
和 的分子空间构型均为
的分子空间构型均为___________ 。
(5) 的晶胞结构如图所示,X代表的离子是
的晶胞结构如图所示,X代表的离子是___________ ;若该立方晶胞参数为apm, 的摩尔质量用
的摩尔质量用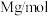 ,阿伏加德罗常数用
,阿伏加德罗常数用 来表示,则
来表示,则 晶体的密度=
晶体的密度=___________  (写出表达式)。
(写出表达式)。
 )如
)如 、
、 等有广泛的用途。
等有广泛的用途。 是液晶显示器生产过程中常用的化学清洗剂,
是液晶显示器生产过程中常用的化学清洗剂, 可用于面粉的漂白和杀菌。回答下面问题:
可用于面粉的漂白和杀菌。回答下面问题:(1)锑是制造液晶显示器的一种原材料,基态锑的价层电子排布式
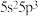 ,可知锑在元素周期表的位置是
,可知锑在元素周期表的位置是(2)元素F、O、N位于同一周期,其第一电离能由大到小的顺序是
(3)液晶显示器材料因含微量杂质元素铬(Cr)而呈浅红色。基态铬原子的价层电子排布式为
 和
和 离子,其中N原子的杂化类型分别是
离子,其中N原子的杂化类型分别是
 (填“<”或“=”或“>”)。
(填“<”或“=”或“>”)。(4)已知热稳定性
 高于
高于 ,解释其原因是
,解释其原因是 为无色气体,
为无色气体, 为黄色油状液体,
为黄色油状液体, 和
和 价层电子对互斥模型均为
价层电子对互斥模型均为 和
和 的分子空间构型均为
的分子空间构型均为(5)
 的晶胞结构如图所示,X代表的离子是
的晶胞结构如图所示,X代表的离子是 的摩尔质量用
的摩尔质量用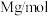 ,阿伏加德罗常数用
,阿伏加德罗常数用 来表示,则
来表示,则 晶体的密度=
晶体的密度= (写出表达式)。
(写出表达式)。
您最近一年使用:0次
2023-05-14更新
|
93次组卷
|
3卷引用:河北省石家庄市河北师范大学附属实验中学2024届高三上学期10月月考化学试题
解题方法
10 . 锂离子电池是目前广泛应用的二次电池。由于锂资源储量有限,科学家将目光转向钾离子电池。
(1) 用作钾离子电池的电解液溶剂,可由
用作钾离子电池的电解液溶剂,可由 与有机物X经加成反应得到。
与有机物X经加成反应得到。
① 中碳原子杂化方式为
中碳原子杂化方式为_______ 。
②X的结构简式为_______ 。
(2)由于离子半径:
_______  (填“>”或“<”),在充、放电过程中,
(填“>”或“<”),在充、放电过程中, 的嵌入、脱出会破坏锂离子电池正极材料的结构,应研发新的正极材料。
的嵌入、脱出会破坏锂离子电池正极材料的结构,应研发新的正极材料。
(3)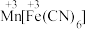 可用作钾离子电池的正极材料,其晶胞结构如下图所示。
可用作钾离子电池的正极材料,其晶胞结构如下图所示。

①距离 最近的
最近的 有
有_______ 个。
②第三电离能 :
: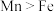 ,结合原子结构解释原因:
,结合原子结构解释原因:_______ 。
③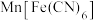 放电后转化为
放电后转化为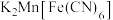 ,充电时物质的变化如下:
,充电时物质的变化如下: 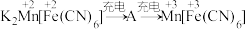 。充电时生成A的电极反应式:
。充电时生成A的电极反应式:_______ (请标注A中 和
和 的化合价)。
的化合价)。
(1)
 用作钾离子电池的电解液溶剂,可由
用作钾离子电池的电解液溶剂,可由 与有机物X经加成反应得到。
与有机物X经加成反应得到。①
 中碳原子杂化方式为
中碳原子杂化方式为②X的结构简式为
(2)由于离子半径:

 (填“>”或“<”),在充、放电过程中,
(填“>”或“<”),在充、放电过程中, 的嵌入、脱出会破坏锂离子电池正极材料的结构,应研发新的正极材料。
的嵌入、脱出会破坏锂离子电池正极材料的结构,应研发新的正极材料。(3)
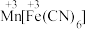 可用作钾离子电池的正极材料,其晶胞结构如下图所示。
可用作钾离子电池的正极材料,其晶胞结构如下图所示。
①距离
 最近的
最近的 有
有②第三电离能
 :
: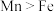 ,结合原子结构解释原因:
,结合原子结构解释原因:③
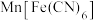 放电后转化为
放电后转化为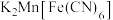 ,充电时物质的变化如下:
,充电时物质的变化如下: 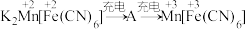 。充电时生成A的电极反应式:
。充电时生成A的电极反应式: 和
和 的化合价)。
的化合价)。
您最近一年使用:0次



