名校
1 . A、B、C、D、E五种原子序数均小于18的元素,且原子序数依次增大,其中B与C的电子层数相同,D与E的电子层数相同,A与D的最外层电子数相同,C与E的最外层电子数相同,E元素的原子最外层电子数是电子层数的2倍,D与其他具有相同电子层数的原子相比半径最大。又知由B元素组成的单质是空气中的主要成分。
(1)B的元素名称是_______ ,该元素的原子结构示意图为_______ ,核外有___ 个未成对电子,用电子式表示B的简单氢化物的形成过程_________ 。
(2)C、D、E三种元素形成的简单离子的半径由大到小的顺序是________ (用离子符号表示)。
(3)请在以上五种元素中任意选择几种元素,画出由这几种元素组成的离子化合物的电子式(画出1种即可)_____ 。
(4)以下说法正确的是________ 。
①B的氧化物均为酸性氧化物
②A和C形成的化合物中既可能存在极性共价键,也可能存在非极性共价键
③由A、B、C形成的化合物中不可能存在离子键
④D2E的熔沸点较高,硬度较大
(1)B的元素名称是
(2)C、D、E三种元素形成的简单离子的半径由大到小的顺序是
(3)请在以上五种元素中任意选择几种元素,画出由这几种元素组成的离子化合物的电子式(画出1种即可)
(4)以下说法正确的是
①B的氧化物均为酸性氧化物
②A和C形成的化合物中既可能存在极性共价键,也可能存在非极性共价键
③由A、B、C形成的化合物中不可能存在离子键
④D2E的熔沸点较高,硬度较大
您最近一年使用:0次
2024-01-21更新
|
133次组卷
|
2卷引用:上海市宜川中学2023-2024学年高三上学期期末考试化学试题
解题方法
2 . A、B、C、D、E、F、G均为常见短周期元素,原子序数依次递增。已知A、B、C能分别与D组成二元化合物K、L、M,甲、乙分别是B、D的单质,常温下分别是常见的固体和气体,化合物M是产生光化学烟雾的主要气体之一,丙是C的最高价氧化物对应的水化物,它们之间有如图所示转化关系。E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
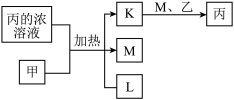
(1)C在元素周期表中的位置为_______ 。
(2)甲与丙的浓溶液反应的化学方程式为_______ 。
(3)化合物L的电子式为_______ ,M与水发生反应的化学方程式是_______ ,该反应的还原产物是_______ 。
(4)E、F、G形成的简单离子,半径由大到小顺序是_______ (用离子符号表示)。B、F、G元素的非金属性由强到弱的顺序_______ (用元素符号表示)。

(1)C在元素周期表中的位置为
(2)甲与丙的浓溶液反应的化学方程式为
(3)化合物L的电子式为
(4)E、F、G形成的简单离子,半径由大到小顺序是
您最近一年使用:0次
23-24高三上·江苏南通·期末
3 . 随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在元素周期表的位置是___________ 。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)___________ :___________>___________;比较g、h的最高价氧化物对应的水化物的酸性强弱是___________ :___________>___________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式___________ 。
(4)已知1mole的单质在足量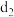 中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:
中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________ 。
(5)f和e的最高价氧化物水化物相互反应的离子方程式___________ 。

根据判断出的元素回答问题:
(1)f在元素周期表的位置是
(2)比较d、e常见离子的半径的小(用化学式表示,下同)
(3)任选上述元素组成一种四原子共价化合物,写出其电子式
(4)已知1mole的单质在足量
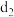 中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:
中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:(5)f和e的最高价氧化物水化物相互反应的离子方程式
您最近一年使用:0次
4 . W、X、Y、Z、R是原子序数依次递增的五种短周期元素,Y原子核外电子数与W、X的最外层电子数之和相等,Y原子半径是短周期元素原子半径中最大的,R最高正价与最低负价代数和为4,W的一种氢化物常作制冷剂,Z原子的电子层数与最外层电子数相等。回答下列问题:
(1)W元素的名称为___________ ,R元素在周期表中位于第三周期___________ 族。
(2)X、Z、R所形成的简单离子半径由大到小的顺序为___________ (用离子符号表示)。
(3)R的简单氢化物的电子式为___________ ;W、X的最简单氢化物稳定性关系:___________ (填氢化物化学式)。
(4)Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(5) 与
与 气体发生氧化还原反应,生成X的常见单质和一种盐,写出该反应的化学方程式:
气体发生氧化还原反应,生成X的常见单质和一种盐,写出该反应的化学方程式:___________ 。
(1)W元素的名称为
(2)X、Z、R所形成的简单离子半径由大到小的顺序为
(3)R的简单氢化物的电子式为
(4)Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物反应的离子方程式为
(5)
 与
与 气体发生氧化还原反应,生成X的常见单质和一种盐,写出该反应的化学方程式:
气体发生氧化还原反应,生成X的常见单质和一种盐,写出该反应的化学方程式:
您最近一年使用:0次
14-15高三上·上海嘉定·期末
5 . 一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s) KCl(l)+NaAlSi3O8(s)。
KCl(l)+NaAlSi3O8(s)。
(1)上述反应涉及的第三周期元素中,离子半径最小的是_______ (用元素符号表示)。Cl原子与Si原子可以形成的五核分子,其化学键长和键角都相等,则该物质为________ 分子(填“极性”或“非极性”)。
(2)表示原子或离子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式。从中选择最详尽描述核外电子运动状态的方式,来表示氧离子核外电子的运动状态:____________ 。
(3)上述元素的最高价氧化物对应水化物中,既能与强酸又能与强碱反应,其原因在于:__________ (用电离方程式表示)。
(4)Al与Cl可以形成分子晶体AlCl3,关于AlCl3溶液的说法错误的是___________ 。
A 水溶液中离子浓度大小:c(Cl-)>c(Al3+)> c(H+)>c(OH-)
B 升高温度,AlCl3水溶液pH减小,c(Al3+)减小
C c(Al3+)+c(H+)=c(Cl-)+c(OH-)
D c(Cl-)=3c(Al3+)+3c(AlO2-)
(5)不能用于比较Na与Al金属性相对强弱的事实是____________ 。
A 最高价氧化物对应水化物的碱性 B Na和AlCl3溶液反应
C 单质与H2O反应的难易程度 D 比较同浓度NaCl和AlCl3的pH值
(6)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为____________ 。用电子式表示Na2O2的形成过程:_________
 KCl(l)+NaAlSi3O8(s)。
KCl(l)+NaAlSi3O8(s)。(1)上述反应涉及的第三周期元素中,离子半径最小的是
(2)表示原子或离子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式。从中选择最详尽描述核外电子运动状态的方式,来表示氧离子核外电子的运动状态:
(3)上述元素的最高价氧化物对应水化物中,既能与强酸又能与强碱反应,其原因在于:
(4)Al与Cl可以形成分子晶体AlCl3,关于AlCl3溶液的说法错误的是
A 水溶液中离子浓度大小:c(Cl-)>c(Al3+)> c(H+)>c(OH-)
B 升高温度,AlCl3水溶液pH减小,c(Al3+)减小
C c(Al3+)+c(H+)=c(Cl-)+c(OH-)
D c(Cl-)=3c(Al3+)+3c(AlO2-)
(5)不能用于比较Na与Al金属性相对强弱的事实是
A 最高价氧化物对应水化物的碱性 B Na和AlCl3溶液反应
C 单质与H2O反应的难易程度 D 比较同浓度NaCl和AlCl3的pH值
(6)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为
您最近一年使用:0次
解题方法
6 . 因在航空、核能、电池等高技术领域的重要作用——锂被称为“21世纪的能源金属”。完成下列填空:
(1)锂位于元素周期表的________ 。锂的很多化学性质与镁相似,请依据元素周期律进行解释:_________ 。
(2)氢化锂(LiH)是离子化合物,写出其阴离子的电子式_______________ ,LiH中阴离子半径大于阳离子半径,其原因是__________________________________________________ 。
(3) 工业上用Li2CO3制取锂的化合物及金属锂。碳原子核外电子有________ 种不同能量的电子,其中有两个电子的能量最高且能量相等,这两个电子所处的轨道是_____________________ 。
(4)用Li2CO3、氨水和液溴制备LiBr·H2O的流程如下:

①合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:
Li2CO3+Br2+ NH3·H2O→LiBr+( )__________ 。
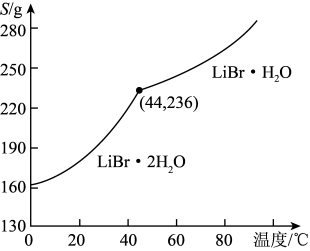
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到LiBr·H2O晶体的实验步骤:_____ 、过滤、用乙醇洗涤,干燥。
(1)锂位于元素周期表的
(2)氢化锂(LiH)是离子化合物,写出其阴离子的电子式
(3) 工业上用Li2CO3制取锂的化合物及金属锂。碳原子核外电子有
(4)用Li2CO3、氨水和液溴制备LiBr·H2O的流程如下:

①合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:
Li2CO3+Br2+ NH3·H2O→LiBr+( )
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到LiBr·H2O晶体的实验步骤:

您最近一年使用:0次
2019-01-14更新
|
236次组卷
|
3卷引用:【区级联考】上海市杨浦区2019届高三上学期等级考试模拟(期末)化学试题
解题方法
7 . 氯仿(CHCl3)不溶于水,但在一定条件下水解生成两种酸,其中一种是甲酸(HCOOH)。在19世纪氯仿广泛用于麻醉,可由“乙醛漂白粉法”制得。在光照条件下,氯仿易被空气氧化生成剧毒光气(COCl2)和一种化合物。因此氯仿需要小口钢罐贮存运输,使用前要检验其是否变质。
(1)CHCl3的电子式为__________ ,HCOOH中C的杂化方式为__________ ;
(2)漂白粉中三种元素的简单离子的半径的大小顺序为__________ (用离子符号表示);
(3)氯仿不溶于水而甲酸易溶于水的原因是__________ ;
(4)Fe2+的外围电子排布图为__________ ;
(5)纯铁的一种同素异形体的晶胞为面心立方晶胞,该晶体中原子的配位数为__________ ,若铁原子的半径为a cm,则该晶体的密度为__________ 。
(1)CHCl3的电子式为
(2)漂白粉中三种元素的简单离子的半径的大小顺序为
(3)氯仿不溶于水而甲酸易溶于水的原因是
(4)Fe2+的外围电子排布图为
(5)纯铁的一种同素异形体的晶胞为面心立方晶胞,该晶体中原子的配位数为
您最近一年使用:0次
解题方法
8 . X、Y、Z、W是元素周期表前四周期中原子序数依次增大的常见元素,其相关信息如下表:
回答下列问题:
(1)Y在元素周期表中的位置是________ ;X、Z的简单气态氢化物稳定性较弱的是____ (填化学式)。
(2)X的一种氢化物X2H4的分子中极性键和非极性键数目比为_______ ;Y的氯化物电子式为________ 。
(3)W的氧化物(W2O)跟X的最高价氧化物对应的水化物反应生成XO的离子方程式为_______ 。
| 元素 | 相关信息 |
| X | X的某种氢化物能使湿润的红色石蕊试纸变蓝 |
| Y | Y的一种核素质量数为24.中子数为12 |
| Z | Z的单质是良好的半导体材料,广泛应用于光电信息领域 |
| W | W的最高价氧化物对应水化物是一种不溶于水的蓝色固体 |
(1)Y在元素周期表中的位置是
(2)X的一种氢化物X2H4的分子中极性键和非极性键数目比为
(3)W的氧化物(W2O)跟X的最高价氧化物对应的水化物反应生成XO的离子方程式为
您最近一年使用:0次
9 . 铝及其化合物在日常生活、工业上有广泛的应用。
(1)铝原子核外有_____ 种不同运动状态的电子,有_____ 种能量不同的电子。
(2)氮化铝具有强度高,耐磨,抗腐蚀,熔点可达2200℃。推测氮化铝是______ 晶体,试比较组成该物质的两微粒半径大小____________________ 。
(3)可用铝和氧化钡反应可制备金属钡:2Al+4BaO 3Ba↑+BaO·Al2O3的主要原因是
3Ba↑+BaO·Al2O3的主要原因是 __________ (选填编号)。
(4)氢氧化铝在水中发生酸式电离的电离方程式为:____________________ ,
滴入少量盐酸,上述体系中Al3+浓度_______ (填“增加”、“减少”或“不变”)。
(5)工业上用氢氧化铝、氢氟酸和碳酸钠制取冰晶石(Na3AlF6)。其反应物中有两种元素在周期表中位置相邻,可比较它们金属性或非金属性强弱的是_______ (选填编号)。
a.气态氢化物的稳定性
b.最高价氧化物对应水化物的酸(碱)性
c.单质与氢气反应的难易
d.单质与同浓度酸发生反应的快慢
(6)冰晶石可做电解氧化铝的助熔剂,此反应中若有0.6mol电子转移,则在________ 极可得金属铝的质量为__________ 克。工业上不用电解氯化铝而是用电解氧化铝的方法获得铝单质的原因_____________________ 。
(1)铝原子核外有
(2)氮化铝具有强度高,耐磨,抗腐蚀,熔点可达2200℃。推测氮化铝是
(3)可用铝和氧化钡反应可制备金属钡:2Al+4BaO
 3Ba↑+BaO·Al2O3的主要原因是
3Ba↑+BaO·Al2O3的主要原因是 a.Al活泼性大于Ba | b.Ba沸点比Al的低 | c.BaO·Al2O3比Al2O3稳定 |
滴入少量盐酸,上述体系中Al3+浓度
(5)工业上用氢氧化铝、氢氟酸和碳酸钠制取冰晶石(Na3AlF6)。其反应物中有两种元素在周期表中位置相邻,可比较它们金属性或非金属性强弱的是
a.气态氢化物的稳定性
b.最高价氧化物对应水化物的酸(碱)性
c.单质与氢气反应的难易
d.单质与同浓度酸发生反应的快慢
(6)冰晶石可做电解氧化铝的助熔剂,此反应中若有0.6mol电子转移,则在
您最近一年使用:0次
10 . 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。请回答下列问题:
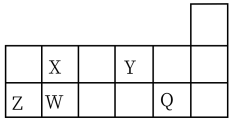
(1)W在周期表中的位置是__________ ,Y、Z的离子半径由大到小的顺序为__________ (用元素符号表示)。
(2)下列说法正确的是__________ 。
a.XY2和WY2都能溶于水生成对应的酸
b.Q的含氧酸的酸性比X的含氧酸的酸性强
c.X的最简单气态氢化物的稳定性大于W的最简单气态氢化物的稳定性
d.由NaOH溶液分别滴入MgQ2、ZQ3溶液中的反应现象可比较Mg和Z金属性的强弱
(3)自来水厂常用QY2对饮用水进行消毒,处理后的水中要求QY2的浓度在0.10~0.80mg·L-1之间。碘量法可以检测水中QY2的浓度,步骤如下:
操作1:取一定体积的水样,加入一定量的碘化钾,再用NaOH溶液调至中性,并加入淀粉溶液,溶液变蓝。
操作II:再加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2=S4O62-+2I-)
操作Ⅲ:然后再加硫酸调节水样pH至1~3。
操作时,不同pH环境中Q元素粒子种类及化合价如图所示:
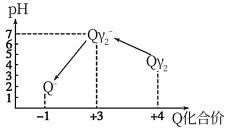
①操作I中反应的离子方程式是___________________ 。
②确定操作Ⅱ完全反应的现象是_________________ 。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是_________________ 。
④若水样的体积为1.0 L,在操作Ⅱ中消耗了 l.0×10-3mol·L-1的Na2S2O3溶液10 mL,则水样中QY2的浓度是_______ mg.L-1(精确到0.01)。

(1)W在周期表中的位置是
(2)下列说法正确的是
a.XY2和WY2都能溶于水生成对应的酸
b.Q的含氧酸的酸性比X的含氧酸的酸性强
c.X的最简单气态氢化物的稳定性大于W的最简单气态氢化物的稳定性
d.由NaOH溶液分别滴入MgQ2、ZQ3溶液中的反应现象可比较Mg和Z金属性的强弱
(3)自来水厂常用QY2对饮用水进行消毒,处理后的水中要求QY2的浓度在0.10~0.80mg·L-1之间。碘量法可以检测水中QY2的浓度,步骤如下:
操作1:取一定体积的水样,加入一定量的碘化钾,再用NaOH溶液调至中性,并加入淀粉溶液,溶液变蓝。
操作II:再加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2=S4O62-+2I-)
操作Ⅲ:然后再加硫酸调节水样pH至1~3。
操作时,不同pH环境中Q元素粒子种类及化合价如图所示:

①操作I中反应的离子方程式是
②确定操作Ⅱ完全反应的现象是
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是
④若水样的体积为1.0 L,在操作Ⅱ中消耗了 l.0×10-3mol·L-1的Na2S2O3溶液10 mL,则水样中QY2的浓度是
您最近一年使用:0次
2017-02-17更新
|
1148次组卷
|
3卷引用:2017届天津市五区县高三上学期期末考试化学试卷



