名校
1 . 硫酸亚铁铵[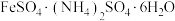 ,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
第一步:在圆底烧瓶中称取mg铁屑,再用量筒量取15mL 的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。
的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。 溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
第三步:冷却至室温,待有大量晶体析出时,减压过滤,用试剂N少量多次洗涤,干燥后,称得晶体质量为11.8g。计算产率。
回答下列问题:
(1)硫酸亚铁铵中组成元素的原子半径由大到小的顺序为___________ 。
(2)已知:Cr的3d比4p能量低得多,重铬酸钾具有二聚结构,它由两个通过氧原子键合在一起的铬原子组成,中心Cr为正四面体形,结构为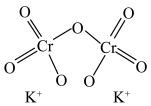 ,其中Cr原子的杂化方式为___________(填标号)。
,其中Cr原子的杂化方式为___________(填标号)。
(3)圆底烧瓶中生成 的离子方程式为
的离子方程式为___________ 。
(4)第二步中需要称量剩余铁屑质量的原因为___________ ,写出制备硫酸亚铁铵晶体的化学方程式:___________ 。
(5)试剂N是___________ 。
(6)准确称取0.8g硫酸亚铁铵晶体三份,分别放入三个250mL锥形瓶中,加入100mL水,20mL 的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用
的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用 重铬酸钾标准液进行滴定。
重铬酸钾标准液进行滴定。
①重铬酸钾在酸性条件下的还原产物为 ,写出该滴定反应的离子方程式:
,写出该滴定反应的离子方程式:___________ 。
②三次实验消耗标准液的体积分别是16.75mL、16.80mL、16.85mL,则硫酸亚铁铵晶体的纯度为___________ (写出含M的表达式)。
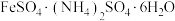 ,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:第一步:在圆底烧瓶中称取mg铁屑,再用量筒量取15mL
 的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。
的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。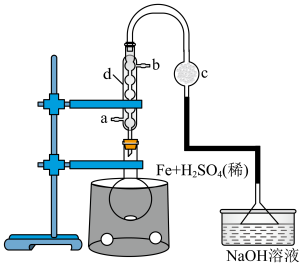
 溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。第三步:冷却至室温,待有大量晶体析出时,减压过滤,用试剂N少量多次洗涤,干燥后,称得晶体质量为11.8g。计算产率。
回答下列问题:
(1)硫酸亚铁铵中组成元素的原子半径由大到小的顺序为
(2)已知:Cr的3d比4p能量低得多,重铬酸钾具有二聚结构,它由两个通过氧原子键合在一起的铬原子组成,中心Cr为正四面体形,结构为
 ,其中Cr原子的杂化方式为___________(填标号)。
,其中Cr原子的杂化方式为___________(填标号)。A. | B. | C.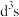 | D.sp |
(3)圆底烧瓶中生成
 的离子方程式为
的离子方程式为(4)第二步中需要称量剩余铁屑质量的原因为
(5)试剂N是
(6)准确称取0.8g硫酸亚铁铵晶体三份,分别放入三个250mL锥形瓶中,加入100mL水,20mL
 的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用
的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用 重铬酸钾标准液进行滴定。
重铬酸钾标准液进行滴定。①重铬酸钾在酸性条件下的还原产物为
 ,写出该滴定反应的离子方程式:
,写出该滴定反应的离子方程式:②三次实验消耗标准液的体积分别是16.75mL、16.80mL、16.85mL,则硫酸亚铁铵晶体的纯度为
您最近一年使用:0次
2024-05-26更新
|
112次组卷
|
2卷引用:2024届重庆市渝西中学高三下学期模拟预测化学试题
解题方法
2 . 下表为元素周期表的一部分。请回答下列问题:
(1)写出X元素的元素符号:______ 。
(2)C、N两种元素中,原子半径较小的是______ (填元素符号)。
(3)元素Y在元素周期表中的位置为______ 。
(4)写出Z的气态氢化物的电子式:______ 。
碳 | 氮 | Y | |
X | 硫 | Z |
(2)C、N两种元素中,原子半径较小的是
(3)元素Y在元素周期表中的位置为
(4)写出Z的气态氢化物的电子式:
您最近一年使用:0次
解题方法
3 . 已知A、B、C、D、E、F为短周期元素,其中C的原子序数最小,它们的最高正价与原子半径关系如图所示。
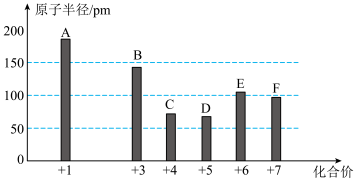
请回答下列问题:
(1)B元素在周期表中的位置为__________ ;D元素能与氢元素组成18电子分子,该分子含有的共价键类型为__________ (填“极性键”或“非极性键”)。
(2)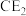 属于严禁携带的易燃易爆液体,其电子式为
属于严禁携带的易燃易爆液体,其电子式为__________ ;A、E、F三种元素形成的简单离子,半径由大到小的顺序是__________ (用离子符号表示)。
(3)写出元素A、B的最高价氧化物的水化物相互反应的离子方程式__________ 。
(4)用C元素的最简单氢化物和 在碱性条件下可以组成燃料电池,电极材料为多孔惰性金属电极;则通入C元素最简单氢化物的一极是该电池的
在碱性条件下可以组成燃料电池,电极材料为多孔惰性金属电极;则通入C元素最简单氢化物的一极是该电池的__________ 极,若线路中转移2mol电子,则消耗的 在标准状况下的体积为
在标准状况下的体积为__________ 。
(5)化合物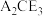 在农业上可用作杀虫剂,以及在工业上可用于处理废水中的重金属离子。向
在农业上可用作杀虫剂,以及在工业上可用于处理废水中的重金属离子。向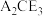 溶液中滴加酸性
溶液中滴加酸性 溶液,观察到溶液紫色褪去,并有无色无味气体产生,写出该反应的离子方程式
溶液,观察到溶液紫色褪去,并有无色无味气体产生,写出该反应的离子方程式__________ 。

请回答下列问题:
(1)B元素在周期表中的位置为
(2)
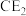 属于严禁携带的易燃易爆液体,其电子式为
属于严禁携带的易燃易爆液体,其电子式为(3)写出元素A、B的最高价氧化物的水化物相互反应的离子方程式
(4)用C元素的最简单氢化物和
 在碱性条件下可以组成燃料电池,电极材料为多孔惰性金属电极;则通入C元素最简单氢化物的一极是该电池的
在碱性条件下可以组成燃料电池,电极材料为多孔惰性金属电极;则通入C元素最简单氢化物的一极是该电池的 在标准状况下的体积为
在标准状况下的体积为(5)化合物
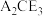 在农业上可用作杀虫剂,以及在工业上可用于处理废水中的重金属离子。向
在农业上可用作杀虫剂,以及在工业上可用于处理废水中的重金属离子。向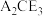 溶液中滴加酸性
溶液中滴加酸性 溶液,观察到溶液紫色褪去,并有无色无味气体产生,写出该反应的离子方程式
溶液,观察到溶液紫色褪去,并有无色无味气体产生,写出该反应的离子方程式
您最近一年使用:0次
名校
解题方法
4 . N、P及其化合物在工业生产中起着重要的作用。回答下列问题:
(1)由磷原子核形成的三种微粒:a.([Ne]3s23p3)、b.([Ne]3s23p2)、c.([Ne]3s23p24s1),半径由大到小的顺序为___________ (填标号,下同);再失去一个电子所需最低能量由大到小的顺序为___________ 。
(2)已知HSCN的结构有两种,这两种分子结构中除氢外各原子均满足八电子稳定结构(无配位键),请画出沸点高的分子的结构式___________ 。
(3)杂环化合物咪唑结构如图,其分子中的大π键可表示为 ,则其结合质子能力更强的氮原子是
,则其结合质子能力更强的氮原子是___________ (填“①”或“②”),其原因是___________ 。

(4)氮、铜形成的一种化合物,为立方晶系晶体,晶胞参数为apm,沿体对角线投影如下图所示。已知该晶胞中原子的分数坐标如下:Cu:(0,0, );(0,
);(0, ,0);(
,0);( ,0,0);N:(0,0,0),其中与Cu原子等距且最近的Cu原子有
,0,0);N:(0,0,0),其中与Cu原子等距且最近的Cu原子有___________ 个,则该化合物的化学式为___________ 。

(5)PCl5是一种白色晶体,其晶胞如图所示。该晶体熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。

①写出PCl5熔融时的电离方程式___________ 。
②若晶胞参数为anm,则晶体的密度为___________  (列出计算式)。
(列出计算式)。
(1)由磷原子核形成的三种微粒:a.([Ne]3s23p3)、b.([Ne]3s23p2)、c.([Ne]3s23p24s1),半径由大到小的顺序为
(2)已知HSCN的结构有两种,这两种分子结构中除氢外各原子均满足八电子稳定结构(无配位键),请画出沸点高的分子的结构式
(3)杂环化合物咪唑结构如图,其分子中的大π键可表示为
 ,则其结合质子能力更强的氮原子是
,则其结合质子能力更强的氮原子是
(4)氮、铜形成的一种化合物,为立方晶系晶体,晶胞参数为apm,沿体对角线投影如下图所示。已知该晶胞中原子的分数坐标如下:Cu:(0,0,
 );(0,
);(0, ,0);(
,0);( ,0,0);N:(0,0,0),其中与Cu原子等距且最近的Cu原子有
,0,0);N:(0,0,0),其中与Cu原子等距且最近的Cu原子有
(5)PCl5是一种白色晶体,其晶胞如图所示。该晶体熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。

①写出PCl5熔融时的电离方程式
②若晶胞参数为anm,则晶体的密度为
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2024-01-22更新
|
674次组卷
|
2卷引用:山东省名校联考2024届高三上学期模拟预测化学试题
5 . 硫、氮的化合物及其相互转化在促进社会进步、资源利用和环境保护中具有重要价值。
(1)下列与氮氧化物无关的环境问题是______。
(2)工业上先用NaOH溶液吸收SO2,再用CaO使NaOH再生:NaOH溶液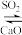 Na2SO3,使NaOH再生的原理是
Na2SO3,使NaOH再生的原理是___________ 。(用化学方程式表示)
(3)土壤中的硝酸盐会被细菌分解。有一种细菌是利用土壤中的硫化物来分解硝酸盐,其主要化学反应原理是:K2S + KNO3 +H2O =N2 +K2SO4 + KOH。
①K、S、N、O元素的原子半径从大到小的顺序是___________ 。
②上述反应中的各物质属于共价化合物是______ ;氧化剂是_______ 。
③配平上述反应方程式,并标出电子转移的方向和数目______ 。
④上述反应改变了土壤的成分,从而对农业生产产生一定的不利影响,请选择任一角度进行简要说明:________ 。
(4)氨水、NH4Cl、NH4HCO3、NH4HSO4是常见的氮肥。常温下等物质的量浓度的上述4种溶液中c( )最大的是______。
)最大的是______。
(5)某科研小组将微电池技术用于去除天然气中的H2S,装置如图所示,总反应是:2Fe+2H2S+O2=2FeS+2H2O。

①写出负极的电极反应式___________ 。
②一段时间后,单位时间内H2S的去除率降低,其可能的原因是________ 。
(1)下列与氮氧化物无关的环境问题是______。
| A.酸雨 | B.白色污染 | C.光化学烟雾 | D.温室效应 |
(2)工业上先用NaOH溶液吸收SO2,再用CaO使NaOH再生:NaOH溶液
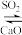 Na2SO3,使NaOH再生的原理是
Na2SO3,使NaOH再生的原理是(3)土壤中的硝酸盐会被细菌分解。有一种细菌是利用土壤中的硫化物来分解硝酸盐,其主要化学反应原理是:K2S + KNO3 +H2O =N2 +K2SO4 + KOH。
①K、S、N、O元素的原子半径从大到小的顺序是
②上述反应中的各物质属于共价化合物是
③配平上述反应方程式,并标出电子转移的方向和数目
④上述反应改变了土壤的成分,从而对农业生产产生一定的不利影响,请选择任一角度进行简要说明:
(4)氨水、NH4Cl、NH4HCO3、NH4HSO4是常见的氮肥。常温下等物质的量浓度的上述4种溶液中c(
 )最大的是______。
)最大的是______。| A.氨水 | B.NH4Cl | C.NH4HCO3 | D.NH4HSO4 |
(5)某科研小组将微电池技术用于去除天然气中的H2S,装置如图所示,总反应是:2Fe+2H2S+O2=2FeS+2H2O。

①写出负极的电极反应式
②一段时间后,单位时间内H2S的去除率降低,其可能的原因是
您最近一年使用:0次
解题方法
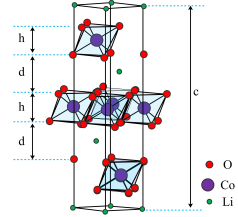
6 . 钴酸锂(LiCoO2)是常见的锂离子电池正极材料,其晶胞结构示意图如图。晶体中O围绕Co形成八面体,八面体共棱形成带负电的层状空间结构,与Li+层交替排列。在充放电过程中,Li+在层间脱出或嵌入。
(1)下列Li原子电子排布图表示的状态中,能量最低的是______ 。
(2)Li+与H-具有相同的电子构型,离子半径r(Li+)小于r(H-)的主要原因是______ 。
(3)观察该晶胞图示,其中Li处于晶胞顶点或晶胞内部,Co处于晶胞内部或晶胞侧棱上,而O的位置不易观察。结合钴酸锂(LiCoO2)化学式,可推断该晶胞中O的个数为______ 。
(4)晶胞底面为菱形,晶胞高度为cnm,Co和O组成八面体层高度为hnm,计算两层间的距离d=______ nm。(列出计算式)
(5)Li+在______ (填“充电”或“放电”)过程中会从八面体层间脱出。该过程会导致晶胞高度c变大,解释原因:______ 。

(1)下列Li原子电子排布图表示的状态中,能量最低的是
A.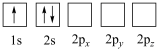 | B.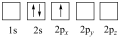 |
C.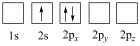 | D. |
(2)Li+与H-具有相同的电子构型,离子半径r(Li+)小于r(H-)的主要原因是
(3)观察该晶胞图示,其中Li处于晶胞顶点或晶胞内部,Co处于晶胞内部或晶胞侧棱上,而O的位置不易观察。结合钴酸锂(LiCoO2)化学式,可推断该晶胞中O的个数为
(4)晶胞底面为菱形,晶胞高度为cnm,Co和O组成八面体层高度为hnm,计算两层间的距离d=
(5)Li+在
您最近一年使用:0次
解题方法
7 . Li3OX(图a)和Li2OHX(图b)的晶胞结构,如图所示。
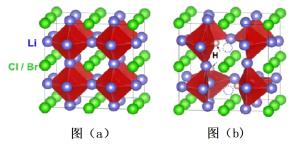
请回答下列问题:
(1)基态氯原子的价层电子排布式为_____ 。基态溴原子核外电子有_____ 种不同的空间运动状态。
(2)离子半径,r(Li+)=76pm,r(H-)=208pm,H-半径大于Li+的原因是_____ 。
(3)下列含锂的粒子中,失去1个电子需要的能量最低的是_____。
(4)已知几种元素的电负性数据如下:
①PBr3分子的空间结构是_____ 。在H2O、HCl、HBr、PH3中,共价键极性最弱的是_____ (填化学式)。。
②已知PCl5分子中P原子的s、p、d轨道参与杂化。试解释存在PCl5,不存在NCl5的主要原因可能是_____ 。
③在LiH、Li2O、LiCl、LiBr中,离子键百分率最高的是_____ (填化学式)。
(5)1个图b(Li2OHCl)晶胞的质量为_____ g(只列计算式)。
(6)如图a,晶胞参数为Apm,NA为阿伏加德罗常数的值。Li3OBr晶体密度为_____ g·cm-3(只列计算式)。

请回答下列问题:
(1)基态氯原子的价层电子排布式为
(2)离子半径,r(Li+)=76pm,r(H-)=208pm,H-半径大于Li+的原因是
(3)下列含锂的粒子中,失去1个电子需要的能量最低的是_____。
| A.1s22s1 | B.1s2 | C.1s12s1 | D.1s23s1 |
| 元素 | O | H | Cl | Br | P |
| 电负性 | 3.5 | 2.1 | 3.0 | 2.8 | 2.1 |
②已知PCl5分子中P原子的s、p、d轨道参与杂化。试解释存在PCl5,不存在NCl5的主要原因可能是
③在LiH、Li2O、LiCl、LiBr中,离子键百分率最高的是
(5)1个图b(Li2OHCl)晶胞的质量为
(6)如图a,晶胞参数为Apm,NA为阿伏加德罗常数的值。Li3OBr晶体密度为
您最近一年使用:0次
解题方法
8 .  是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
(1) 与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为
与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为___________ 。
(2) 可形成
可形成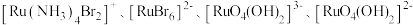 四种配离子且配离子中不存在非极性键,其中
四种配离子且配离子中不存在非极性键,其中 离子半径最小的配离子是
离子半径最小的配离子是___________ ,具有对称结构的 中
中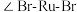 为
为___________ 。图1中通过螯合作用形成配位键的N原子的杂化方式为___________ , 离子配体中N原子与中心
离子配体中N原子与中心 离子配位的原因是
离子配位的原因是___________ 。

(3) 的晶体结构如图2所示。
的晶体结构如图2所示。
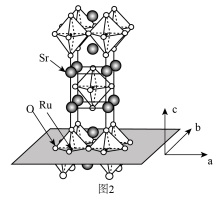
① 和
和 的电负性:
的电负性:
___________  (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为
(填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为___________ 形。
②用 表示阿伏伽德罗常数的值,晶胞参数为
表示阿伏伽德罗常数的值,晶胞参数为 ,
, ,则其密度为
,则其密度为___________  (列出计算式即可)。
(列出计算式即可)。
 是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:(1)
 与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为
与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为(2)
 可形成
可形成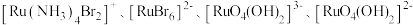 四种配离子且配离子中不存在非极性键,其中
四种配离子且配离子中不存在非极性键,其中 离子半径最小的配离子是
离子半径最小的配离子是 中
中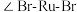 为
为 离子配体中N原子与中心
离子配体中N原子与中心 离子配位的原因是
离子配位的原因是
(3)
 的晶体结构如图2所示。
的晶体结构如图2所示。
①
 和
和 的电负性:
的电负性:
 (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为
(填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为②用
 表示阿伏伽德罗常数的值,晶胞参数为
表示阿伏伽德罗常数的值,晶胞参数为 ,
, ,则其密度为
,则其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解题方法
9 . 硼化合物在工农业和医药方面用途广泛。请回答:
(1) B(OH)3分子的空间结构(以B为中心)名称是_______ ,硼原子的杂化轨道类型是_______ 。B(OH)3的水溶液呈酸性的原因是_______
(2)Li、Be、B在元素周期表上处于相邻位置,正确的是_______。
(3)B与La形成的某化合物晶体结构如下图。立方体的每一个顶点上都有一个由硼原子框架形成的八面体,八面体又以顶点互相连接。该化合物的化学式为_______ ,该晶体中La的配位数是_______ 。

(1) B(OH)3分子的空间结构(以B为中心)名称是
(2)Li、Be、B在元素周期表上处于相邻位置,正确的是_______。
A.基态原子半径: | B.电负性: |
C.第一电离能: | D.第二电离能: |

您最近一年使用:0次
解题方法
10 . 锂离子电池是目前广泛应用的二次电池。由于锂资源储量有限,科学家将目光转向钾离子电池。
(1) 用作钾离子电池的电解液溶剂,可由
用作钾离子电池的电解液溶剂,可由 与有机物X经加成反应得到。
与有机物X经加成反应得到。
① 中碳原子杂化方式为
中碳原子杂化方式为_______ 。
②X的结构简式为_______ 。
(2)由于离子半径:
_______  (填“>”或“<”),在充、放电过程中,
(填“>”或“<”),在充、放电过程中, 的嵌入、脱出会破坏锂离子电池正极材料的结构,应研发新的正极材料。
的嵌入、脱出会破坏锂离子电池正极材料的结构,应研发新的正极材料。
(3)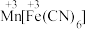 可用作钾离子电池的正极材料,其晶胞结构如下图所示。
可用作钾离子电池的正极材料,其晶胞结构如下图所示。

①距离 最近的
最近的 有
有_______ 个。
②第三电离能 :
: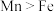 ,结合原子结构解释原因:
,结合原子结构解释原因:_______ 。
③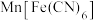 放电后转化为
放电后转化为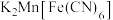 ,充电时物质的变化如下:
,充电时物质的变化如下: 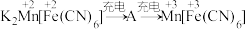 。充电时生成A的电极反应式:
。充电时生成A的电极反应式:_______ (请标注A中 和
和 的化合价)。
的化合价)。
(1)
 用作钾离子电池的电解液溶剂,可由
用作钾离子电池的电解液溶剂,可由 与有机物X经加成反应得到。
与有机物X经加成反应得到。①
 中碳原子杂化方式为
中碳原子杂化方式为②X的结构简式为
(2)由于离子半径:

 (填“>”或“<”),在充、放电过程中,
(填“>”或“<”),在充、放电过程中, 的嵌入、脱出会破坏锂离子电池正极材料的结构,应研发新的正极材料。
的嵌入、脱出会破坏锂离子电池正极材料的结构,应研发新的正极材料。(3)
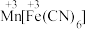 可用作钾离子电池的正极材料,其晶胞结构如下图所示。
可用作钾离子电池的正极材料,其晶胞结构如下图所示。
①距离
 最近的
最近的 有
有②第三电离能
 :
: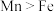 ,结合原子结构解释原因:
,结合原子结构解释原因:③
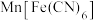 放电后转化为
放电后转化为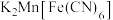 ,充电时物质的变化如下:
,充电时物质的变化如下: 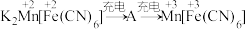 。充电时生成A的电极反应式:
。充电时生成A的电极反应式: 和
和 的化合价)。
的化合价)。
您最近一年使用:0次



