真题
解题方法
1 . 氮和氧是构建化合物的常见元素。
(1)某化合物的晶胞如图,其化学式是_______ ,晶体类型是_______ 。
(2)下列说法正确的是_______。
(3)① ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为_______ ;比较键角 中的
中的
_______  中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由_______ 。
②将 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
_______  (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式_______ 。
已知: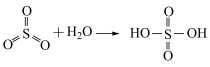
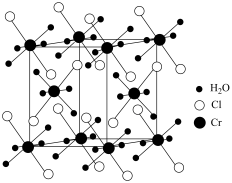
(1)某化合物的晶胞如图,其化学式是
(2)下列说法正确的是_______。
A.电负性: | B.离子半径: |
C.第一电离能: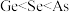 | D.基态 2+的简化电子排布式: 2+的简化电子排布式: |
(3)①
 ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为 中的
中的
 中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由②将
 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
 (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式
您最近一年使用:0次
2023高三·全国·专题练习
2 . 我国科学家使用了新的铝铍埋藏测年法测量北京猿人的生存年代。这种方法的测量对象是石英(二氧化硅),它是砂石的主要成分。当宇宙射线打到地面时,会将石英中的硅原子和氧原子打破,生成铝和铍的同位素。只要测出一块石头中26Al和10Be的含量,就能推算出它被埋入地下的时间。完成下列填空:
(1)画出Be的核外价电子排布轨道式___________ 。Be所在的周期中,最外层有2个未成对电子的元素的符号是___________ 、___________ 。
(2)写出Al的最外层电子排布式___________ 。铝原子核外有___________ 种运动状态不同的电子;铝原子核外有___________ 种能量不同的电子。有一种与26Al中子数相同的硅的核素,写出该核素符号___________ ,该硅电负性___________ (填“大于”或“小于”)Al 。
(3)比较Al3+、S2-和Cl-半径由大到小的顺序___________ ;这3种元素最高价氧化物对应的水化物中酸性最强的是___________ (写化学式)。
(4)铝单质在氧气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:___________ 。
(1)画出Be的核外价电子排布轨道式
(2)写出Al的最外层电子排布式
(3)比较Al3+、S2-和Cl-半径由大到小的顺序
(4)铝单质在氧气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:
您最近一年使用:0次
2023高三·全国·专题练习
3 . 有位于前四周期的A、B、C、D、E、F、G七种元素(无稀有气体),它们的核电荷数依次增大。其中C、F、G是金属元素:A和F属同族,它们原子的最外层电子排布式为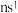 。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。G元素原子共有3个价电子,其中一个价电子位于第三能层d轨道。请回答下列问题:
。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。G元素原子共有3个价电子,其中一个价电子位于第三能层d轨道。请回答下列问题:
(1)G是___________ (用元素符号回答,下同),其最高化合价为___________ 。
(2)元素E的电子所占据的最高能级的原子轨道呈___________ 形。D、E可分别与A形成的最简分子,前者的稳定性弱于后者,从化学键的角度解释的原因是___________ ;
(3)B、C、D、F的简单离子半径由大到小的顺序为:___________ 。
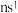 。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。G元素原子共有3个价电子,其中一个价电子位于第三能层d轨道。请回答下列问题:
。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。G元素原子共有3个价电子,其中一个价电子位于第三能层d轨道。请回答下列问题:(1)G是
(2)元素E的电子所占据的最高能级的原子轨道呈
(3)B、C、D、F的简单离子半径由大到小的顺序为:
您最近一年使用:0次
2023高三·全国·专题练习
4 . 氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是_______ 。根据对角线规则,B的一些化学性质与元素_______ 的相似。
(2)NH3BH3分子中,N—B化学键称为_______ 键,其电子对由_______ 提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH +B3O
+B3O +9H2。B3O
+9H2。B3O 的结构为
的结构为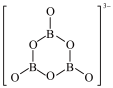 。在该反应中,B原子的杂化轨道类型由
。在该反应中,B原子的杂化轨道类型由_______ 变为_______ 。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是_______ 。
(4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
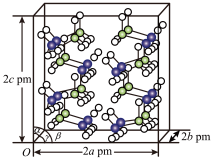
氨硼烷晶体的密度ρ=_______ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
(1)H、B、N中,原子半径最大的是
(2)NH3BH3分子中,N—B化学键称为
 +B3O
+B3O +9H2。B3O
+9H2。B3O 的结构为
的结构为 。在该反应中,B原子的杂化轨道类型由
。在该反应中,B原子的杂化轨道类型由(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是
(4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。

氨硼烷晶体的密度ρ=
您最近一年使用:0次
2023高三·全国·专题练习
5 . 现有部分元素的原子结构特点如下表所示:
(1)画出G原子结构示意图:____________________ 。
(2)元素X与元素Z相比,非金属性较强的是_________________ (填元素名称),写出一个能表示X、Z非金属性强弱关系的化学方程式:_________ 。
(3)X、Y、Z、G四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为___ 。
(4)元素X和元素Y以原子个数比为1∶1形成的化合物Q,元素G和元素Y化合形成的化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的,且在自然界中稳定存在的物质,写出该反应的化学方程式:________ 。
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
G | 最外层电子数是次外层电子数的2.5倍 |
(2)元素X与元素Z相比,非金属性较强的是
(3)X、Y、Z、G四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为
(4)元素X和元素Y以原子个数比为1∶1形成的化合物Q,元素G和元素Y化合形成的化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的,且在自然界中稳定存在的物质,写出该反应的化学方程式:
您最近一年使用:0次
名校
解题方法
6 . W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,请用对应的的化学用语回答下列问题:
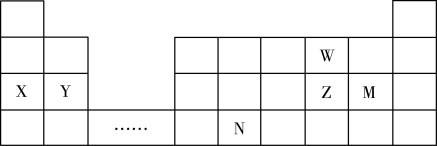
(1)N元素在周期表中的位置___________ ,根据周期表,推测N原子序数为___________
(2)比较Y、Z、W三种元素形成简单离子的半径由大到小的顺序___________ (用元素符号表示)
(3)M最高价氧化物的水化物在水中的电离方程式:___________
(4)以下说法正确的是___________
(5)由X、W元素构成的原子个数比为1:1的化合物所含化学键类型为___________ ,将一定量此化合物投入到足量的水中,产生2.24L气体(标准状况下),转移电子的物质的量为________ 。

(1)N元素在周期表中的位置
(2)比较Y、Z、W三种元素形成简单离子的半径由大到小的顺序
(3)M最高价氧化物的水化物在水中的电离方程式:
(4)以下说法正确的是___________
| A.单质的还原性:X>Y,可以用X与YM2溶液发生反应置换出Y来证明 |
| B.Y与同周期的ⅢA元素的原子序数相差1 |
| C.硅主要用于半导体器件的研制,目前用硅研发出的太阳能光伏电池,如我校的路灯 |
| D.元素N位于金属与非金属的分界线附近,可以推断N元素的单质可与氨水反应放出氢气 |
您最近一年使用:0次
解题方法
7 . 一种新型硫酸盐功能电解液由2mol·L-1Na2SO4和0.3mol·L-1MgSO4混合组成,电化学测试表明该电解液构建的Na2Ni[Fe(CN)6]、NaTi2(PO4)3/C电池可以稳定循环500次以上。
请回答下列问题:
(1)MgSO4中三种原子的半径由大到小的顺序是___________ (用元素符号表示),其中电负性最大的元素是___________ (填名称)。
(2)第一电离能N>O的原因是___________ 。
(3)Na2Ni[Fe(CN)6]中,基态Fe2+核外电子的空间运动状态有___________ 种,[Fe(CN)6]4-中σ键和π键的数目之比为___________ 。
(4)NaTi2(PO4)3中, 中磷原子的杂化类型是
中磷原子的杂化类型是___________ 。
(5)N、O两种元素形成的简单氢化物的熔点:NH3___________ H2O(填“>”“<”或“=”),其原因是___________ 。
(6)NiaMgbFec的立方晶胞结构如图所示。已知晶胞的边长为npm,设NA为阿伏加德罗常数的值。

①a:b:c=___________ 。
②该晶体密度是___________ g·cm-3(用含n、NA的代数式表示)。
请回答下列问题:
(1)MgSO4中三种原子的半径由大到小的顺序是
(2)第一电离能N>O的原因是
(3)Na2Ni[Fe(CN)6]中,基态Fe2+核外电子的空间运动状态有
(4)NaTi2(PO4)3中,
 中磷原子的杂化类型是
中磷原子的杂化类型是(5)N、O两种元素形成的简单氢化物的熔点:NH3
(6)NiaMgbFec的立方晶胞结构如图所示。已知晶胞的边长为npm,设NA为阿伏加德罗常数的值。

①a:b:c=
②该晶体密度是
您最近一年使用:0次
2023-04-26更新
|
279次组卷
|
3卷引用:专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)
(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)河南省名校大联考2023届高三下学期三模考试理综化学试题新疆疏附县第一中学2023-2024学年高三上学期开学摸底测试化学试题
2023高三·全国·专题练习
8 . W、X、Y、Z为原子序数依次增大的短周期主族元素,Y的原子序数等于W与X的原子序数之和,Z的最外层电子数为K层的一半,W与X可形成原子个数比为2:1的18e-分子。
(1)简单离子半径:Z>X>Y_______ ;
(2)X和Y的最简单氢化物的沸点:X>Y_______ 。
(1)简单离子半径:Z>X>Y
(2)X和Y的最简单氢化物的沸点:X>Y
您最近一年使用:0次
2023高三·全国·专题练习
9 . 我国嫦娥五号探测器带回1.731kg的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z原子序数依次增大,最外层电子数之和为15,X、Y、Z为同周期相邻元素,且均不与W同族。
(1)四种元素原子半径由大到小的顺序为W>X>Y>Z_______ ;
(2)Z的氧化物的水化物的酸性强于碳酸_______ 。
(1)四种元素原子半径由大到小的顺序为W>X>Y>Z
(2)Z的氧化物的水化物的酸性强于碳酸
您最近一年使用:0次
2023高三·全国·专题练习
10 . 冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并随着环的大小不同而与不同金属离子作用。

(1) 的体积与X的空腔大小相近,恰好能进入X的环内,且
的体积与X的空腔大小相近,恰好能进入X的环内,且 与氧原子的一对孤电子对作用形成稳定结构W(如图)。
与氧原子的一对孤电子对作用形成稳定结构W(如图)。
①基态锂离子核外能量最高的电子所处电子层符号为_______ 。
②W中 与孤电子对之间的作用属于
与孤电子对之间的作用属于_______ (填字母)。
A.离子键 B.共价键 C.配位键 D.氢键 E.以上都不是
(2)冠醚Y能与 形成稳定结构,但不能与
形成稳定结构,但不能与 形成稳定结构。理由是
形成稳定结构。理由是_______ 。
(3)烯烃难溶于水,被 水溶液氧化的效果较差。若烯烃中溶入冠醚Z,氧化效果明显提升。
水溶液氧化的效果较差。若烯烃中溶入冠醚Z,氧化效果明显提升。
①水分子中键角_______ (填“>”“<”或“=”) 。
。
②已知:冠醚Z与 可以发生如图所示的变化。加入冠醚Z后,烯烃的氧化效果明显提升的原因是
可以发生如图所示的变化。加入冠醚Z后,烯烃的氧化效果明显提升的原因是_______ 。


(1)
 的体积与X的空腔大小相近,恰好能进入X的环内,且
的体积与X的空腔大小相近,恰好能进入X的环内,且 与氧原子的一对孤电子对作用形成稳定结构W(如图)。
与氧原子的一对孤电子对作用形成稳定结构W(如图)。①基态锂离子核外能量最高的电子所处电子层符号为
②W中
 与孤电子对之间的作用属于
与孤电子对之间的作用属于A.离子键 B.共价键 C.配位键 D.氢键 E.以上都不是
(2)冠醚Y能与
 形成稳定结构,但不能与
形成稳定结构,但不能与 形成稳定结构。理由是
形成稳定结构。理由是(3)烯烃难溶于水,被
 水溶液氧化的效果较差。若烯烃中溶入冠醚Z,氧化效果明显提升。
水溶液氧化的效果较差。若烯烃中溶入冠醚Z,氧化效果明显提升。①水分子中键角
 。
。②已知:冠醚Z与
 可以发生如图所示的变化。加入冠醚Z后,烯烃的氧化效果明显提升的原因是
可以发生如图所示的变化。加入冠醚Z后,烯烃的氧化效果明显提升的原因是
您最近一年使用:0次



