名校
1 . 如图所示为元素周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是___________ (填编号);④⑤⑥⑦⑧五种元素形成的稳定离子中,离子半径最小的是___________ (填离子符号)。
(2)某元素原子的价层电子排布式为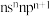 ,该元素原子的最外层电子的孤电子对数为
,该元素原子的最外层电子的孤电子对数为___________ ,该元素的第一电离能___________ (填“大于”“等于”或“小于”)原子的价层电子排布式为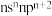 的元素。
的元素。
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与 溶液反应的化学方程式:
溶液反应的化学方程式:___________ 。
(4)上述10种元素形成的最高价氧化物对应水化物中,酸性最强的是___________ (填化学式)。
(5)下列各组微粒的空间结构相同的是___________ (填序号)。
① 和
和 ②
② 和
和 ③
③ 和
和 ④
④ 和
和 ⑤
⑤ 和
和 ⑥
⑥ 和
和 ⑦
⑦ 和
和

请回答下列问题:
(1)表中属于d区的元素是
(2)某元素原子的价层电子排布式为
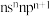 ,该元素原子的最外层电子的孤电子对数为
,该元素原子的最外层电子的孤电子对数为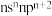 的元素。
的元素。(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与
 溶液反应的化学方程式:
溶液反应的化学方程式:(4)上述10种元素形成的最高价氧化物对应水化物中,酸性最强的是
(5)下列各组微粒的空间结构相同的是
①
 和
和 ②
② 和
和 ③
③ 和
和 ④
④ 和
和 ⑤
⑤ 和
和 ⑥
⑥ 和
和 ⑦
⑦ 和
和
您最近一年使用:0次
名校
2 . 类比法是一种学习化学的重要方法,下列类比结论正确的是
| A.AlCl3是共价化合物,则 BeCl2也是共价化合物 |
| B.N2分子中存在N≡N键,化学性质稳定,则CH≡CH化学性质稳定 |
| C.NaCl固体与浓硫酸共热可制 HCl,则NaI固体与浓硫酸共热可制 HI |
| D.卤素单质中 F₂熔点最低,则碱金属元素单质中 Li 的熔点最低 |
您最近一年使用:0次
名校
解题方法
3 . 类比法是一种学习化学的重要方法,下列类比法结论正确的是
| A.AlCl3是共价化合物,则BeCl2也是共价化合物 |
| B.C2H5OH分子间可以形成氢键,则CH3CHO分子间也可以形成氢键 |
| C.NaCl固体与浓硫酸共热可制HCl,则NaI固体与浓硫酸共热可制HI |
| D.卤素单质中F2熔点最低,则碱金属元素单质中Li的熔点最低 |
您最近一年使用:0次
2023-06-02更新
|
293次组卷
|
2卷引用:辽宁省东北育才学校科学高中部2023届高三最后一次模拟考试化学试题
解题方法
4 . 锗是一种呈灰白色的稀有金属,在自然界中的分布极为分散,所以很难看到有独立成矿的锗,一般与含硫化物的铅、锌、铜以及特定的煤炭伴生,提取比较麻烦,产量也不高。如图为工业上利用锗锌矿(主要成分GeO2和ZnS少量Fe2O3)来制备高纯度锗的流程。
已知:1.GeCl4沸点低(83.1℃)易水解,在浓盐酸中溶解度低。
2.GeO2可溶于强碱溶液,生成锗酸盐。

(1)根据元素周期表中位置推测,锗和砷元素最高正价含氧酸的酸性: > (用含氧酸化学式表示)__ 。滤渣2中除含有MgGeO3外,还含有少量__ 。
(2)步骤⑤中加入浓盐酸,发生主要反应的化学方程式为__ ,不用稀盐酸的原因是__ 。
(3)步骤⑥发生反应的化学方程式为__ 。
(4)如表是不同镁化合物对锗回收率的影响,实验中选用MgCl2、MgSO4或MgO作为沉淀剂,以及不同n(Mg)/n(Ge)条件下锗的回收率。
表1不同Mg/Ge摩尔比条件下的错回收率/%
表2不同镁化合物对锗回收率的影响
由表1可知工业上n(Mg)/n(Ge)=__ ,锗的回收率比较理想,由表2可知,MgCl2与MgSO4作为沉淀剂,锗的回收率都比较理想,而MgO的沉淀效果不理想,这可能是因为__ 。
(5)用氢气还原GeO2可制得金属锗。其反应如下:①GeO2+H2=GeO+H2O②GeO+H2=Ge+H2O③GeO2+2H2=Ge+2H2O。反应式③△H=+13728kJ•mol-1,△S=+15600J/(K•mol-1),则还原反应的温度一般控制在__ ℃范围内。【已知GeO在700℃会升华,T(K)=t(℃)+273】
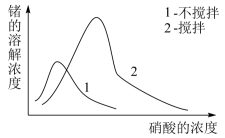
(6)锗的性质与铝相似,锗在硝酸中的溶解速度受硝酸浓度、搅拌速度、温度等因素影响。如图,锗溶解速度有最大值,硝酸的浓度小于此值时,随浓度增加溶解速度增加,反之降低,这是由于硝酸浓度高时锗表面被__ 所致。
已知:1.GeCl4沸点低(83.1℃)易水解,在浓盐酸中溶解度低。
2.GeO2可溶于强碱溶液,生成锗酸盐。

(1)根据元素周期表中位置推测,锗和砷元素最高正价含氧酸的酸性: > (用含氧酸化学式表示)
(2)步骤⑤中加入浓盐酸,发生主要反应的化学方程式为
(3)步骤⑥发生反应的化学方程式为
(4)如表是不同镁化合物对锗回收率的影响,实验中选用MgCl2、MgSO4或MgO作为沉淀剂,以及不同n(Mg)/n(Ge)条件下锗的回收率。
表1不同Mg/Ge摩尔比条件下的错回收率/%
| 水解母液 | n(Mg)/n(Ge) | |||||
| 0 | 0.5 | 1 | 1.5 | 2 | 2.5 | |
| 1# | 65.3 | 92.4 | 95.9 | 98.5 | 99.1 | 99.1 |
| 2# | 57.1 | 90.5 | 94.9 | 98.2 | 98.8 | 98.9 |
| 3# | 41.6 | 87.1 | 93.1 | 97.5 | 98.5 | 98.5 |
表2不同镁化合物对锗回收率的影响
| 镁化合物 | 回收率/% |
| MgCl2 | 98.3 |
| MgSO4 | 98.2 |
| MgO | 85.3 |
由表1可知工业上n(Mg)/n(Ge)=
(5)用氢气还原GeO2可制得金属锗。其反应如下:①GeO2+H2=GeO+H2O②GeO+H2=Ge+H2O③GeO2+2H2=Ge+2H2O。反应式③△H=+13728kJ•mol-1,△S=+15600J/(K•mol-1),则还原反应的温度一般控制在
(6)锗的性质与铝相似,锗在硝酸中的溶解速度受硝酸浓度、搅拌速度、温度等因素影响。如图,锗溶解速度有最大值,硝酸的浓度小于此值时,随浓度增加溶解速度增加,反之降低,这是由于硝酸浓度高时锗表面被

您最近一年使用:0次
名校
5 . 氨硼烷(NH3BH3)和乙烷的结构相似,含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。下列说法错误的是
| A.H、B、N三种元素中,电负性最大的是N |
| B.根据对角线规则,B、Si最高价氧化物对应的水化物均为二元酸 |
| C.氨硼烷N采取sp3杂化,B采取sp3杂化 |
| D.NH3BH3属于分子晶体,晶体中存在的化学键有极性键和配位键 |
您最近一年使用:0次
2021-05-03更新
|
341次组卷
|
3卷引用:辽宁省朝阳市2021届高三下学期3月普通高等学校招生全国统一模拟(一模) 化学试题
辽宁省朝阳市2021届高三下学期3月普通高等学校招生全国统一模拟(一模) 化学试题河南省辉县市一中2020-2021学年高二下学期第二次阶段性考试化学试题(已下线)卷14 物质结构与性质选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)
6 . 下列关于物质结构和性质的命题中,正确的有项
①氯乙酸(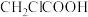 )的
)的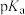 大于乙酸(
大于乙酸( )的
)的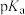
② 的键角大于
的键角大于
③氨水中大部分 与
与 以氢键结合成
以氢键结合成 分子,根据氨水的性质可知
分子,根据氨水的性质可知 的结构式可记为:
的结构式可记为:
④ 、
、 中阴阳离子个数比相同
中阴阳离子个数比相同
⑤根据对角线规则, 是两性氢氧化物
是两性氢氧化物
⑥价层电子对包括 键电子对,
键电子对, 键电子对和孤电子对
键电子对和孤电子对
⑦ 和
和 的中心原子都是
的中心原子都是 杂化
杂化
①氯乙酸(
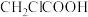 )的
)的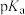 大于乙酸(
大于乙酸( )的
)的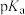
②
 的键角大于
的键角大于
③氨水中大部分
 与
与 以氢键结合成
以氢键结合成 分子,根据氨水的性质可知
分子,根据氨水的性质可知 的结构式可记为:
的结构式可记为:
④
 、
、 中阴阳离子个数比相同
中阴阳离子个数比相同⑤根据对角线规则,
 是两性氢氧化物
是两性氢氧化物⑥价层电子对包括
 键电子对,
键电子对, 键电子对和孤电子对
键电子对和孤电子对⑦
 和
和 的中心原子都是
的中心原子都是 杂化
杂化| A.2项 | B.3项 | C.4项 | D.5项 |
您最近一年使用:0次
名校
解题方法
7 . 应用元素周期律的有关知识进行的下列预测中,正确的有几个
①Be的最高价氧化物对应的水化物具有两性
②Tl(铊)与盐酸和NaOH溶液作用均能产生氢气
③At的单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④Li在氧气中剧烈燃烧的产物为Li2O2
⑤SrSO4(硫酸锶)是难溶于水的白色固体
⑥H2Se是无色、有毒、比H2S稳定的气体
①Be的最高价氧化物对应的水化物具有两性
②Tl(铊)与盐酸和NaOH溶液作用均能产生氢气
③At的单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④Li在氧气中剧烈燃烧的产物为Li2O2
⑤SrSO4(硫酸锶)是难溶于水的白色固体
⑥H2Se是无色、有毒、比H2S稳定的气体
| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
9-10高一下·江西·期中
8 . 运用元素周期律分析下面的推断,其中错误的是( )
| A.铍(Be)的氧化物的水化物可能具有两性 |
| B.砹(At)为有色固体;HAt不稳定;AgAt感光性很强,且不溶于水也不溶于稀酸 |
| C.硫酸锶(SrSO4)是难溶于水的白色固体 |
| D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
您最近一年使用:0次
名校
9 . 下列说法中错误的是
| A.根据对角线规则,铍和铝的性质具有相似性 |
| B.[Cu(H2O)4]2+中Cu提供空轨道,H2O中O提供孤对电子形成配位键 |
| C.元素电负性越大的原子,吸引电子的能力越强 |
| D.手性分子互为镜像,它们的性质没有区别 |
您最近一年使用:0次
2016-12-09更新
|
520次组卷
|
5卷引用:辽宁省实验中学分校2016-2017学年高二下学期期末考试化学试题
名校
10 . 锂和镁在元素周期表中有特殊“对角线”关系,它们的性质相似。下列有关锂及其化合物叙述正确的是( )
| A.Li2SO4难溶于水 |
| B.Li与N2反应的产物是Li3N |
| C.LiOH易溶于水 |
| D.LiOH与Li2CO3受热都很难分解 |
您最近一年使用:0次
2016-12-09更新
|
505次组卷
|
14卷引用:辽宁省抚顺市第一中学2019-2020高二下学期期中考试化学试题
辽宁省抚顺市第一中学2019-2020高二下学期期中考试化学试题(已下线)2013-2014四川省成都市五校高一下学期期中联考化学试卷2014-2015黑龙江省哈尔滨六中高二上期末化学试卷河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:1.2 原子结构与元素的性质 第2课时贵州省遵义育新高级中学2018-2019学年高二上学期11月月考化学试题贵州省普定县一中2018-2019学年高二上学期期中考试化学试题湖北省武汉市钢城四中2018-2019学年高二下学期期中考试化学试题甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(普通班)吉林省汪清四中2020-2021学年高二下学期第二阶段考试化学试题云南省通海县第一中学2021-2022学年高二下学期3月月考化学试题内蒙古赤峰市元宝山区第一中学2021-2022学年高二下学期期中考试化学试题安徽省滁州市九校2021-2022学年高二下学期3月月考化学试题(已下线)专题09 常见金属元素的性质及应用-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)BBWYhjhx1113.pdf



