解题方法
1 . 按要求回答下列问题:
(1)根据价层电子对互斥模型,H2S 、SO2 、SO3 的气态分子中,中心原子价层电子对数不同于其他分子的是___________ 。
(2)晶体中H2O 和 中心原子的杂化轨道类型分别为
中心原子的杂化轨道类型分别为___________ ,试判断 H2O 和  的键角大小关系并说明原因:
的键角大小关系并说明原因:___________ 。
(3)成语“信口雌黄 ”中的雌黄分子式为 As2S3,分子结构如图,As 原子的杂化方式为___________ , 雌黄和 SnCl2 在盐酸中反应转化为雄黄(As4S4)和 SnCl4 并放出 H2S 气体。___________ 。
(5)Zn2+的核外电子排布式为___________ ,在元素周期表中,该元素在___________ (填“s”“p”“d”“f”或“ds”)区。。
(6)S8与热的浓NaOH 溶液反应的产物之一为Na2S3,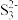 的空间结构为
的空间结构为___________ 。
(7)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,则[H2F]+ 的空间结构为___________ 。
(8)Na3AsO4 中含有的化学键类型包括___________ ; 的空间结构为
的空间结构为 ___________ 。
(1)根据价层电子对互斥模型,H2S 、SO2 、SO3 的气态分子中,中心原子价层电子对数不同于其他分子的是
(2)晶体中H2O 和
 中心原子的杂化轨道类型分别为
中心原子的杂化轨道类型分别为 的键角大小关系并说明原因:
的键角大小关系并说明原因:(3)成语“信口雌黄 ”中的雌黄分子式为 As2S3,分子结构如图,As 原子的杂化方式为

(5)Zn2+的核外电子排布式为
(6)S8与热的浓NaOH 溶液反应的产物之一为Na2S3,
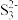 的空间结构为
的空间结构为(7)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,则[H2F]+ 的空间结构为
(8)Na3AsO4 中含有的化学键类型包括
 的空间结构为
的空间结构为
您最近一年使用:0次
名校
解题方法
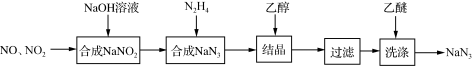
2 . 叠氮化钠(NaN3)是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚,广泛应用于汽车安全气囊。某硝酸工厂拟通过下列方法处理尾气并制备叠氮化钠。___________ 。
(2)已知NaN3阳离子与阴离子个数比为1:1,则NaN3中所含的化学键为___________ ,1mol该阴离子中所含的电子总数为___________ mol
(3)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3 K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
①该反应中的还原剂为___________ (填化学式)。
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克___________ ?(写出计算过程,保留一位小数,不考虑固体的体积)。
(2)已知NaN3阳离子与阴离子个数比为1:1,则NaN3中所含的化学键为
(3)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3
 K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。①该反应中的还原剂为
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克
您最近一年使用:0次
3 . 以粗盐和石英砂为原料制备纯碱和精硅的流程如下图所示,结合题意回答下列问题:
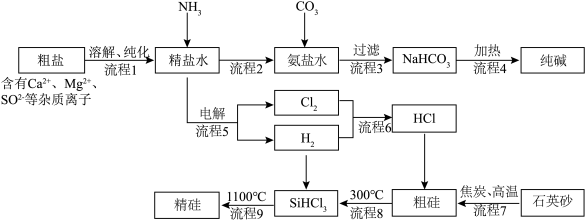
(1)流程1可在实验室完成,过程如下图所示,若只加一种试剂,则A化学式为________________ 。
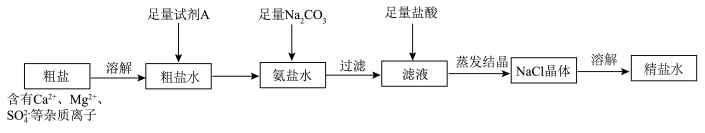
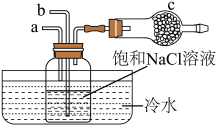
(2)流程2和流程3也可在实验室模拟完成,具体过程如图所示,则a口通入________________ 气体,c装置固体为________________ 。
(3)流程4生成的Na2CO3,其含有的化学键为________________ 。
(4)流程7的化学方程式________________ 。
(5)流程9整个制备过程必须严格控制无氧,若混入O2,可能引起的后果是________________ 。
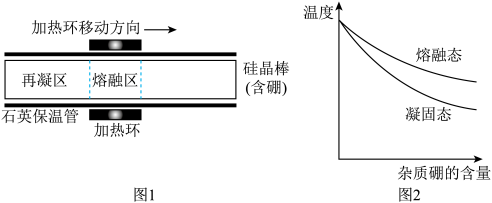
(6)制得的精硅含有微量硼,会影响芯片性能。某实验室利用区域熔炼技术制高纯硅的装置剖面图如图1,将含微量杂质硼的硅晶棒装入石英保温管中,利用加热环自左向右缓慢移动对其进行加热熔炼,已知杂质硼在不同状态的硅中含量分布如图2所示。
下列说法中错误的是________________。

(1)流程1可在实验室完成,过程如下图所示,若只加一种试剂,则A化学式为

(2)流程2和流程3也可在实验室模拟完成,具体过程如图所示,则a口通入

(3)流程4生成的Na2CO3,其含有的化学键为
(4)流程7的化学方程式
(5)流程9整个制备过程必须严格控制无氧,若混入O2,可能引起的后果是
(6)制得的精硅含有微量硼,会影响芯片性能。某实验室利用区域熔炼技术制高纯硅的装置剖面图如图1,将含微量杂质硼的硅晶棒装入石英保温管中,利用加热环自左向右缓慢移动对其进行加热熔炼,已知杂质硼在不同状态的硅中含量分布如图2所示。

下列说法中错误的是________________。
| A.混有杂质硼的硅晶棒熔点低于纯硅 |
| B.熔炼前,可以用普通玻璃管替换石英保温管 |
| C.熔炼时,加热环移动速度过快可能导致杂质硼分离不彻底 |
| D.熔炼后,硅晶棒纯度右端高于左端 |
您最近一年使用:0次
名校
4 . 1869年门捷列夫提出元素周期表,根据元素周期表和周期律,回答问题。
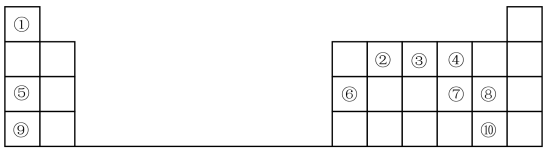
(1)元素⑦在周期表中的位置_______ 。
(2)元素①和⑤形成的化合物中化学键类型是_______ 。
(3)在①~⑧元素中,原子半径最大的是_______ (填元素名称);其某种氧化物可用于潜水艇中的供氧剂,该氧化物中阴离子与阳离子个数比为_______ 。
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是_______ (用离子符号表示),元素⑨的最高价氧化物对应水化物与元素⑥的最高价氧化物对应的水化物反应的离子方程式为_______ 。
(5)元素的非金属性⑩_______ ⑧(填“>”或“<”);下列事实不能证明上述结论的是_______ 。
A.元素⑧的单质与⑩的氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的氢化物的还原性比元素⑩的弱
C.元素⑧和⑩的氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强
E.元素⑧的氢化物的水溶液的酸性比元素⑩的弱
(6)⑤的最高价氧化物对应的水化物的电子式为_______ ,用电子式表示氯化钠的形成过程_______ 。

(1)元素⑦在周期表中的位置
(2)元素①和⑤形成的化合物中化学键类型是
(3)在①~⑧元素中,原子半径最大的是
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是
(5)元素的非金属性⑩
A.元素⑧的单质与⑩的氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的氢化物的还原性比元素⑩的弱
C.元素⑧和⑩的氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强
E.元素⑧的氢化物的水溶液的酸性比元素⑩的弱
(6)⑤的最高价氧化物对应的水化物的电子式为
您最近一年使用:0次
名校
5 . A、B、C、D、E、F、G为短周期元素,原子序数依次增大。A、B两元素最高正价和最低负价代数和为零;D是地壳中含量最高的非金属元素;E和A同主族,G与D同主族;E、F、G的最高价氧化物的水化物两两之间可以反应。
(1)G元素的名称是__________ ,其在周期表中的位置是_____________ ,其离子结构示意图为_____________ 。
(2)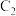 的电子式
的电子式_____________ ;由A、C原子个数比为5∶1组成的一种化合物,其中各原子均达到稳定结构,该化合物中所含化学键类型为_____________ 。
(3)B、C形成的最高价氧化物的水化物,酸性由强到弱的顺序为_____________ (用分子式表示,下同);D和G的简单氢化物沸点的由高到低的顺序为_____________ 。
(4)E和F分别对应的最高价氧化物的水化物相互反应的离子方程式________________ 。
(5)由C、E组成的一种离子化合物的化学式为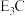 ,该化合物中两种离子的半径由大到小的顺序是(用离子符号表示)
,该化合物中两种离子的半径由大到小的顺序是(用离子符号表示)_________________________ ;该化合物遇水剧烈反应,有刺激性气味的气体生成,该反应的化学方程式为___________________________ 。
(1)G元素的名称是
(2)
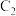 的电子式
的电子式(3)B、C形成的最高价氧化物的水化物,酸性由强到弱的顺序为
(4)E和F分别对应的最高价氧化物的水化物相互反应的离子方程式
(5)由C、E组成的一种离子化合物的化学式为
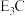 ,该化合物中两种离子的半径由大到小的顺序是(用离子符号表示)
,该化合物中两种离子的半径由大到小的顺序是(用离子符号表示)
您最近一年使用:0次
名校
解题方法
6 . 随着原子序数的递增,7种短周期元素A~G的最高正价或最低负价与原子序数的关系如图。
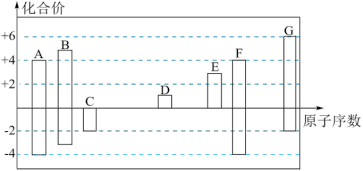
回答下列问题:
(1)写出中子数为8的A元素的一种核素的化学符号_______ 。
(2)在A、B、F、G四种元素中,非金属性最弱的元素在周期表中的位置为_______ 。
(3)E元素最高价氧化物对应水化物与氢氧化钠溶液反应的离子方程式为_______ 。
(4)元素A与G形成的电子总数为38的分子的结构式为_______ 。
(5)元素C与D按原子个数比1:1形成的化合物的电子式为_______ ,所含有化学键类型有_______ 。
(6)如图表示由C、G元素组成的两种气体分子在一定条件下的密闭容器中充分反应的转化关系,请写出该转化过程的化学方程式:_______ 。

回答下列问题:
(1)写出中子数为8的A元素的一种核素的化学符号
(2)在A、B、F、G四种元素中,非金属性最弱的元素在周期表中的位置为
(3)E元素最高价氧化物对应水化物与氢氧化钠溶液反应的离子方程式为
(4)元素A与G形成的电子总数为38的分子的结构式为
(5)元素C与D按原子个数比1:1形成的化合物的电子式为
(6)如图表示由C、G元素组成的两种气体分子在一定条件下的密闭容器中充分反应的转化关系,请写出该转化过程的化学方程式:

您最近一年使用:0次
解题方法
7 . 已知A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,已知A的某种原子核内没有中子,A和D,C和F分别为同一主族元素,B原子的最外层电子数比次外层多3,E的最高价氧化物对应的水化物既可以和强酸反应也可以和强碱溶液反应。
(1)C、E分别形成的简单离子中,半径较大的是___________ (填离子符号)
(2)F和G的最高价氧化物对应的水化物酸性较强的是___________ (填化学式)
(3)由A、D、F形成的化合物中化学键的类型为___________ ;
(4)由A、B形成18e-化合物的结构式为___________ ;
(5)用电子式表示C与D形成的原子个数比为1:2的化合物的形成过程___________ ;
(6)D、E的最高价氧化物对应的水化物相互反应的化学方程式为___________ ;
(7)由B、G形成的化合物分子中,B和G原子的最外层均达到8电子稳定结构,该化合物遇水可反应生成一种具有漂白性的化合物,写出反应的化学方程式:___________ 。
(1)C、E分别形成的简单离子中,半径较大的是
(2)F和G的最高价氧化物对应的水化物酸性较强的是
(3)由A、D、F形成的化合物中化学键的类型为
(4)由A、B形成18e-化合物的结构式为
(5)用电子式表示C与D形成的原子个数比为1:2的化合物的形成过程
(6)D、E的最高价氧化物对应的水化物相互反应的化学方程式为
(7)由B、G形成的化合物分子中,B和G原子的最外层均达到8电子稳定结构,该化合物遇水可反应生成一种具有漂白性的化合物,写出反应的化学方程式:
您最近一年使用:0次
名校
解题方法
8 . 已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族;A与B形成离子化合物,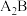 中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)元素C在元素周期表中的位置是第________ 周期第________ 族。
(2)B、D两元素的简单气态氢化物的稳定性:________ >________ (填化学式)。
(3)写出下列物质的电子式:
E与B形成的化合物:_________ ; A、B、E形成的化合物:_________ ;D与E形成的化合物:_________ ;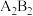 的电子式:
的电子式:_________ 。
(4)用电子式表示离子化合物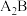 的形成过程:
的形成过程:__________ 。
(5)下面是同学们熟悉的物质:① ②金刚石 ③NaBr ④
②金刚石 ③NaBr ④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧Ne ⑨
⑧Ne ⑨ ⑩KOH。这些物质中,只含有共价键的是
⑩KOH。这些物质中,只含有共价键的是_________ (填序号,下同);只含有离子键的是________ ;既含有共价键又含有离子键的是________________ 。属于共价化合物的是________________ ;属于离子化合物的是________________ 。
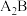 中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:(1)元素C在元素周期表中的位置是第
(2)B、D两元素的简单气态氢化物的稳定性:
(3)写出下列物质的电子式:
E与B形成的化合物:
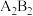 的电子式:
的电子式:(4)用电子式表示离子化合物
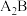 的形成过程:
的形成过程:(5)下面是同学们熟悉的物质:①
 ②金刚石 ③NaBr ④
②金刚石 ③NaBr ④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧Ne ⑨
⑧Ne ⑨ ⑩KOH。这些物质中,只含有共价键的是
⑩KOH。这些物质中,只含有共价键的是
您最近一年使用:0次
9 . 二氧化碳转化甲醇技术是当前的研究热点,假设该过程仅发生如下3个反应:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) K1△H1
CH3OH(g)+H2O(g) K1△H1
反应II:2CH3OH(g) CH3OCH3(g)+H2O(g) K2△H2
CH3OCH3(g)+H2O(g) K2△H2
反应III:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) K3△H3
CH3OCH3(g)+3H2O(g) K3△H3
(1)上述反应的平衡常数K与温度T的关系都符合:lnK=A+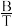 (A、B都为常数,且都大于零),则
(A、B都为常数,且都大于零),则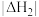
______ 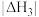 (填“>”、“<”或“=)。
(填“>”、“<”或“=)。
(2)在体积为1L的刚性容器中,仅发生反应I,投料比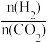 =3,反应一段时间后,在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图所示。
=3,反应一段时间后,在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图所示。

①下列说法能作为反应I达到平衡状态的判据是______ (填字母)。
A.气体密度不再变化 B.CO2的体积分数不再变化
C.气体平均相对分子质量不再变化 D.CO2、H2的物质的量之比为1:3
②有分子筛时,P点之前甲醇的产率随温度升高而升高的原因是______ 。
③210℃下,反应达到平衡时,该容器中未通过膜的H2O分子占反应生成的H2O分子的百分比为_____ (用a表示)。
(3)CH3OH(g)在γ-Al2O3固体表面发生反应Ⅱ要经历:吸附→表面反应→脱附三个阶段,其机理如图所示。

①发生脱附的是历程______ (填数字)。
②已知历程5的化学方程式为:HO*+H*→H2O*(用*标注吸附的原子)。写出历程3的化学方程式:_____ 。
(4)甲醇可作为燃料电池的燃料。
①某甲醇燃料电池的部分结构如图所示,该电池的负极反应式为_____ 。

②已知氢气和甲醇的热值分别为143kJ/g和23kJ/g,与车载氢气供能模式相比,车载甲醇供能模式的优势是______ 。(已知燃料的能量密度单位为: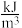 )
)
反应I:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) K1△H1
CH3OH(g)+H2O(g) K1△H1反应II:2CH3OH(g)
 CH3OCH3(g)+H2O(g) K2△H2
CH3OCH3(g)+H2O(g) K2△H2反应III:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) K3△H3
CH3OCH3(g)+3H2O(g) K3△H3(1)上述反应的平衡常数K与温度T的关系都符合:lnK=A+
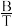 (A、B都为常数,且都大于零),则
(A、B都为常数,且都大于零),则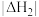
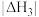 (填“>”、“<”或“=)。
(填“>”、“<”或“=)。(2)在体积为1L的刚性容器中,仅发生反应I,投料比
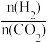 =3,反应一段时间后,在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图所示。
=3,反应一段时间后,在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图所示。
①下列说法能作为反应I达到平衡状态的判据是
A.气体密度不再变化 B.CO2的体积分数不再变化
C.气体平均相对分子质量不再变化 D.CO2、H2的物质的量之比为1:3
②有分子筛时,P点之前甲醇的产率随温度升高而升高的原因是
③210℃下,反应达到平衡时,该容器中未通过膜的H2O分子占反应生成的H2O分子的百分比为
(3)CH3OH(g)在γ-Al2O3固体表面发生反应Ⅱ要经历:吸附→表面反应→脱附三个阶段,其机理如图所示。

①发生脱附的是历程
②已知历程5的化学方程式为:HO*+H*→H2O*(用*标注吸附的原子)。写出历程3的化学方程式:
(4)甲醇可作为燃料电池的燃料。
①某甲醇燃料电池的部分结构如图所示,该电池的负极反应式为

②已知氢气和甲醇的热值分别为143kJ/g和23kJ/g,与车载氢气供能模式相比,车载甲醇供能模式的优势是
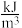 )
)
您最近一年使用:0次
名校
解题方法
10 . 碳元素能形成多种单质,其中石墨和富勒烯( )是两类常见的物质。
)是两类常见的物质。 以其完美的球烯受到科学家重视,其结构如下图所示。60个碳原子是等同的,均为近似
以其完美的球烯受到科学家重视,其结构如下图所示。60个碳原子是等同的,均为近似 杂化,但却有两种不同类型的碳碳键。其中一种为138pm:另一种为145pm。
杂化,但却有两种不同类型的碳碳键。其中一种为138pm:另一种为145pm。


(1)请在图中标明这2种类型的键的键长___________ 。
(2)石墨中原子和原子之间存在的作用力类型有___________ 。
a.σ键 b.π键 c.极性键 d.非极性键 e.离子键 f.范德华力
(3)石墨、 互为同素异形体,但相同条件下,石墨的熔点比
互为同素异形体,但相同条件下,石墨的熔点比 高得多,原因是
高得多,原因是_______ 。
(4) 的晶胞结构如图所示,每个白球代表1个
的晶胞结构如图所示,每个白球代表1个 分子。已知一定条件下晶胞的棱长为acm,阿伏加德罗常数为
分子。已知一定条件下晶胞的棱长为acm,阿伏加德罗常数为 ,则该条件下
,则该条件下 的摩尔体积为
的摩尔体积为________  (用含a、
(用含a、 的代数式表示)
的代数式表示)
(5) 常态下是为紫色固体,不导电,但给富勒烯掺杂金属后(用金属原子把富勒烯分子连起来或者把金属原子放进富勒烯笼子里),其在一定条件下甚至可以成为超导体。
常态下是为紫色固体,不导电,但给富勒烯掺杂金属后(用金属原子把富勒烯分子连起来或者把金属原子放进富勒烯笼子里),其在一定条件下甚至可以成为超导体。 晶体结构中存在四面体空隙(如图中1、3、6、7围成的空隙)和八面体空隙(如图中3、6、7、8、9、12围成的空隙)。所有空隙中均填充一个金属M原子,可获得某条件下的超导材料。则该超导材料中,平均一个
晶体结构中存在四面体空隙(如图中1、3、6、7围成的空隙)和八面体空隙(如图中3、6、7、8、9、12围成的空隙)。所有空隙中均填充一个金属M原子,可获得某条件下的超导材料。则该超导材料中,平均一个 晶胞需掺杂
晶胞需掺杂___________ 个M原子。
 )是两类常见的物质。
)是两类常见的物质。 以其完美的球烯受到科学家重视,其结构如下图所示。60个碳原子是等同的,均为近似
以其完美的球烯受到科学家重视,其结构如下图所示。60个碳原子是等同的,均为近似 杂化,但却有两种不同类型的碳碳键。其中一种为138pm:另一种为145pm。
杂化,但却有两种不同类型的碳碳键。其中一种为138pm:另一种为145pm。

(1)请在图中标明这2种类型的键的键长
(2)石墨中原子和原子之间存在的作用力类型有
a.σ键 b.π键 c.极性键 d.非极性键 e.离子键 f.范德华力
(3)石墨、
 互为同素异形体,但相同条件下,石墨的熔点比
互为同素异形体,但相同条件下,石墨的熔点比 高得多,原因是
高得多,原因是(4)
 的晶胞结构如图所示,每个白球代表1个
的晶胞结构如图所示,每个白球代表1个 分子。已知一定条件下晶胞的棱长为acm,阿伏加德罗常数为
分子。已知一定条件下晶胞的棱长为acm,阿伏加德罗常数为 ,则该条件下
,则该条件下 的摩尔体积为
的摩尔体积为 (用含a、
(用含a、 的代数式表示)
的代数式表示)(5)
 常态下是为紫色固体,不导电,但给富勒烯掺杂金属后(用金属原子把富勒烯分子连起来或者把金属原子放进富勒烯笼子里),其在一定条件下甚至可以成为超导体。
常态下是为紫色固体,不导电,但给富勒烯掺杂金属后(用金属原子把富勒烯分子连起来或者把金属原子放进富勒烯笼子里),其在一定条件下甚至可以成为超导体。 晶体结构中存在四面体空隙(如图中1、3、6、7围成的空隙)和八面体空隙(如图中3、6、7、8、9、12围成的空隙)。所有空隙中均填充一个金属M原子,可获得某条件下的超导材料。则该超导材料中,平均一个
晶体结构中存在四面体空隙(如图中1、3、6、7围成的空隙)和八面体空隙(如图中3、6、7、8、9、12围成的空隙)。所有空隙中均填充一个金属M原子,可获得某条件下的超导材料。则该超导材料中,平均一个 晶胞需掺杂
晶胞需掺杂
您最近一年使用:0次



