名校
1 . 根据已学物质结构与性质的有关知识,回答下列问题:
(1)请写出第三周期元素中p轨道上有3个未成对电子的元素符号:____________ ,某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是____________ 。
(2)根据价层电子对互斥理论推测下列离子或分子的空间立体构型:H3O+____________ ,BF3____________ 。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关化学反应方程式____________ 、_________ 。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为____________ ;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为_______ 。
(1)请写出第三周期元素中p轨道上有3个未成对电子的元素符号:
(2)根据价层电子对互斥理论推测下列离子或分子的空间立体构型:H3O+
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关化学反应方程式
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为

您最近一年使用:0次
2016-12-09更新
|
729次组卷
|
5卷引用:2017届江西师范大学附属中学高三3月月考理综化学试卷
10-11高二·江西上饶·阶段练习
名校
2 . 下列基态原子或离子的电子排布式错误的是( )
| A.K:1s22s22p63s23p64s1 | B.F-:1s22s22p6 |
| C.26Fe:1s22s22p63s23p63d54s3 | D.Kr:1s22s22p63s23p63d104s24p6 |
您最近一年使用:0次
2016-12-09更新
|
332次组卷
|
11卷引用:2011-2012学年江西省上饶县中学高二第一次月考化学试卷
(已下线)2011-2012学年江西省上饶县中学高二第一次月考化学试卷(已下线)2011-2012学年山东省泰安宁阳二中高二下学期期末考试化学试卷2015-2016学年山西省右玉一中高二5月月考化学试卷2015-2016学年山西省朔州市右玉一中高二下5月月考化学试卷陕西省黄陵中学2018届高三(重点班)上学期期中考试化学试题陕西省西安中学2017-2018学年高二(平行班)下学期期末考试化学试题【全国百强校】河北省冀州市中学2018-2019学年高二上学期第五次月考化学试题河南省林州市第一中学2019-2020学年高二3月线上调研考试(实验班)化学试题福建省莆田第二十五中学2019-2020学年高二下学期返校考试化学试题甘肃省庆阳市镇原中学2019-2020学年高二下学期期末考试化学试题吉林省松原市乾安县第七中学2020-2021学年高二下学期第五次质量检测化学试题
解题方法
3 . 分铁及其化合物在生产生活及科学研究方面应用非常广泛.
(1)Fe2+基态核外电子排布式为_______________ ;
(2)Fe3+可与_______________ (阴离子)发生特征的显色反应,用于鉴定Fe3+,该阴离子的电子式为_______________ ,其空间构型为_______________ ;
(3)已知Fe2+和Fe3+均可与CN-形成配离子[Fe(CN)6]4-和[Fe(CN)6]3-,在酸性溶液中H2O2可使Fe(CN)64-转化为Fe(CN)63-.写出以上转化的离子方程式_______________ ;
(4)CN-的其中一个等电子体可与Fe(0)形成配合物,该配合物的化学式为_______________ ,1mol该配合物所含有σ键和π键数目之比为_______________ ;
(5)向Fe2+溶液中加入K3[Fe(CN)6],可生成蓝色难溶化合物滕氏蓝,若向Fe3+溶液中加入K4[Fe(CN)6],则可生成蓝色难溶化合物普鲁士蓝,经结构分析,滕氏蓝和普鲁士蓝为同一化合物,其晶胞结构( )如图所示(K+未标出)。
)如图所示(K+未标出)。

根据上述信息,滕氏蓝和普鲁士蓝晶胞含有_______________ 个Fe2+,其化学式为_______________ ,含有的化学键有_______________ (填字母序号).
a.共价键 b.离子键 c.配位键 d.金属键 e.氢键
(1)Fe2+基态核外电子排布式为
(2)Fe3+可与
(3)已知Fe2+和Fe3+均可与CN-形成配离子[Fe(CN)6]4-和[Fe(CN)6]3-,在酸性溶液中H2O2可使Fe(CN)64-转化为Fe(CN)63-.写出以上转化的离子方程式
(4)CN-的其中一个等电子体可与Fe(0)形成配合物,该配合物的化学式为
(5)向Fe2+溶液中加入K3[Fe(CN)6],可生成蓝色难溶化合物滕氏蓝,若向Fe3+溶液中加入K4[Fe(CN)6],则可生成蓝色难溶化合物普鲁士蓝,经结构分析,滕氏蓝和普鲁士蓝为同一化合物,其晶胞结构(
 )如图所示(K+未标出)。
)如图所示(K+未标出)。
根据上述信息,滕氏蓝和普鲁士蓝晶胞含有
a.共价键 b.离子键 c.配位键 d.金属键 e.氢键
您最近一年使用:0次
4 . 砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________ 。
(2)根据元素周期律,原子半径Ga_____________ As,第一电离能Ga____________ As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________ ,其中As的杂化轨道类型为_________ 。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是__________ 。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________ ,Ga与As以________ 键键合。Ga和As的摩尔质量分别为MGag·mol-1和MAs g·mol-1,原子半径分别为rGapm和rAspm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________ 。

(1)写出基态As原子的核外电子排布式
(2)根据元素周期律,原子半径Ga
(3)AsCl3分子的立体构型为
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为

您最近一年使用:0次
2016-12-09更新
|
3890次组卷
|
21卷引用:【全国百强校】江西省南昌市第十中学2019届高三上学期期末考试理科综合化学试题
【全国百强校】江西省南昌市第十中学2019届高三上学期期末考试理科综合化学试题2016年全国普通高等学校招生统一考试化学(新课标3卷精编版)2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷2015-2016学年黑龙江哈尔滨六中高二下期末化学试卷四川省眉山中学2016-2017学年高二下学期期中考试理综化学试题新疆生产建设兵团第二中学2016-2017学年高二下学期第二次月考化学试题四川省绵阳中学实验学校2017届高三5月模拟理综化学试题河南省南阳市第一中学2018届高三实验班第一次考试化学试题贵州省遵义航天高级中学2018届高三第二次模拟(10月)理科综合化学试题吉林省实验中学2018高三一模理综化学试题【全国百强校】内蒙古集宁一中(东校区)2017-2018学年高二下学期期中考试化学试题【全国校级联考】四川省眉山一中办学共同体2019届高三9月月考化学试题吉林省实验中学2018届高三上学期第五次月考(一模)理科综合化学试题【全国百强校】四川省棠湖中学2019届高三上学期第三次月考理综-化学试题2016年全国普通高等学校招生统一考试化学(全国3卷参考版)2020届高中化学第一轮复习第十二章《物质结构与性质》测试卷湖北省武汉市华中师范大学第一附属中学2020届高三2月份网络教学质量监测理综化学试题广西壮族自治区田阳高中2019-2020学年高二下学期6月月考理科综合化学试题福建省永安市第三中学2021届高三9月月考化学试题广西河池市高级中学2021-2022学年高三上学期第三次月考化学试题湖南省郴州市永兴县第一中学2021-2022学年高三下学期期中考试化学试题
解题方法
5 . Ⅰ.德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。

①C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数-棱边数=2,
请回答:C20分子共有________ 个正五边形,共有________ 条棱边。
Ⅱ.A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D元素的核电荷数为29。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为______ 。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为_____ ,1mol该分子中含有π键的数目为________ 。该分子中碳原子的杂化轨道类型是_____ ,该分子属于_________ 分子(填“极性”或“非极性”)。
(3)基态D原子的电子排布式为__________ 。

①C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数-棱边数=2,
请回答:C20分子共有
Ⅱ.A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D元素的核电荷数为29。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为
(3)基态D原子的电子排布式为
您最近一年使用:0次
解题方法
6 . 下列说法正确的是
| A.含有离子键和共价键的化合物一定是离子化合物 |
| B.元素原子的最外层电子数等于该元素的最高正化合价 |
| C.目前人们已发现的元素种类数目与原子种类数目相同 |
| D.多电子原子中,在离核较近的区域内运动的电子能量较高 |
您最近一年使用:0次
2016-12-09更新
|
147次组卷
|
2卷引用:2014-2015江西省南昌市第十九中学高一下学期期中考试化学试卷
解题方法
7 . X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下:X元素原子的价电子构型为nsnnp2n,Y和Z位于同一周期,最外层都有两个未成对电子,L元素原子的基态未成对电子数是同周期最多的元素。
请回答如下问题:
(1)L元素在周期表中的位置是_______________ ,该原子核外电子排布式是_______________ ,其最高正价氧化物对应的水氧化物的化学式是_______________ ;
(2)元素X与Y形成的化合物晶体类型是晶体_________ ,1mol该化合物含有的化学键数为___________ (用阿伏加德罗常数NA表示);
(3)元素M是周期表中电负性最强的元素,X与M形成的化合物XM2的分子几何构型是________ ,该化合物中X的原子的杂化轨道类型是____________ ;
(4)X与碳、氢、三种元素形成的相对分子质量最小的分子里有个____ δ键,____ 个π键;
(5)金属元素N与Z形成的离子化合物的晶胞结构如图,晶胞中Z离子数目为______ 。
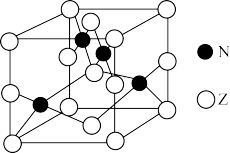
请回答如下问题:
(1)L元素在周期表中的位置是
(2)元素X与Y形成的化合物晶体类型是晶体
(3)元素M是周期表中电负性最强的元素,X与M形成的化合物XM2的分子几何构型是
(4)X与碳、氢、三种元素形成的相对分子质量最小的分子里有个
(5)金属元素N与Z形成的离子化合物的晶胞结构如图,晶胞中Z离子数目为

您最近一年使用:0次
2016-12-09更新
|
481次组卷
|
3卷引用:2015届江西省重点中学盟校高三第一次十校联考理综化学试卷
名校
8 . 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是________ ,B、C、D的电负性由小到大的顺序为______ (用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是____________________ 。
(2)E原子的基态电子排布式为________ 。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为____________ 。

(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:________ 。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________ 。
(5)温室效应,科学家设计反应:CO2+4H2—→CH4+2H2O以减小空气中CO2。若有1 mol CH4生成,则有________ mol σ键和________ mol π键断裂。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是
(2)E原子的基态电子排布式为

(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是
(5)温室效应,科学家设计反应:CO2+4H2—→CH4+2H2O以减小空气中CO2。若有1 mol CH4生成,则有
您最近一年使用:0次
9 . W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质是大气污染物监测物之一;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态的电子排布式可表示为______________________________________ 。
(2)MX3-的空间构型__________________________ (用文字描述)。
(3)M可形成多种氢化物,其中MH3的碱性强于M2H4的原因是_____________________________________________________ 。
(4)根据等电子原理,WX分子的结构式为_______________________ 。
(5)1 mol WX2中含有的σ键数目为_______________________ 。
(6)H2X分子中X原子轨道的杂化类型为_______________________ 。
(7)向Z2+的溶液中加入过量NaOH溶液,可生成Z的配位数为4的配位离子,写出该配位离子的结构式_______________________ 。
(1)Y3+基态的电子排布式可表示为
(2)MX3-的空间构型
(3)M可形成多种氢化物,其中MH3的碱性强于M2H4的原因是
(4)根据等电子原理,WX分子的结构式为
(5)1 mol WX2中含有的σ键数目为
(6)H2X分子中X原子轨道的杂化类型为
(7)向Z2+的溶液中加入过量NaOH溶液,可生成Z的配位数为4的配位离子,写出该配位离子的结构式
您最近一年使用:0次
2016-12-09更新
|
1220次组卷
|
4卷引用:2015届江西省新余市高三上学期期末考试理综化学试卷
2015届江西省新余市高三上学期期末考试理综化学试卷(已下线)2014届河北省唐山市高三4月第二次模拟理综化学试卷新疆乌鲁木齐市第四中学2018-2019学年高二下学期期末考试化学试题河南省驻马店市正阳县高级中学2019-2020高二下学期第一次素质检测化学试题
名校
解题方法
10 . 长式周期表共有18 个纵行,从左到右排为1﹣18 列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是( )
| A.第9列中元素中没有非金属元素 |
| B.只有第二列的元素原子最外层电子排布为ns2 |
| C.第四周期第10列元素是铁元素 |
| D.第15列元素原子的最外层电子排布为ns2np5 |
您最近一年使用:0次
2016-12-09更新
|
368次组卷
|
8卷引用:江西省玉山县第一中学2017届高三化学板块复习测试:物质结构与性质
江西省玉山县第一中学2017届高三化学板块复习测试:物质结构与性质(已下线)2011-2012学年福建师大附中高二下学期期中考试化学试卷(已下线)2011-2012学年福建省龙岩一中高二期末考试化学试卷(已下线)2014届上海市上海理工大学附属中学高三上学期第三次月考化学试卷河北省邢台市第一中学2017-2018学年高二下学期第一次月考化学试题【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期中考试(理)化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二下学期期中考试化学试题课时2 核外电子排布与元素周期表、原子半径——A学习区 夯实基础(鲁科版选修3)



