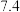名校
1 . 磷酸铁锂( )被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下:
)被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下:

已知: 是种难溶于水的物质。
是种难溶于水的物质。
(1)基态 原子的单电子数目为
原子的单电子数目为___________ 。
(2)钛铁矿用浓硫酸处理之前,需要粉碎,其目的是___________ 。
(3) 水解生成
水解生成 的离子方程式为
的离子方程式为___________ 。
(4)加入 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(5)为测定钛铁矿中铁的含量,某同学取经浓硫酸等处理的溶液(此时钛铁矿中的铁已全部转化为二价铁离子),采取 标准液滴定
标准液滴定 的方法:(不考虑
的方法:(不考虑 与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果
与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果___________ (填“偏高”、“偏低”或“无影响”),滴定终点的现象是___________ 。滴定分析时,称取ag钛铁矿,处理后,用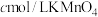 标准液滴定,消耗VmL,则铁元素的质量分数的表达式为
标准液滴定,消耗VmL,则铁元素的质量分数的表达式为___________ 。
 )被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下:
)被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下:
已知:
 是种难溶于水的物质。
是种难溶于水的物质。(1)基态
 原子的单电子数目为
原子的单电子数目为(2)钛铁矿用浓硫酸处理之前,需要粉碎,其目的是
(3)
 水解生成
水解生成 的离子方程式为
的离子方程式为(4)加入
 发生反应的离子方程式为
发生反应的离子方程式为(5)为测定钛铁矿中铁的含量,某同学取经浓硫酸等处理的溶液(此时钛铁矿中的铁已全部转化为二价铁离子),采取
 标准液滴定
标准液滴定 的方法:(不考虑
的方法:(不考虑 与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果
与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果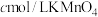 标准液滴定,消耗VmL,则铁元素的质量分数的表达式为
标准液滴定,消耗VmL,则铁元素的质量分数的表达式为
您最近一年使用:0次
2 . 我国科学家用粗氢氧化高钴 制备硫酸钴晶体(
制备硫酸钴晶体(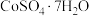 ),其工艺流程如下:
),其工艺流程如下:

已知:ⅰ.还原浸出液中的阳离子有: 、
、 、
、 和
和 等
等
ⅱ.部分物质的溶度积常数(25℃)
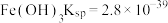
ⅲ.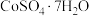 溶解度随温度升高而明显增大
溶解度随温度升高而明显增大
(1)Co元素位于元素周期表的_______ 区,基态Co原子的核外电子排布式为_______ 。
(2)浸出 时,理论上还原性离子和氧化性离子物质的量比为
时,理论上还原性离子和氧化性离子物质的量比为_______ 。
(3)写出“氧化沉铁”的离子方程式_______ ,25℃时,浊液中铁离子浓度为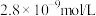 ,此时溶液
,此时溶液
_______ 。
(4)结合平衡移动原理解释“氟化沉钙”步骤加入过量NaF的原因_______ 。
(5)用滴定法测定硫酸钴晶体中的钴含量,其原理和操作如下。
在溶液中,用铁氯化钾将Co(Ⅱ)氧化为Co(Ⅲ),过量的铁氰化钾以Co(Ⅱ)标准液返滴定。反应的方程式为: 。
。
已知:铁氰化钾标准液浓度为 ,Co(Ⅱ)标准液质量浓度为
,Co(Ⅱ)标准液质量浓度为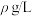 。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗
。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗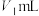 铁氰化钾标准液、
铁氰化钾标准液、 Co(Ⅱ)标准液。
Co(Ⅱ)标准液。
计算样品中钴含量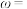
_______ (以钴的质量分数 计)。
计)。
(6)Fe与S形成的一种化合物晶体的晶胞结构及其纵向投影如图所示,该物质的化学式为_______ 。已知:晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞六棱柱底面边长为
,晶胞六棱柱底面边长为 ,则该晶胞的高
,则该晶胞的高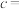
_______  (列出计算式)。
(列出计算式)。

 制备硫酸钴晶体(
制备硫酸钴晶体(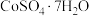 ),其工艺流程如下:
),其工艺流程如下:
已知:ⅰ.还原浸出液中的阳离子有:
 、
、 、
、 和
和 等
等ⅱ.部分物质的溶度积常数(25℃)

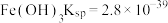
ⅲ.
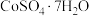 溶解度随温度升高而明显增大
溶解度随温度升高而明显增大(1)Co元素位于元素周期表的
(2)浸出
 时,理论上还原性离子和氧化性离子物质的量比为
时,理论上还原性离子和氧化性离子物质的量比为(3)写出“氧化沉铁”的离子方程式
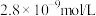 ,此时溶液
,此时溶液
(4)结合平衡移动原理解释“氟化沉钙”步骤加入过量NaF的原因
(5)用滴定法测定硫酸钴晶体中的钴含量,其原理和操作如下。
在溶液中,用铁氯化钾将Co(Ⅱ)氧化为Co(Ⅲ),过量的铁氰化钾以Co(Ⅱ)标准液返滴定。反应的方程式为:
 。
。已知:铁氰化钾标准液浓度为
 ,Co(Ⅱ)标准液质量浓度为
,Co(Ⅱ)标准液质量浓度为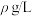 。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗
。取1.000g硫酸钴晶体,加水配成200mL溶液,取10mL待测液进行滴定,消耗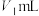 铁氰化钾标准液、
铁氰化钾标准液、 Co(Ⅱ)标准液。
Co(Ⅱ)标准液。计算样品中钴含量
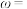
 计)。
计)。(6)Fe与S形成的一种化合物晶体的晶胞结构及其纵向投影如图所示,该物质的化学式为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞六棱柱底面边长为
,晶胞六棱柱底面边长为 ,则该晶胞的高
,则该晶胞的高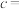
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
解题方法
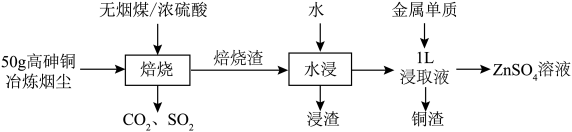
3 . 某研究小组模拟用硫酸化焙烧—水浸工艺从高砷铜冶炼烟尘中浸出铜、锌的流程如下。 及氧化物,焙烧时,金属砷酸盐转化为硫酸盐与
及氧化物,焙烧时,金属砷酸盐转化为硫酸盐与 。各元素质量分数如下:
。各元素质量分数如下:
②25℃时,硫酸铅的溶度积常数 ;
;
③浸出率的计算:浸出率 。
。
回答下列问题:
(1)基态Zn原子的价层电子排布式为___________ 。
(2)“焙烧”时,无烟煤除了为焙烧提供热量外,还表现___________ 的作用。请补全 参与反应的化学方程式:
参与反应的化学方程式:
___________ 。
(3)“水浸”时,所得浸渣的主要成分为___________ (写化学式),往浸取液中加入的金属单质是___________ (写化学式)。
(4)高砷铜冶炼烟尘经过焙烧、水浸等工序后,测得浸取液中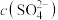 为
为 ,请从理论上分析铅是否沉淀完全?
,请从理论上分析铅是否沉淀完全?___________ (列式计算并得出结论)。
(5)铜浸出率的测定:从上述流程中得到的1L浸取液中取50mL与过量的酸性KI完全反应后,过滤,往滤液中滴加淀粉溶液为指示剂,用 标准溶液滴定,滴定终点时消耗
标准溶液滴定,滴定终点时消耗 标准溶液21.00mL。
标准溶液21.00mL。
(已知: ,
, )
)
①滴定终点的现象为___________ 。
②忽略流程中的损失,可得铜的浸出率为___________ 。
 及氧化物,焙烧时,金属砷酸盐转化为硫酸盐与
及氧化物,焙烧时,金属砷酸盐转化为硫酸盐与 。各元素质量分数如下:
。各元素质量分数如下:| Cu | Zn | As | Pb | In | Ag |
| 5.60% | 15.60% | 28.68% | 22.34% | 0.073% | 0.01% |
 ;
;③浸出率的计算:浸出率
 。
。回答下列问题:
(1)基态Zn原子的价层电子排布式为
(2)“焙烧”时,无烟煤除了为焙烧提供热量外,还表现
 参与反应的化学方程式:
参与反应的化学方程式:
(3)“水浸”时,所得浸渣的主要成分为
(4)高砷铜冶炼烟尘经过焙烧、水浸等工序后,测得浸取液中
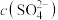 为
为 ,请从理论上分析铅是否沉淀完全?
,请从理论上分析铅是否沉淀完全?(5)铜浸出率的测定:从上述流程中得到的1L浸取液中取50mL与过量的酸性KI完全反应后,过滤,往滤液中滴加淀粉溶液为指示剂,用
 标准溶液滴定,滴定终点时消耗
标准溶液滴定,滴定终点时消耗 标准溶液21.00mL。
标准溶液21.00mL。(已知:
 ,
, )
)①滴定终点的现象为
②忽略流程中的损失,可得铜的浸出率为
您最近一年使用:0次
4 . 一种从火法炼铜烟道灰(主要成分是 的硫酸盐,还有少量
的硫酸盐,还有少量 和
和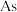 的氧化物)中回收铅,并制取三盐基硫酸铅(
的氧化物)中回收铅,并制取三盐基硫酸铅(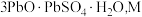 为
为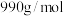 )的工艺如图:
)的工艺如图:
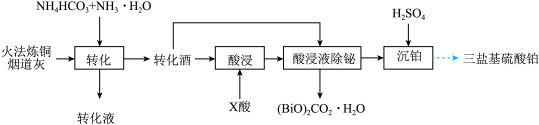
已知: 微溶于水
微溶于水
(1)写出铅原子的核外电子排布式:
_______ ,它位于元素周期表的_______ 区。
(2)转化过程温度选择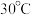 ,原因是
,原因是_______ 。
(3)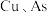 元素均进入转化液中,相关的离子分别为
元素均进入转化液中,相关的离子分别为_______ 、_______ (填离子符号)。
(4)转化渣主要成分为碳酸铅和碳酸氧铋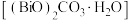 ,写出
,写出 转化为
转化为 的离子反应方程式:
的离子反应方程式:_______ 。
(5)加入适量的 酸,
酸, 酸宜为_______(填序号)。
酸宜为_______(填序号)。
(6)转化渣除铋的离子方程式为_______ 。
(7)若使用 烟道灰,最终制得纯度为
烟道灰,最终制得纯度为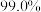 的三盐基硫酸铅
的三盐基硫酸铅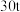 ,已知该工艺铅的回收率约为
,已知该工艺铅的回收率约为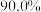 ,则烟道灰中含铅的质量分数为
,则烟道灰中含铅的质量分数为_______ 。
 的硫酸盐,还有少量
的硫酸盐,还有少量 和
和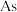 的氧化物)中回收铅,并制取三盐基硫酸铅(
的氧化物)中回收铅,并制取三盐基硫酸铅(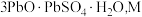 为
为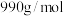 )的工艺如图:
)的工艺如图:
已知:
 微溶于水
微溶于水(1)写出铅原子的核外电子排布式:

(2)转化过程温度选择
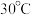 ,原因是
,原因是(3)
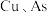 元素均进入转化液中,相关的离子分别为
元素均进入转化液中,相关的离子分别为(4)转化渣主要成分为碳酸铅和碳酸氧铋
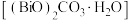 ,写出
,写出 转化为
转化为 的离子反应方程式:
的离子反应方程式:(5)加入适量的
 酸,
酸, 酸宜为_______(填序号)。
酸宜为_______(填序号)。| A.盐酸 | B.硫酸 | C.硝酸 | D.氢硫酸 |
(6)转化渣除铋的离子方程式为
(7)若使用
 烟道灰,最终制得纯度为
烟道灰,最终制得纯度为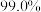 的三盐基硫酸铅
的三盐基硫酸铅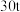 ,已知该工艺铅的回收率约为
,已知该工艺铅的回收率约为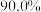 ,则烟道灰中含铅的质量分数为
,则烟道灰中含铅的质量分数为
您最近一年使用:0次
5 . 钛合金是航天航空工业的重要材料,某小组以钛铁矿粉(主要成分为FeTiO3,还含有少量的MgO)和金红石矿粉(TiO2)为原料制备Ti等产品的一种工艺流程示意图如下:
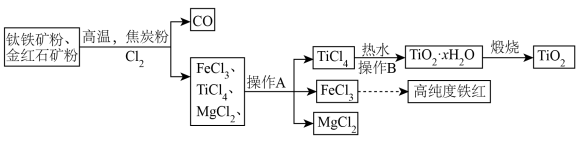
已知: 、
、 、
、 的沸点依次为1412℃、316℃、136℃。请回答下列问题:
的沸点依次为1412℃、316℃、136℃。请回答下列问题:
(1)钛的价层电子排布式为___________ 。
(2)操作A利用的原理为___________ 。
(3)操作B中包括对沉淀进行洗涤,请简述实验室洗涤沉淀的方法:___________ 。
(4)铁红的主要成分是___________ 。(填化学式)。
(5) 在实验室也可利用如下图装置制备
在实验室也可利用如下图装置制备 粗产品。
粗产品。
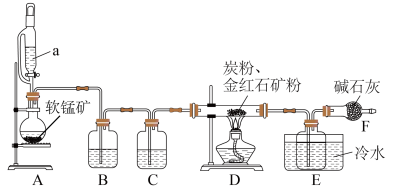
①若用高锰酸钾和浓盐酸制备氯气,写出A中发生反应的离子反应方程式:___________ 。
②仪器a的名称是___________ ,C装置中的试剂是___________ 。
③从环境保护角度考虑,本实验存在不足,请提出改进措施:___________ 。
(6)测定样品中TiO2纯度。取2.000g样品,在酸性条件下充分溶解,加入适量铝粉将TiO2+还原为Ti3+。过滤并洗涤,将所得滤液和洗涤液合并配制成250mL溶液。取25.00mL所配溶液于锥形瓶中,滴加几滴 溶液,用
溶液,用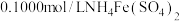 标准溶液滴定,将Ti3+转化成TiO2+,重复操作3次,平均消耗
标准溶液滴定,将Ti3+转化成TiO2+,重复操作3次,平均消耗 标准溶液。
标准溶液。
①计算该样品中TiO2的质量分数:___________ 。
②若其他操作都正确,盛装NH4Fe(SO4)2标准溶液的滴定管没有润洗,则测得结果将___________ (填“偏高”、“偏低”或“无影响”)。

已知:
 、
、 、
、 的沸点依次为1412℃、316℃、136℃。请回答下列问题:
的沸点依次为1412℃、316℃、136℃。请回答下列问题:(1)钛的价层电子排布式为
(2)操作A利用的原理为
(3)操作B中包括对沉淀进行洗涤,请简述实验室洗涤沉淀的方法:
(4)铁红的主要成分是
(5)
 在实验室也可利用如下图装置制备
在实验室也可利用如下图装置制备 粗产品。
粗产品。
①若用高锰酸钾和浓盐酸制备氯气,写出A中发生反应的离子反应方程式:
②仪器a的名称是
③从环境保护角度考虑,本实验存在不足,请提出改进措施:
(6)测定样品中TiO2纯度。取2.000g样品,在酸性条件下充分溶解,加入适量铝粉将TiO2+还原为Ti3+。过滤并洗涤,将所得滤液和洗涤液合并配制成250mL溶液。取25.00mL所配溶液于锥形瓶中,滴加几滴
 溶液,用
溶液,用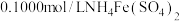 标准溶液滴定,将Ti3+转化成TiO2+,重复操作3次,平均消耗
标准溶液滴定,将Ti3+转化成TiO2+,重复操作3次,平均消耗 标准溶液。
标准溶液。①计算该样品中TiO2的质量分数:
②若其他操作都正确,盛装NH4Fe(SO4)2标准溶液的滴定管没有润洗,则测得结果将
您最近一年使用:0次
名校
6 . 三氯化铬( )在工业上主要用作媒染剂和催化剂,实验室模拟工业上以
)在工业上主要用作媒染剂和催化剂,实验室模拟工业上以 为原料制备
为原料制备 。
。
(1)制备 。取一定质量的
。取一定质量的 和对应量的水加入到三颈烧瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成
和对应量的水加入到三颈烧瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成 并放出
并放出 气体。
气体。
①Cr原子的外围电子排布式为___________ 。
②上述反应的化学方程式为___________ 。
③上述反应中的乙醇与投料的 物质的量比例大约为
物质的量比例大约为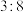 ,原因是
,原因是___________ 。
(2)测定 的质量分数。
的质量分数。
I.称取样品0.3300g,加水溶解并配成250.0mL的溶液。
II.移取25.00mL样品溶液于带塞的锥形瓶中,加热至沸后加入稍过量的 ,稀释并加热煮沸,再加入过量的硫酸酸化,将
,稀释并加热煮沸,再加入过量的硫酸酸化,将 氧化为
氧化为 ;再加入过量KI固体加塞摇匀,使铬元素完全以
;再加入过量KI固体加塞摇匀,使铬元素完全以 的形式存在。
的形式存在。
III.加入1mL淀粉溶液,用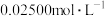 标准
标准 溶液滴定至终点,平行测定3次,平均消耗标准
溶液滴定至终点,平行测定3次,平均消耗标准 溶液24.00mL。
溶液24.00mL。
已知反应:
 (未配平)
(未配平)
 (未配平)
(未配平)
①滴定终点的现象是___________ 。
②计算 的质量分数(写出计算过程)
的质量分数(写出计算过程)___________ 。
 )在工业上主要用作媒染剂和催化剂,实验室模拟工业上以
)在工业上主要用作媒染剂和催化剂,实验室模拟工业上以 为原料制备
为原料制备 。
。(1)制备
 。取一定质量的
。取一定质量的 和对应量的水加入到三颈烧瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成
和对应量的水加入到三颈烧瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成 并放出
并放出 气体。
气体。①Cr原子的外围电子排布式为
②上述反应的化学方程式为
③上述反应中的乙醇与投料的
 物质的量比例大约为
物质的量比例大约为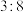 ,原因是
,原因是(2)测定
 的质量分数。
的质量分数。I.称取样品0.3300g,加水溶解并配成250.0mL的溶液。
II.移取25.00mL样品溶液于带塞的锥形瓶中,加热至沸后加入稍过量的
 ,稀释并加热煮沸,再加入过量的硫酸酸化,将
,稀释并加热煮沸,再加入过量的硫酸酸化,将 氧化为
氧化为 ;再加入过量KI固体加塞摇匀,使铬元素完全以
;再加入过量KI固体加塞摇匀,使铬元素完全以 的形式存在。
的形式存在。III.加入1mL淀粉溶液,用
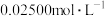 标准
标准 溶液滴定至终点,平行测定3次,平均消耗标准
溶液滴定至终点,平行测定3次,平均消耗标准 溶液24.00mL。
溶液24.00mL。已知反应:
 (未配平)
(未配平) (未配平)
(未配平)①滴定终点的现象是
②计算
 的质量分数(写出计算过程)
的质量分数(写出计算过程)
您最近一年使用:0次
2023-07-19更新
|
101次组卷
|
2卷引用:江西省乐安县第二中学2023-2024学年高三上学期开学考试化学试题
2023·湖南长沙·模拟预测
名校
解题方法
7 . 钴是生产电池材料、高温合金、磁性材料及催化剂的重要原料。一种以湿法炼锌净化渣(主要含有Co、Zn、Fe、Cu、Pb、ZnO、 等)为原料提取钴的工艺流程如图所示:
等)为原料提取钴的工艺流程如图所示:

已知:常温下,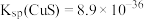 ,
,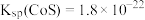 。
。
回答下列问题:
(1)基态Co原子的价层电子轨道表示式为_______ 。
(2)“浸出渣”中一定含有的物质为_______ (填化学式)。在“浸出”过程中,使用稀硫酸,未加热和搅拌,也没有进一步研碎净化渣,但反应速率较快,原因是_______ 。
(3) 常用作沉淀剂,在“铜渣”中检测不到
常用作沉淀剂,在“铜渣”中检测不到 ,“除铜液”中
,“除铜液”中 浓度为
浓度为 ,则此时溶液的
,则此时溶液的
_______ [已知:常温下,饱和 水溶液中存在关系式:
水溶液中存在关系式: ]。
]。
(4)“氧化”过程中, 与
与 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(5)“沉铁”过程中, 的作用是
的作用是_______ 。
(6)以1吨湿法炼锌净化渣(Co的质量分数为 )为原料提取出
)为原料提取出 。在提取过程中钴的损失率为
。在提取过程中钴的损失率为_______ (填含w、m的表达式)%。
 等)为原料提取钴的工艺流程如图所示:
等)为原料提取钴的工艺流程如图所示:
已知:常温下,
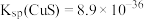 ,
,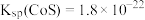 。
。回答下列问题:
(1)基态Co原子的价层电子轨道表示式为
(2)“浸出渣”中一定含有的物质为
(3)
 常用作沉淀剂,在“铜渣”中检测不到
常用作沉淀剂,在“铜渣”中检测不到 ,“除铜液”中
,“除铜液”中 浓度为
浓度为 ,则此时溶液的
,则此时溶液的
 水溶液中存在关系式:
水溶液中存在关系式: ]。
]。(4)“氧化”过程中,
 与
与 发生反应的离子方程式为
发生反应的离子方程式为(5)“沉铁”过程中,
 的作用是
的作用是(6)以1吨湿法炼锌净化渣(Co的质量分数为
 )为原料提取出
)为原料提取出 。在提取过程中钴的损失率为
。在提取过程中钴的损失率为
您最近一年使用:0次
名校
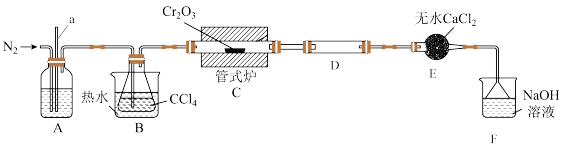
8 . 三氯化铬( )是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的装置如图所示:
的装置如图所示:
已知:碱性条件下, 可将
可将 氧化
氧化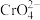 (黄色);酸性条件下,
(黄色);酸性条件下, 可将
可将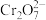 (橙色)还原为
(橙色)还原为 (绿色)。
(绿色)。
回答下列问题:
(1)基态Cr原子的核外电子排布式为_______ 。
(2)装置B中热水的作用是_______ ;实验进行一段时间后,发现导管a中的液面在不断上升,出现该现象的可能原因是_______ ,改进的措施是_______ 。
(3)对于装置C中发生的反应,甲、乙分别提出了两种不同的观点,甲认为发生的反应是 ;乙认为发生的反应是
;乙认为发生的反应是 。
。
Ⅰ.查阅资料知: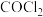 (俗称光气)有毒,遇潮湿的空气马上生成两种酸性气体,该反应的化学方程式为
(俗称光气)有毒,遇潮湿的空气马上生成两种酸性气体,该反应的化学方程式为_______ 。
Ⅱ.设计实验验证装置C中发生的反应;反应结束后,静置,待装置F中溶液分层后,取适量上层溶液于试管中,_______ ,证明甲的观点正确,
(4)测定某样品中 的质量分数的实验步骤如下:
的质量分数的实验步骤如下:
Ⅰ.取5.0g该样品,在强碱性条件下·加入过量30% 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为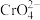 ,再继续加热一段时间。
,再继续加热一段时间。
Ⅱ.冷却后,滴入适量的稀硫酸和浓磷酸(浓磷酸的作用是防止指示剂提前变色),使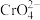 转化为
转化为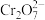 ,再加适量的蒸馏水将溶液稀释至100mL
,再加适量的蒸馏水将溶液稀释至100mL
Ⅲ.取25.00mL溶液,加入适量浓 混合均匀,滴入的3滴试亚铁灵作指示剂,用新配制的
混合均匀,滴入的3滴试亚铁灵作指示剂,用新配制的 的
的 标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗
标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗 标准溶液21.00mL(滴定中
标准溶液21.00mL(滴定中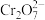 被
被 还原为
还原为 )。
)。
①步骤Ⅰ中完全转化时发生反应的离子方程式为_______ 。
②该样品中 的质量分数为
的质量分数为_______ 。
 )是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的装置如图所示:
的装置如图所示:
已知:碱性条件下,
 可将
可将 氧化
氧化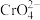 (黄色);酸性条件下,
(黄色);酸性条件下, 可将
可将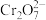 (橙色)还原为
(橙色)还原为 (绿色)。
(绿色)。回答下列问题:
(1)基态Cr原子的核外电子排布式为
(2)装置B中热水的作用是
(3)对于装置C中发生的反应,甲、乙分别提出了两种不同的观点,甲认为发生的反应是
 ;乙认为发生的反应是
;乙认为发生的反应是 。
。Ⅰ.查阅资料知:
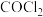 (俗称光气)有毒,遇潮湿的空气马上生成两种酸性气体,该反应的化学方程式为
(俗称光气)有毒,遇潮湿的空气马上生成两种酸性气体,该反应的化学方程式为Ⅱ.设计实验验证装置C中发生的反应;反应结束后,静置,待装置F中溶液分层后,取适量上层溶液于试管中,
(4)测定某样品中
 的质量分数的实验步骤如下:
的质量分数的实验步骤如下:Ⅰ.取5.0g该样品,在强碱性条件下·加入过量30%
 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为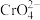 ,再继续加热一段时间。
,再继续加热一段时间。Ⅱ.冷却后,滴入适量的稀硫酸和浓磷酸(浓磷酸的作用是防止指示剂提前变色),使
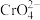 转化为
转化为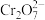 ,再加适量的蒸馏水将溶液稀释至100mL
,再加适量的蒸馏水将溶液稀释至100mLⅢ.取25.00mL溶液,加入适量浓
 混合均匀,滴入的3滴试亚铁灵作指示剂,用新配制的
混合均匀,滴入的3滴试亚铁灵作指示剂,用新配制的 的
的 标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗
标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗 标准溶液21.00mL(滴定中
标准溶液21.00mL(滴定中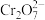 被
被 还原为
还原为 )。
)。①步骤Ⅰ中完全转化时发生反应的离子方程式为
②该样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2022-10-12更新
|
486次组卷
|
5卷引用:江西省赣州市五校联考2022-2023学年高三上学期期中考试化学试题
江西省赣州市五校联考2022-2023学年高三上学期期中考试化学试题广东省部分学校2022-2023学年高三上学期10月联考化学试题湖南省邵东市第一中学2022-2023学年高二上学期期中考试化学试题(已下线)山东省枣庄市2022-2023学年高三下学期二模考试化学试题变式题(实验综合题)安徽省滁州市实验中学等2校2022-2023学年高二上学期1月期末考试化学试题
解题方法
9 . 硒和碲是重要的稀散元素,都可以作为半导体材料。一种从碲碱渣(碲和硒的含量较高,还含有少量 、
、 等元素)分离硒回收碲的工艺流程如下:
等元素)分离硒回收碲的工艺流程如下: 、
、 及少量可溶性的铜、铅化合物等。
及少量可溶性的铜、铅化合物等。
② 为两性氧化物,微溶于水。
为两性氧化物,微溶于水。
③亚硒酸为二元弱酸,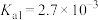 、
、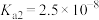
回答下列问题:
(1)硒与氧同族,基态 原子价电子排布式为
原子价电子排布式为___________ 。比较键角大小:
___________  (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是___________ 。
(2)“除杂渣”的主要成分为___________ 。
(3)“中和”时控制 为
为 ,生成
,生成 沉淀,若硫酸过量,将导致
沉淀,若硫酸过量,将导致 的回收率下降的原因是
的回收率下降的原因是___________ 。
(4)“酸浸液”中硒主要以亚硒酸的形式存在。若控制“酸浸液”的 为2,此时溶液中
为2,此时溶液中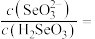
___________ 。
(5)“沉硒”时生成了一种无污染的单质气体,写出“沉硒”时发生的主要反应的化学方程式___________ 。
(6)一种以 和
和 为电极、
为电极、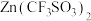 水溶液为电解质的电池,放电时,
水溶液为电解质的电池,放电时, 插入
插入 层间形成
层间形成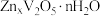 。写出该电池放电时正极的电极反应式
。写出该电池放电时正极的电极反应式___________ 。
 、
、 等元素)分离硒回收碲的工艺流程如下:
等元素)分离硒回收碲的工艺流程如下:
 、
、 及少量可溶性的铜、铅化合物等。
及少量可溶性的铜、铅化合物等。②
 为两性氧化物,微溶于水。
为两性氧化物,微溶于水。③亚硒酸为二元弱酸,
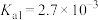 、
、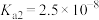
回答下列问题:
(1)硒与氧同族,基态
 原子价电子排布式为
原子价电子排布式为
 (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是(2)“除杂渣”的主要成分为
(3)“中和”时控制
 为
为 ,生成
,生成 沉淀,若硫酸过量,将导致
沉淀,若硫酸过量,将导致 的回收率下降的原因是
的回收率下降的原因是(4)“酸浸液”中硒主要以亚硒酸的形式存在。若控制“酸浸液”的
 为2,此时溶液中
为2,此时溶液中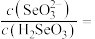
(5)“沉硒”时生成了一种无污染的单质气体,写出“沉硒”时发生的主要反应的化学方程式
(6)一种以
 和
和 为电极、
为电极、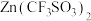 水溶液为电解质的电池,放电时,
水溶液为电解质的电池,放电时, 插入
插入 层间形成
层间形成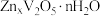 。写出该电池放电时正极的电极反应式
。写出该电池放电时正极的电极反应式
您最近一年使用:0次
10 . 某矿物A中含有 、
、 、
、 、
、 四种成分,设计如下流程图,分离出
四种成分,设计如下流程图,分离出 ,并测定矿物中铁元素的含量
,并测定矿物中铁元素的含量
I.分离

已知:
② 不溶于水,
不溶于水, 容易水解产生
容易水解产生 ;
;
②相关数据(参考依据:离子浓度 ,温度
,温度 );
);
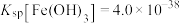 ,
,
请回答:
(1)Ti的原子序数为22,在周期表中位于________ 区,其价层电子排布式为________ 。
(2)流程中操作①需要的玻璃仪器一共有________ 种;固体B的化学式为________ 。
(3)当溶液中离子浓度达到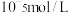 时,可视为沉淀完全,则流程图中a的取值范围是
时,可视为沉淀完全,则流程图中a的取值范围是________ 。
(4)操作②是调节 ,请写出生成
,请写出生成 的离子反应:
的离子反应:________ 。
(5)检验 是否洗涤干净的操作是
是否洗涤干净的操作是________________________________ 。
Ⅱ.测定矿物中Fe元素的含量,取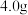 矿物A,分以下几步进行:
矿物A,分以下几步进行:
①将流程图中所得的 用浓盐酸溶解,并调节到
用浓盐酸溶解,并调节到 ,定容到100mL;
,定容到100mL;
②从中取出25mL于锥形瓶中,加入8滴50g/L的 溶液,并滴加6滴1g/L的甲基橙,微热,使
溶液,并滴加6滴1g/L的甲基橙,微热,使 全部还原为
全部还原为 ,待溶液全部褪色,该反应进行完全,将溶液冷却到室温;
,待溶液全部褪色,该反应进行完全,将溶液冷却到室温;
③向上述反应后的溶液中加入20mL硫磷混酸,再加入4滴2g/L的二苯胺磺酸钠为指示剂,用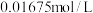 的
的 标准溶液滴定,待溶液恰好呈紫色时停止滴定,做三次平行实验,平均消耗标准
标准溶液滴定,待溶液恰好呈紫色时停止滴定,做三次平行实验,平均消耗标准 溶液的体积为
溶液的体积为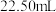 。
。
已知:步骤②和③中的离子反应分别为:
 ,
,
 。
。
请回答:
(6)滴定时应该选用________ (写实验仪器)来盛装) 标准溶液。
标准溶液。
(7)经计算,矿物中Fe元素的含量是________ (保留3位有效数字)。
(8)以下操作会导致所测Fe元素含量偏高的有________。
 、
、 、
、 、
、 四种成分,设计如下流程图,分离出
四种成分,设计如下流程图,分离出 ,并测定矿物中铁元素的含量
,并测定矿物中铁元素的含量I.分离


已知:
②
 不溶于水,
不溶于水, 容易水解产生
容易水解产生 ;
;②相关数据(参考依据:离子浓度
 ,温度
,温度 );
);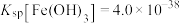 ,
,
离子 | 开始水解的pH | 完全水解的pH |
|
|
|
(1)Ti的原子序数为22,在周期表中位于
(2)流程中操作①需要的玻璃仪器一共有
(3)当溶液中离子浓度达到
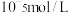 时,可视为沉淀完全,则流程图中a的取值范围是
时,可视为沉淀完全,则流程图中a的取值范围是(4)操作②是调节
 ,请写出生成
,请写出生成 的离子反应:
的离子反应:(5)检验
 是否洗涤干净的操作是
是否洗涤干净的操作是Ⅱ.测定矿物中Fe元素的含量,取
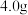 矿物A,分以下几步进行:
矿物A,分以下几步进行:①将流程图中所得的
 用浓盐酸溶解,并调节到
用浓盐酸溶解,并调节到 ,定容到100mL;
,定容到100mL;②从中取出25mL于锥形瓶中,加入8滴50g/L的
 溶液,并滴加6滴1g/L的甲基橙,微热,使
溶液,并滴加6滴1g/L的甲基橙,微热,使 全部还原为
全部还原为 ,待溶液全部褪色,该反应进行完全,将溶液冷却到室温;
,待溶液全部褪色,该反应进行完全,将溶液冷却到室温;③向上述反应后的溶液中加入20mL硫磷混酸,再加入4滴2g/L的二苯胺磺酸钠为指示剂,用
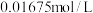 的
的 标准溶液滴定,待溶液恰好呈紫色时停止滴定,做三次平行实验,平均消耗标准
标准溶液滴定,待溶液恰好呈紫色时停止滴定,做三次平行实验,平均消耗标准 溶液的体积为
溶液的体积为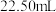 。
。已知:步骤②和③中的离子反应分别为:
 ,
, 。
。请回答:
(6)滴定时应该选用
 标准溶液。
标准溶液。(7)经计算,矿物中Fe元素的含量是
(8)以下操作会导致所测Fe元素含量偏高的有________。
A.步骤②中加入的 过多 过多 |
| B.滴定之前,锥形瓶中有少量的蒸馏水 |
| C.滴定时没有摇动锥形瓶,溶液变紫色后马上停止滴定 |
D.配制 标准溶液时,玻璃棒的下端靠在容量瓶刻度线的上方 标准溶液时,玻璃棒的下端靠在容量瓶刻度线的上方 |
您最近一年使用:0次