解题方法
1 . 锰、铬、铜、铁四种元素的基态原子中,有五个未成对电子的原子核外电子排布式为___________ 。
您最近一年使用:0次
2 . 某国产电动汽车推出的“刀片电池”具有强环境适应性,更安全可靠。“刀片电池”正极材料使用了磷酸亚铁锂(LiFePO4)。磷酸亚铁锂(LiFePO4)由Li2CO3、C6H12O6和FePO4在高温条件下制备。
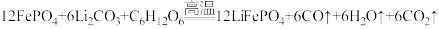
(1)铁是26号元素,它是___________ 。(选填编号)
a.主族元素b.副族元素c.短周期元素d.长周期元素
磷元素的原子核外有___________ 种运动状态不同的电子。
(2)上述方程式中,CO2的电子式为___________ ,属于第二周期的元素,原子半径由小到大排列___________ 。
(3)反应中的氧化剂是___________ ;当有0.1molLiFePO4生成时,转移电子的数目为___________ 个。
磷酸亚铁锂也可以用(CH3COO)2Fe、NH4H2PO4和LiOH为原料制备。
(4)NH4H2PO4溶于水形成的溶液中存在:c(H+)+c( )=c(OH-)+c(H2PO
)=c(OH-)+c(H2PO )+
)+___________ 。
(5)请解释(CH3COO)2Fe溶于水显酸性的原因___________ 。
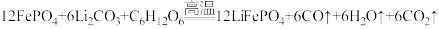
(1)铁是26号元素,它是
a.主族元素b.副族元素c.短周期元素d.长周期元素
磷元素的原子核外有
(2)上述方程式中,CO2的电子式为
(3)反应中的氧化剂是
磷酸亚铁锂也可以用(CH3COO)2Fe、NH4H2PO4和LiOH为原料制备。
(4)NH4H2PO4溶于水形成的溶液中存在:c(H+)+c(
 )=c(OH-)+c(H2PO
)=c(OH-)+c(H2PO )+
)+(5)请解释(CH3COO)2Fe溶于水显酸性的原因
您最近一年使用:0次
名校
解题方法
3 . 大型客机燃油用四乙基铅[Pb(CH2CH3)4])做抗震添加剂,但皮肤长期接触四乙基铅对身体健康有害,可用硫基乙胺(HSCH2CH2NH2)和KMnO4清除四乙基铅。
(1)碳原子核外电子的空间运动状态有______ 种,基态锰原子的外围电子排布式为___ ,该原子能量最高的电子的电子云轮廓图形状为________ 。
(2)N、C和Mn电负性由大到小的顺序为____________ 。
(3)HSCH2CH2NH2中C的杂化方式为_____ ,其中NH2-空间构型为____ ;N和P的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是_______ 。
(4)Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于_____ 晶体。已知Pb(CH2CH3)4晶体的堆积方式如下。
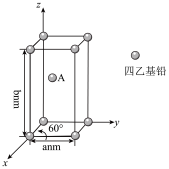
Pb(CH2CH3)4]在xy平面上的二维堆积中的配位数是___ ,A分子的坐标参数为_____ ;设阿伏加 德罗常数为NA/mol,Pb(CH2CH3)4]的摩尔质量为Mg/mol,则Pb(CH2CH3)4]晶体的密度是_____ g/cm3 (列出计算式即可)。
(1)碳原子核外电子的空间运动状态有
(2)N、C和Mn电负性由大到小的顺序为
(3)HSCH2CH2NH2中C的杂化方式为
(4)Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于

Pb(CH2CH3)4]在xy平面上的二维堆积中的配位数是
您最近一年使用:0次
2020-02-24更新
|
654次组卷
|
3卷引用:四川省遂宁市第二中学2020届高三上学期第二次高考模拟理综化学试题
四川省遂宁市第二中学2020届高三上学期第二次高考模拟理综化学试题北京专家2020届高三高考模拟试卷(二)化学试题(已下线)专题6.4 物质结构与性质(选考)(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升
4 . 氯原子核外有___ 种不同运动状态的电子,它的最外层电子排布式是___ 。
您最近一年使用:0次
15-16高三上·上海青浦·开学考试
5 . 黑火药是中国古代四大发明之一,它的爆炸反应为:
2KNO3+3C+S A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
(1)生成物A的电子式为:__________________ ,属于______________ 晶体。
(2)黑火药中位于短周期的元素有_________ 种。其中有一种元素的单质可制药,其氧化物可做防腐剂,该元素在周期表中的位置是_________ ,该元素的原子核外有_______ 种不同运动状态的电子。
(3)黑火药所含元素中原子半径从大到小的顺序是______________ (用元素符号表示);
(4)下列能说明黑火药中碳与硫两元素非金属性相对强弱的有___________________ 。
A.相同条件下水溶液的pH:Na2CO3>Na2SO4 B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价 D.加热分解温度:CH4>H2S
2KNO3+3C+S
 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)(1)生成物A的电子式为:
(2)黑火药中位于短周期的元素有
(3)黑火药所含元素中原子半径从大到小的顺序是
(4)下列能说明黑火药中碳与硫两元素非金属性相对强弱的有
A.相同条件下水溶液的pH:Na2CO3>Na2SO4 B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价 D.加热分解温度:CH4>H2S
您最近一年使用:0次
2014·上海松江·三模
解题方法
6 . 地球化学中,通常用热重分析研究矿物在受热时的质量变化以确定其组成。取66.6 mg由高岭石[Al4Si4O10(OH)8]和方解石(CaCO3)组成的矿物,加热到673K~1123K区间内分解为氧化物,样品总失重13.8 mg。高岭石受热分解反应方程式:Al4Si4O10(OH)8 →2Al2O3+4SiO2+4H2O
(1)硅原子核外电子排布在____ 个不同的电子层中,核外最外层电子分布在____ 个不同的轨道中。
(2)硅与铝同周期且相邻,化学性质有相似性,写出Si与NaOH溶液反应的化学方程式________ 。
(3)高岭石是长石的一种,不同类长石其氧原子的物质的量分数相同。由钙长石化学式CaAl2Si2O8可推知钠长石的化学式为_________________ 。
(4)此矿物中高岭石的质量分数为____________ 。
a. 44% b. 56% c. 77.5% d. 80%
(5)若对高岭土进行煅烧活化,然后利用盐酸进行分解,对于分解出的氯化铝溶液及二氧化硅再分别加入碱溶液进行去杂提纯,最后得到的氯化铝溶液可制备氧化铝。写出由氯化铝溶液得到纯净氧化铝的化学反应方程式(要求最节约):_____________________ 。
(6)用焦炭与石英砂(SiO2)混合高温,产生粗硅,现由两种方法将粗硅提纯:
第一种方法:Si+2Cl2 SiCl4 SiCl4+2H2
SiCl4 SiCl4+2H2 Si+4HCl
Si+4HCl
第二种方法:Si+3HCl SiHCl3 SiHCl3+H2
SiHCl3 SiHCl3+H2 Si+3HCl。
Si+3HCl。
工业上常用第二种方法来提纯单晶硅,其原因是_________________ 。
(1)硅原子核外电子排布在
(2)硅与铝同周期且相邻,化学性质有相似性,写出Si与NaOH溶液反应的化学方程式
(3)高岭石是长石的一种,不同类长石其氧原子的物质的量分数相同。由钙长石化学式CaAl2Si2O8可推知钠长石的化学式为
(4)此矿物中高岭石的质量分数为
a. 44% b. 56% c. 77.5% d. 80%
(5)若对高岭土进行煅烧活化,然后利用盐酸进行分解,对于分解出的氯化铝溶液及二氧化硅再分别加入碱溶液进行去杂提纯,最后得到的氯化铝溶液可制备氧化铝。写出由氯化铝溶液得到纯净氧化铝的化学反应方程式(要求最节约):
(6)用焦炭与石英砂(SiO2)混合高温,产生粗硅,现由两种方法将粗硅提纯:
第一种方法:Si+2Cl2
 SiCl4 SiCl4+2H2
SiCl4 SiCl4+2H2 Si+4HCl
Si+4HCl第二种方法:Si+3HCl
 SiHCl3 SiHCl3+H2
SiHCl3 SiHCl3+H2 Si+3HCl。
Si+3HCl。工业上常用第二种方法来提纯单晶硅,其原因是
您最近一年使用:0次
名校
7 . 铁元素和碳元素形成的单质及化合物在生产、生活中有广泛的用途,
请回答下列问题:
(1)基态Fe原子的价层电子的电子排布图为_________________ ;其最外层电子的电子云形状为___________ 。
(2)(NH4)2Fe(SO4)2 • 6H2O俗称摩尔盐。其阴离子的VSEPR模型名称为____________________ 。
写出一种与NH4+互为等电子体的分子的电子式:________________________________ 。
(3)Fe(CO)5可用作催化剂、汽油抗暴剂等.其分子中σ键和π键的数目之比为______________ 。CO的沸点高于N2的原因是_________________________ 。
(4)碳元素可形成多种单质。
①石墨烯是从石墨中剥离出来的由单层碳原子构成的平面结构新型碳材料。其中碳原子的杂化方式为______________________ 。
料,其中碳原子的杂化方式为 ,
②金刚石的晶胞如图所示。若晶胞参数为a pm,阿伏伽德罗常数的值为NA,则该晶胞中原子的体积占晶胞体积的百分率为________________ ;1cm3晶体的平均质量为___________ (列出计算式即可)。
请回答下列问题:
(1)基态Fe原子的价层电子的电子排布图为
(2)(NH4)2Fe(SO4)2 • 6H2O俗称摩尔盐。其阴离子的VSEPR模型名称为
写出一种与NH4+互为等电子体的分子的电子式:
(3)Fe(CO)5可用作催化剂、汽油抗暴剂等.其分子中σ键和π键的数目之比为
(4)碳元素可形成多种单质。
①石墨烯是从石墨中剥离出来的由单层碳原子构成的平面结构新型碳材料。其中碳原子的杂化方式为
料,其中碳原子的杂化方式为 ,
②金刚石的晶胞如图所示。若晶胞参数为a pm,阿伏伽德罗常数的值为NA,则该晶胞中原子的体积占晶胞体积的百分率为
您最近一年使用:0次
8 . (1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
则该元素是_______ (填写元素符号)。
(2)基态C原子中,电子运动状态有_____ 种,电子占据的最高能级符号为_____ ,该能级含有的轨道数为________ 。
(3)关于化合物 ,下列叙述正确的有
,下列叙述正确的有______ 。
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键
D. C原子的杂化方式是sp2和sp3
(4)已知苯酚( )具有弱酸性,其Ka=1.1×10-l0;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-l0;水杨酸第一级电离形成的离子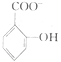 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_____ Ka(苯酚)(填“>”或“<”),其原因是____________ 。
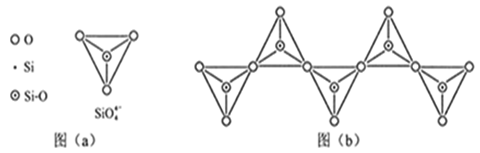
(5)在硅酸盐中,SiO44-四面体[如图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根的一部分;Si与O的原子数之比为______ ,化学式为_______ 。
| 电离能 | I1 | I2 | I3 | I4 | …… |
| Ia(kJ/mol) | 578 | 1817 | 2745 | 11578 | …… |
则该元素是
(2)基态C原子中,电子运动状态有
(3)关于化合物
 ,下列叙述正确的有
,下列叙述正确的有A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键
D. C原子的杂化方式是sp2和sp3
(4)已知苯酚(
 )具有弱酸性,其Ka=1.1×10-l0;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-l0;水杨酸第一级电离形成的离子 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)(5)在硅酸盐中,SiO44-四面体[如图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根的一部分;Si与O的原子数之比为

您最近一年使用:0次
2013·上海浦东新·二模
9 . 化学的魅力之一来自于许许多多的“最”。例如熔点最高的金属是钨,硬度最大的金属是铬,密度最大的金属是锇……。根据下面的“最”回答问题:
(1)空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式_______ ,该分子属
于___________ (填“极性”或“非极性”)分子。
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序
_____ (填元素符号),其中任意三种元素组成的物质中肯定含有的化学键是______ 键。
(3)就物理性质而言,第二周期原子序数最小的元素的单质是_________ 最小的金属,其相邻元素R的化学性质与地壳中含量最多的金属元素的化学性质相似,写出R的最高价氧化物对应水化物与NaOH溶液反应的化学方程式:______________________________ 。
(4)关于人体内含量最多的元素M和最硬非金属单质的组成元素N的说法中,正确的是___ 。
a.M和N组成的物质中,M显负价,故M的非金属性强于N
b.M的氢化物的熔沸点必定比N的氢化物的熔沸点高
c.M原子的核外电子云形状种类比N原子的核外电子云形状种类要多
d.M原子的核外未成对电子数和N原子的核外未成对电子数目相等
(1)空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式
于
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序
(3)就物理性质而言,第二周期原子序数最小的元素的单质是
(4)关于人体内含量最多的元素M和最硬非金属单质的组成元素N的说法中,正确的是
a.M和N组成的物质中,M显负价,故M的非金属性强于N
b.M的氢化物的熔沸点必定比N的氢化物的熔沸点高
c.M原子的核外电子云形状种类比N原子的核外电子云形状种类要多
d.M原子的核外未成对电子数和N原子的核外未成对电子数目相等
您最近一年使用:0次



