解题方法
1 . 锂是最轻的活泼金属,其单质及其化合物有广泛的用途。回答下列问题:
(1)在元素周期表中,与
 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是___________ ,该元素基态原子中,占据最高能级电子的电子云轮廓图形状为___________ 。
(2)LiH是一种储氢材料。
(i)Li与H中第一电离能较小的元素是___________ 。
(ii)离子半径:Li+___________ H-(填“>”“=”或“<”)。
(3)已知金属锂晶体为FCC(面心立方晶格),面心立方紧密堆积结构示意图如下:
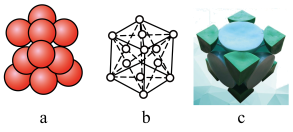
(i)晶胞中锂的配位数为___________ 。
(ii)若锂原子的半径为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则锂晶体密度为
,则锂晶体密度为___________  (列出含有
(列出含有 、
、 的计算式即可)。
的计算式即可)。
(1)在元素周期表中,与
 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是(2)LiH是一种储氢材料。
(i)Li与H中第一电离能较小的元素是
(ii)离子半径:Li+
(3)已知金属锂晶体为FCC(面心立方晶格),面心立方紧密堆积结构示意图如下:

(i)晶胞中锂的配位数为
(ii)若锂原子的半径为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则锂晶体密度为
,则锂晶体密度为 (列出含有
(列出含有 、
、 的计算式即可)。
的计算式即可)。
您最近一年使用:0次
2023-10-28更新
|
93次组卷
|
2卷引用:山西省大同市2023-2024学年高三上学期10月月考化学试题
解题方法
2 . 闪锌矿与纤锌矿的主要成分均为ZnS。在一定条件下ZnO与ZnS、Se共热可制备荧光材料ZnSe。回答下列问题:
(1)基态Zn原子占据最高能层的电子云轮廓图形状为___________ ;基态Zn与S原子成对电子数之比为___________ 。
(2)根据下列锌卤化物的熔点和溶解性,判断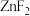 晶体的类型为
晶体的类型为___________ ;分析 、
、 、
、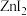 的熔点依次增大的原因
的熔点依次增大的原因___________ 。
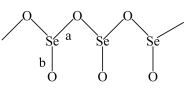
(3)固态 是以
是以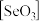 角锥体以角相连接的展平的聚合结构,每一锥体带有一悬垂的终端O原子(如图所示)。图中Se-O键键长较短的是
角锥体以角相连接的展平的聚合结构,每一锥体带有一悬垂的终端O原子(如图所示)。图中Se-O键键长较短的是___________ (填“a”或“b”)。其原因是___________ 。
(4)ZnSe晶胞与ZnS晶胞相似(如图),晶胞中距离最近的两个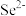 的距离为anm,请计算ZnSe晶胞的密度
的距离为anm,请计算ZnSe晶胞的密度___________  。
。

(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。ZnSe晶胞中部分原子的分数坐标为:A点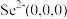 ,B点
,B点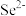 的分数坐标为
的分数坐标为___________ ;从该晶胞中找出距离B点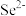 最远的
最远的 的位置
的位置___________ (用分数坐标表示)。
(1)基态Zn原子占据最高能层的电子云轮廓图形状为
(2)根据下列锌卤化物的熔点和溶解性,判断
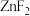 晶体的类型为
晶体的类型为 、
、 、
、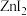 的熔点依次增大的原因
的熔点依次增大的原因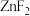 |  |  | 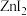 | |
| 熔点/℃ | 872 | 275 | 394 | 446 |
| 在乙醇、乙醚中的溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
 是以
是以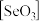 角锥体以角相连接的展平的聚合结构,每一锥体带有一悬垂的终端O原子(如图所示)。图中Se-O键键长较短的是
角锥体以角相连接的展平的聚合结构,每一锥体带有一悬垂的终端O原子(如图所示)。图中Se-O键键长较短的是
(4)ZnSe晶胞与ZnS晶胞相似(如图),晶胞中距离最近的两个
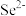 的距离为anm,请计算ZnSe晶胞的密度
的距离为anm,请计算ZnSe晶胞的密度 。
。
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。ZnSe晶胞中部分原子的分数坐标为:A点
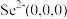 ,B点
,B点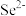 的分数坐标为
的分数坐标为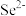 最远的
最远的 的位置
的位置
您最近一年使用:0次
2021-05-06更新
|
159次组卷
|
2卷引用:山西省运城市2020-2021学年高二下学期期中考试化学(A)试题
名校
3 . FeSe、MgB2等超导材料具有广阔的应用前景。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________ ,基态Se原子的电子占据最高能级的电子云轮廓图为________ 形。
(2)向FeSe中嵌入吡啶(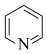 )能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为
)能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________ ;该分子内存在________ (填标号)。
A.σ键 B.π键 C.配位键 D.氢键
(3)将金属锂直接溶于液氨,得到具有很高反应活性的金属电子溶液,再通过系列反应可制得FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2。
①NH2-的空间构型为________ 。
②液氨是氨气液化的产物,氨气易液化的原因是________ 。
③金属锂溶于液氨时发生反应:Li + (m+n)NH3=X+e-(NH3)n。X的化学式为________ 。
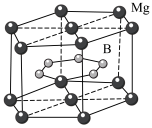
(4)MgB2晶体结构如图所示。B原子独立为一层,具有类似于石墨的结构,每个B原子周围都有________ 个与之等距离且最近的B原子;六棱柱底边边长为a cm,高为c cm,阿伏伽德罗常数的值为NA ,该晶体的密度为________ g·cm-3(列出计算式)。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)向FeSe中嵌入吡啶(
 )能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为
)能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为A.σ键 B.π键 C.配位键 D.氢键
(3)将金属锂直接溶于液氨,得到具有很高反应活性的金属电子溶液,再通过系列反应可制得FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2。
①NH2-的空间构型为
②液氨是氨气液化的产物,氨气易液化的原因是
③金属锂溶于液氨时发生反应:Li + (m+n)NH3=X+e-(NH3)n。X的化学式为
(4)MgB2晶体结构如图所示。B原子独立为一层,具有类似于石墨的结构,每个B原子周围都有
您最近一年使用:0次
2019-03-02更新
|
407次组卷
|
4卷引用:山西运城市运康中学校2019-2020学年高三12月月考化学试题
4 . 如表是元素周期表的一部分,其中的数字编号代表对应的元素。

(1)下列支持或证实原子核外电子处于能量不同的能层和能级的是______ 。
(2)结合表格,下列有关说法错误的是______ 。
(3)⑤的基态原子中能量最高的电子所在原子轨道的电子云轮廓图在空间有______ 个伸展方向,形状为______ 。
(4)元素②的最高价氧化物的电子式为______ ,元素⑥的最高正价为______ 。
(5)如表是一些气态原子失去核外不同电子所需的能量(kJ•mol-1):
①通过上述信息和表中的数据分析锂原子失去核外第二个电子时所需的能量远远大于失去第一个电子所需能量的原因是_____ 。
②表中Y可能为以上六种元素中的______ (填写数字编号)元素。

(1)下列支持或证实原子核外电子处于能量不同的能层和能级的是
| A.原子光谱 | B.原子的逐级电离能数据 |
| C.同位素现象 | D.电子跃迁现象 |
| A.元素周期系只有一个,而元素周期表可以多种多样 |
| B.第二周期的基态原子中,只有②的核外未成对电子数为2 |
C.原子①的电子云如图所示: ,它表示离核越近电子出现的几率越大 ,它表示离核越近电子出现的几率越大 |
| D.“电子气理论”可以解释金属③具有良好的导电性和延展性 |
(4)元素②的最高价氧化物的电子式为
(5)如表是一些气态原子失去核外不同电子所需的能量(kJ•mol-1):
| Li | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
②表中Y可能为以上六种元素中的
您最近一年使用:0次
5 . 中科院宁波研究所的“固态锂电池”即将量产,其技术世界领先。请完成下列问题:
(1)基态锂原子的电子排布式:______ ;基态锂原子中有_____ 种运动状态不同的电子。
(2)LiAlH4是重要的还原剂与储氢材料。其合成方法如下:① Na+Al+2H2 NaAlH4,②NaAlH4+LiCl
NaAlH4,②NaAlH4+LiCl LiAlH4+NaCl。
LiAlH4+NaCl。
①上述反应中涉及的元素的原子半径最大的是______ (填元素名称)。
②LiAlH4与水剧烈反应产生一种盐与 H2,写出反应的化学方程式:_______ 。
③LiAlH4中 H元素表现为-1价,Li元素为+1价,解释H表现出负价的理由:_______ 。
(3)Mg与 Al的电离能如下(kJ·mol-1):
第一电离能 Mg大于 Al,但第二电离能 Mg小于 Al,解释原因:_________ 。
(4)上述物质的元素中电负性最大的元素与电负性最小的元素形成的化合物的电子式为__________ 。
(1)基态锂原子的电子排布式:
(2)LiAlH4是重要的还原剂与储氢材料。其合成方法如下:① Na+Al+2H2
 NaAlH4,②NaAlH4+LiCl
NaAlH4,②NaAlH4+LiCl LiAlH4+NaCl。
LiAlH4+NaCl。①上述反应中涉及的元素的原子半径最大的是
②LiAlH4与水剧烈反应产生一种盐与 H2,写出反应的化学方程式:
③LiAlH4中 H元素表现为-1价,Li元素为+1价,解释H表现出负价的理由:
(3)Mg与 Al的电离能如下(kJ·mol-1):
| Mg | 737.7 | 1450.7 | … |
| Al | 577.5 | 1816.7 | … |
(4)上述物质的元素中电负性最大的元素与电负性最小的元素形成的化合物的电子式为
您最近一年使用:0次
2020-08-21更新
|
165次组卷
|
3卷引用:山西省运城市2019-2020学年高二下学期期末测试化学试题
山西省运城市2019-2020学年高二下学期期末测试化学试题吉林省松原市扶余市第一中学2019-2020学年高二下学期期中考试化学试题(已下线)第01章 原子结构与元素性质(A卷基础强化篇)-2020-2021学年高二化学选择性必修2同步单元AB卷(新教材鲁科版)
6 . 太阳能电池一共可分为三代,请回答下列问题:
(1)第一代太阳能电池为硅基太阳能电池,其中以单晶硅太阳能电池的转化效率最高,技术最为成熟,应用最为广泛。
①在基态Si原子中,电子占据的最高能层符号为___________ ,电子占据的最高能级的电子云轮廓图为___________ 。
②根据对角线规则,Si的一些化学性质与___________ (填短周期元素名称)相似。
(2)第二代太阳能电池是薄膜太阳能电池,如砷化镓电池。
①原子半径:Ga___________ As(填“大于”或“小于”,下同),第一电离能:Ga___________ As。
② 分子含有
分子含有___________ (填“ 键”或“
键”或“ 键”),As的最高价氧化物的化学式为
键”),As的最高价氧化物的化学式为___________ 。
③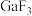 的熔点约为1000℃,
的熔点约为1000℃, 的熔点为77.9℃,其原因是
的熔点为77.9℃,其原因是___________ 。
④Ga、F、Cl的电负性由大到小的顺序为___________ 。
(3)第三代太阳能电池—钙钛矿型太阳能电池,它利用有机金属卤化物(组成为 、
、 和有机碱离子
和有机碱离子 )作为吸光材料,其晶胞结构如图所示。
)作为吸光材料,其晶胞结构如图所示。

①该有机碱离子中,C、N原子的杂化轨道类型分别为___________ 、___________ 。
②若晶胞参数为apm,则晶体密度为___________  。(阿伏加德罗常数的值为
。(阿伏加德罗常数的值为 ,列出计算式)
,列出计算式)
(1)第一代太阳能电池为硅基太阳能电池,其中以单晶硅太阳能电池的转化效率最高,技术最为成熟,应用最为广泛。
①在基态Si原子中,电子占据的最高能层符号为
②根据对角线规则,Si的一些化学性质与
(2)第二代太阳能电池是薄膜太阳能电池,如砷化镓电池。
①原子半径:Ga
②
 分子含有
分子含有 键”或“
键”或“ 键”),As的最高价氧化物的化学式为
键”),As的最高价氧化物的化学式为③
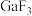 的熔点约为1000℃,
的熔点约为1000℃, 的熔点为77.9℃,其原因是
的熔点为77.9℃,其原因是④Ga、F、Cl的电负性由大到小的顺序为
(3)第三代太阳能电池—钙钛矿型太阳能电池,它利用有机金属卤化物(组成为
 、
、 和有机碱离子
和有机碱离子 )作为吸光材料,其晶胞结构如图所示。
)作为吸光材料,其晶胞结构如图所示。
①该有机碱离子中,C、N原子的杂化轨道类型分别为
②若晶胞参数为apm,则晶体密度为
 。(阿伏加德罗常数的值为
。(阿伏加德罗常数的值为 ,列出计算式)
,列出计算式)
您最近一年使用:0次
解题方法
7 . 自然界中存在大量元素,在工农业生产中有广泛应用。回答下列问题:
(1)人工合成的蓝宝石晶体(Al2O3)是目前半导体工业中应用最广泛的材料。
①基态Al原子中有______ 种运动状态不同的电子,核外电子占据最高能级的符号是_____ ,占据该能级电子的电子云轮廓图形状为_______ 。
②比较第一电高能:Mg______ Al(填“>”、”<”或“=”)。在现代化学中,常利用_________ 上的特征谱线来鉴定元素,称为光谱分析。
(2)羰基硫(COS)存在于许多种植物中,杀虫效果显著。
①1molCOS分子中含有σ键的数目为_____ ,其中心原子的杂化方式为_____ 。
②CS2、CO2、COS的分解温度由低到高的顺序为_____ 。
(3)NaCl 和MgO都属于离子化合物.NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是_______________ 。
(4)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

则:①距离一个Fe原子最近的Mg原子个数是______ ,与此晶胞结构相似的常见的离子晶体是______ (填名称)。
②若该晶体储氢时,H2分子在晶胞的体心和棱心位置,晶胞的参数为dnm,则距离最近的两个H2分子之间的距离为______ cm;含铁56g的该储氢合金可储存标准状况下H2的体积为____ L。
(1)人工合成的蓝宝石晶体(Al2O3)是目前半导体工业中应用最广泛的材料。
①基态Al原子中有
②比较第一电高能:Mg
(2)羰基硫(COS)存在于许多种植物中,杀虫效果显著。
①1molCOS分子中含有σ键的数目为
②CS2、CO2、COS的分解温度由低到高的顺序为
(3)NaCl 和MgO都属于离子化合物.NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是
(4)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

则:①距离一个Fe原子最近的Mg原子个数是
②若该晶体储氢时,H2分子在晶胞的体心和棱心位置,晶胞的参数为dnm,则距离最近的两个H2分子之间的距离为
您最近一年使用:0次



