名校
解题方法
1 . 锗、锡、铅均属于ⅣA族元素,它们的单质与化合物广泛应用于生活的各个领域。
Ⅰ.完成下列填空:
(1)锗元素原子核外能量最高的电子有_______ 个,它们运动所形成的电子云形状为_______ 形。
(2)氢化锗(GeH4)结构与甲烷类似,在常温常压下是具有刺激性气味的无色有毒气体。从结构角度比较GeH4与CH4沸点高低并说明理由_______ 。氢化锗的液氨溶液具有较好的导电性,主要是因为GeH4与NH3反应生成了 和
和_______ (填化学式)两种离子。
Ⅱ.三水锡酸钠(Na2SnO3·3H2O)是一种易溶于水的无色晶体,露置在空气中会逐渐转化成Na2CO3和Sn(OH)4。
(3)常温下,相同物质的量浓度的Na2SnO3溶液与Na2CO3溶液,前者pH_______ (填“大于”“小于”或“等于”)后者。
(4)写出三水锡酸钠露置在空气中发生反应的化学方程式_______ 。
Ⅲ.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、 、
、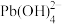 。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。
。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。

(5)Pb(NO3)2溶液中,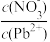
_______ 2(填“>”“=”或“<”);往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子除Na+外,还有_______ (填微粒符号)。
(6)科学家发现一种新型脱铅剂DH,能有效除去水中的痕量铅。已知DH脱铅过程中主要发生反应为:2DH(s)+Pb2+(aq) D2Pb(s)+2H+。则脱铅时最合适的pH约为
D2Pb(s)+2H+。则脱铅时最合适的pH约为_______ (选填编号)。
a.4~5 b.6~7 c.8~10 d.12~14
Ⅰ.完成下列填空:
(1)锗元素原子核外能量最高的电子有
(2)氢化锗(GeH4)结构与甲烷类似,在常温常压下是具有刺激性气味的无色有毒气体。从结构角度比较GeH4与CH4沸点高低并说明理由
 和
和Ⅱ.三水锡酸钠(Na2SnO3·3H2O)是一种易溶于水的无色晶体,露置在空气中会逐渐转化成Na2CO3和Sn(OH)4。
(3)常温下,相同物质的量浓度的Na2SnO3溶液与Na2CO3溶液,前者pH
(4)写出三水锡酸钠露置在空气中发生反应的化学方程式
Ⅲ.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、
 、
、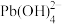 。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。
。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。
(5)Pb(NO3)2溶液中,
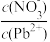
(6)科学家发现一种新型脱铅剂DH,能有效除去水中的痕量铅。已知DH脱铅过程中主要发生反应为:2DH(s)+Pb2+(aq)
 D2Pb(s)+2H+。则脱铅时最合适的pH约为
D2Pb(s)+2H+。则脱铅时最合适的pH约为a.4~5 b.6~7 c.8~10 d.12~14
您最近一年使用:0次
2022-05-29更新
|
274次组卷
|
4卷引用:上海市虹口区2022届高三下学期第二次模拟考试化学试题
上海市虹口区2022届高三下学期第二次模拟考试化学试题(已下线)2022年北京高考真题变式题1-14(已下线)2022年北京高考真题化学试题变式题(结构与性质)江西省吉安市永丰县永丰中学2022-2023学年高二上学期1月期末化学(B班)试题
2 . 工业用焦炭和硫酸钠反应制备硫化钠:Na2SO4 + 2C Na2S + CO2↑,完成下列填空:
Na2S + CO2↑,完成下列填空:
(1)硫元素在周期表中的位置为___________ ,硫原子核外有___________ 种不同运动状态的电子。
(2)CS2的结构与CO2相似,二者形成晶体时的熔点高低为:CS2___________ CO2(填“>、=、<”)。
(3)有关二硫化碳分子的描述正确的是______
(4)C元素和S元素比较,非金属性强的是___________ ,写出一个能支持你的结论的事实:___________ 。
(5)Na2S又称臭碱,Na2S溶液中含硫元素微粒的浓度由大到小的顺序是___________ 。
(6)天然气中常含有少量H2S,在酸性介质中进行天然气脱硫的原理示意图如图示,
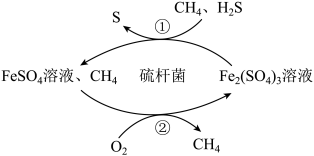
配平步骤①涉及到的方程式(先在括号里补齐生成物):_________
___________Fe2 (SO4)3 + ___________ H2S =___________ FeSO4 +___________ S↓ +___________
(7)图示中反应②是FeSO4在酸性条件下被O2氧化的过程,若有1摩尔FeSO4在酸性条件下被氧化,需要O2的体积(标准状况)为___________ 升。
 Na2S + CO2↑,完成下列填空:
Na2S + CO2↑,完成下列填空:(1)硫元素在周期表中的位置为
(2)CS2的结构与CO2相似,二者形成晶体时的熔点高低为:CS2
(3)有关二硫化碳分子的描述正确的是______
| A.含有非极性键 | B.是直线形分子 | C.属于极性分子 | D.结构式为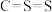 |
(5)Na2S又称臭碱,Na2S溶液中含硫元素微粒的浓度由大到小的顺序是
(6)天然气中常含有少量H2S,在酸性介质中进行天然气脱硫的原理示意图如图示,

配平步骤①涉及到的方程式(先在括号里补齐生成物):
___________Fe2 (SO4)3 + ___________ H2S =___________ FeSO4 +___________ S↓ +___________
(7)图示中反应②是FeSO4在酸性条件下被O2氧化的过程,若有1摩尔FeSO4在酸性条件下被氧化,需要O2的体积(标准状况)为
您最近一年使用:0次
解题方法
3 . SeO2是一种常见的氧化剂,易被还原成 。根据X射线衍射分析,SeO2晶体是如下图所示的长链状结构:
。根据X射线衍射分析,SeO2晶体是如下图所示的长链状结构:
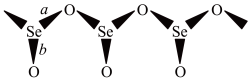
完成下列填空:
(1) 与S同属于VIA族,该族元素原子最外层电子的轨道表示式为
与S同属于VIA族,该族元素原子最外层电子的轨道表示式为_______ ,原子核外占据最高能级的电子云形状为_______ 形。
(2) SeO2在315℃时升华,蒸气中存在二聚态的SeO2,红外研究表明,二聚态的SeO2结构中存在四元环,写出该二聚态的结构式_______ 。
(3) SeO2属于_______ 晶体,其熔点远高于 的理由是
的理由是_______ 。解释键能 的原因
的原因_______ 。
(4) SeO2可将 的水溶液氧化成
的水溶液氧化成 ,反应的化学方程式为
,反应的化学方程式为_______ 。常温下,在稀溶液中硫酸的电离方式为: ;
; 。则在相同浓度
。则在相同浓度 与
与 的稀溶液中,
的稀溶液中,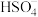 的电离程度较大的是
的电离程度较大的是_______ ,两种溶液中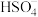 电离程度不同的原因是
电离程度不同的原因是_______ 。
 。根据X射线衍射分析,SeO2晶体是如下图所示的长链状结构:
。根据X射线衍射分析,SeO2晶体是如下图所示的长链状结构:
键长 | |
| a | 178 |
| b | 160.7 |
(1)
 与S同属于VIA族,该族元素原子最外层电子的轨道表示式为
与S同属于VIA族,该族元素原子最外层电子的轨道表示式为(2) SeO2在315℃时升华,蒸气中存在二聚态的SeO2,红外研究表明,二聚态的SeO2结构中存在四元环,写出该二聚态的结构式
(3) SeO2属于
 的理由是
的理由是 的原因
的原因(4) SeO2可将
 的水溶液氧化成
的水溶液氧化成 ,反应的化学方程式为
,反应的化学方程式为 ;
; 。则在相同浓度
。则在相同浓度 与
与 的稀溶液中,
的稀溶液中,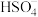 的电离程度较大的是
的电离程度较大的是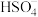 电离程度不同的原因是
电离程度不同的原因是
您最近一年使用:0次
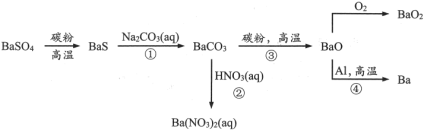
4 . 重晶石( )作为原料制备金属钡及其他含钡化合物的方法如下图:
)作为原料制备金属钡及其他含钡化合物的方法如下图:
完成下列填空:
(1)Ba在元素周期表中位于第_______ 族,最外层电子的电子云形状是_______ 。图中涉及的第二周期元素原子半径由大到小的顺序是_______ ,可以判断其中两种元素非金属性强弱的反应是_______ (选填流程中的反应编号)。
(2)配平BaS与稀硝酸反应的化学方程式:_______ 。
_______ _______
_______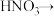 _______
_______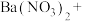 _______
_______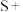 _______
_______ _______
_______
检验溶液中BaS是否完全反应的方法是:取少量反应液,加入_______ (填试剂),有黑色沉淀生成,则BaS未反应完全。
(3)工业上,利用反应①②而不用BaS直接与稀硝酸反应制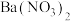 的原因是
的原因是_______ 。
(4)元素的金属性:Al_______ Ba(选填“>”或“<”);已知:沸点Al>Ba,反应④在真空容器中可以发生的理由是_______ 。
 )作为原料制备金属钡及其他含钡化合物的方法如下图:
)作为原料制备金属钡及其他含钡化合物的方法如下图:
完成下列填空:
(1)Ba在元素周期表中位于第
(2)配平BaS与稀硝酸反应的化学方程式:
_______
 _______
_______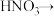 _______
_______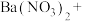 _______
_______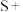 _______
_______ _______
_______
检验溶液中BaS是否完全反应的方法是:取少量反应液,加入
(3)工业上,利用反应①②而不用BaS直接与稀硝酸反应制
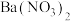 的原因是
的原因是(4)元素的金属性:Al
您最近一年使用:0次
名校
解题方法
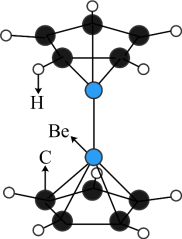
5 . 2023年6月,科学家首次合成含铍-铍能的固态化合物,相关成果发表于《科学》杂质。该分子入选2023年最“炫”分子榜单,其结构如图所示,回答下列问题: 原子最外层电子的电子云轮廓图为
原子最外层电子的电子云轮廓图为_____ (填序号)。
A.球形 B.哑铃形
(2)下列电子排布式分别代表铍微粒,其中失去1个电子所需能量最多的是_____。
(3)“固态双铍化合物的化学式为_____ ,它不含_____ (填标号)。
A.极性键 B.非极性键 C.金属键 D. 键
键
(4)卤化铍的熔点如表所示:
①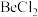 中
中 原子的杂化方式为
原子的杂化方式为_____ ;
②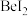
_____ (填“能”或“不能)溶于四氯化碳:
③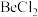 、
、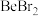 、
、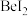 的熔点依次升高的原因是
的熔点依次升高的原因是_____ 。
(5) 易形成配离子
易形成配离子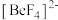 ,其中心阳离子的配位数为
,其中心阳离子的配位数为_____ ,配体是_____ (填化学符号),配离子的空间构型为_____ 。
(6)离子晶体中稳定配位多面体的理论半径比如表所示:
已知铍离子、氧离子的半径分别为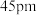 、
、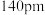 ,
, 的配位多面体是
的配位多面体是_____ 。
(7)Be的某种氧化物晶体是制备氟硼铍酸钾晶体的原料之一,其晶胞结构如图所示。这种氧化物的化学式为_____ ;设晶胞参数为 ,用
,用 表示阿伏加德罗参数的值,则
表示阿伏加德罗参数的值,则 晶体的密度为
晶体的密度为_____  (用含a和
(用含a和 的式子表示)。
的式子表示)。
 原子最外层电子的电子云轮廓图为
原子最外层电子的电子云轮廓图为A.球形 B.哑铃形
(2)下列电子排布式分别代表铍微粒,其中失去1个电子所需能量最多的是_____。
A.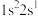 | B.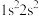 | C.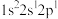 | D. |
(3)“固态双铍化合物的化学式为
A.极性键 B.非极性键 C.金属键 D.
 键
键(4)卤化铍的熔点如表所示:
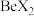 | 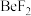 | 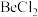 | 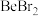 | 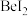 |
熔点/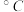 | 552 | 399 | 488 | 510 |
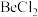 中
中 原子的杂化方式为
原子的杂化方式为②
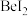
③
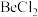 、
、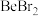 、
、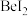 的熔点依次升高的原因是
的熔点依次升高的原因是(5)
 易形成配离子
易形成配离子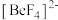 ,其中心阳离子的配位数为
,其中心阳离子的配位数为(6)离子晶体中稳定配位多面体的理论半径比如表所示:
| 配位多面体 | 配位数 | 半径比(r+/r-) |
| 平面三角形 | 3 | 0.15~0.225 |
| 四面体 | 4 | 0.225~0.414 |
| 八面体 | 6 | 0.414~0.732 |
| 立方体 | 8 | 0.732~1.000 |
| 立方八面体 | 12 | 1.000 |
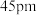 、
、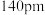 ,
, 的配位多面体是
的配位多面体是(7)Be的某种氧化物晶体是制备氟硼铍酸钾晶体的原料之一,其晶胞结构如图所示。这种氧化物的化学式为
 ,用
,用 表示阿伏加德罗参数的值,则
表示阿伏加德罗参数的值,则 晶体的密度为
晶体的密度为 (用含a和
(用含a和 的式子表示)。
的式子表示)。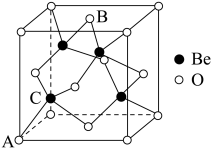
您最近一年使用:0次
6 . 镁元素在自然界分布广泛,是人体的必需元素之一。工业上可用硅热法(Pidgeon法)冶炼镁,以煅白(CaO·MgO,M = 96 g/mol)为原料与硅铁(含硅75%)混合置于密闭还原炉,1200℃下发生反应:2(CaO·MgO)(s) + Si(s)⇌Ca2SiO4 (l)+2Mg(g);完成下列填空:
(1)已知还原性Mg > Si,上述反应仍能发生的原因是_______ 。
(2)由图推测上述反应正向为_______ (填“吸热”或“放热”)反应。
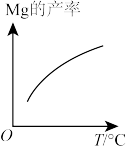
(3)若还原炉体积不变,能证明上述反应达到平衡的是_______ (选填序号)。
a.平衡常数到达最大值
b.反应物不再转化为生成物
c.炉内Ca2SiO4与CaO·MgO的质量比保持不变
d.单位时间内,n(CaO·MgO)消耗 :n(Ca2SiO4)生成 = 2:1
(4)平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将_______ (填“升高”“降低”或“不变”)。
(5)若还原炉容积为400 m3,原料中煅白质量为9600 kg,5小时后,测得煅白的转化率为50%,计算这段时间内Mg的生成速率_______ mol/(L·h)。
(6)工业上也可用电解法来制备镁。相关化合物的熔点如表所示:
①镁原子核外有_______ 种能量不同的电子,它们的运动状态有_______ 种。
②MgCl2的电子式为_______ ;
③判断工业上应选择MgCl2还是MgO作为电解原料并说明理由_______
(1)已知还原性Mg > Si,上述反应仍能发生的原因是
(2)由图推测上述反应正向为

(3)若还原炉体积不变,能证明上述反应达到平衡的是
a.平衡常数到达最大值
b.反应物不再转化为生成物
c.炉内Ca2SiO4与CaO·MgO的质量比保持不变
d.单位时间内,n(CaO·MgO)消耗 :n(Ca2SiO4)生成 = 2:1
(4)平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将
(5)若还原炉容积为400 m3,原料中煅白质量为9600 kg,5小时后,测得煅白的转化率为50%,计算这段时间内Mg的生成速率
(6)工业上也可用电解法来制备镁。相关化合物的熔点如表所示:
| MgCl2 | MgO | |
| 熔点/℃ | 712 | 2850 |
①镁原子核外有
②MgCl2的电子式为
③判断工业上应选择MgCl2还是MgO作为电解原料并说明理由
您最近一年使用:0次
名校
解题方法
7 . 2020年9月科学家发现金星上有磷化氢( ),实验室制备
),实验室制备 的常用方法有两种:
的常用方法有两种:
①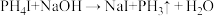
②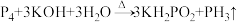
完成下列填空:
(1)P核外能量最高的电子具有相同的___________ (填写序号)。
A.轨道B.自旋方向C.电子云形状D.电子云伸展反应
(2)已知 与
与 的结构相似,
的结构相似, 的空间结构是
的空间结构是___________ 。 的分解温度比
的分解温度比
___________ (填“高”、“低”),判断的依据是___________ 。
(3)已知 为三元酸,其结构式为:
为三元酸,其结构式为: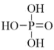 。
。
①次磷酸(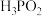 中的P的成键情况与
中的P的成键情况与 中的相同,则
中的相同,则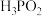 的结构式是
的结构式是___________ 。
②利用反应②制备 时,即使KOH过量,仍只生成
时,即使KOH过量,仍只生成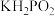 ,说明
,说明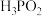 是
是___________ 元酸。
(4)常温下, 在不同pH的溶液中,各种含磷微粒的质量分数如图所示。
在不同pH的溶液中,各种含磷微粒的质量分数如图所示。

①电离平衡常数与化学平衡常数意义相同,写出 第二步电离平衡常数表达式
第二步电离平衡常数表达式
___________ 。
(2)图中可推断 溶液呈
溶液呈___________ (填“酸”、“碱”、“中”)性,可能的原因是___________ 。 溶液中各含磷微粒以及
溶液中各含磷微粒以及 按浓度由大到小的顺序排列
按浓度由大到小的顺序排列___________ 。
 ),实验室制备
),实验室制备 的常用方法有两种:
的常用方法有两种:①
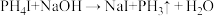
②
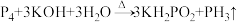
完成下列填空:
(1)P核外能量最高的电子具有相同的
A.轨道B.自旋方向C.电子云形状D.电子云伸展反应
(2)已知
 与
与 的结构相似,
的结构相似, 的空间结构是
的空间结构是 的分解温度比
的分解温度比
(3)已知
 为三元酸,其结构式为:
为三元酸,其结构式为: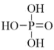 。
。①次磷酸(
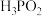 中的P的成键情况与
中的P的成键情况与 中的相同,则
中的相同,则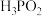 的结构式是
的结构式是②利用反应②制备
 时,即使KOH过量,仍只生成
时,即使KOH过量,仍只生成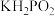 ,说明
,说明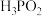 是
是(4)常温下,
 在不同pH的溶液中,各种含磷微粒的质量分数如图所示。
在不同pH的溶液中,各种含磷微粒的质量分数如图所示。
①电离平衡常数与化学平衡常数意义相同,写出
 第二步电离平衡常数表达式
第二步电离平衡常数表达式
(2)图中可推断
 溶液呈
溶液呈 溶液中各含磷微粒以及
溶液中各含磷微粒以及 按浓度由大到小的顺序排列
按浓度由大到小的顺序排列
您最近一年使用:0次
2021-04-02更新
|
224次组卷
|
4卷引用:上海市杨浦区2020-2021学年度高三下学期高中等级考模拟质量调研(3月)化学试题
上海市杨浦区2020-2021学年度高三下学期高中等级考模拟质量调研(3月)化学试题上海市杨浦区2021届高三二模化学试题(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)河北省张家口宣化一中2021届高三下学期阶段模拟(六)化学试题
名校
解题方法
8 . 硼及其化合物在工业中有很多用处。一些硼的卤化物的沸点如图所示:
(1)硼原子的核外共有____ 种形状不同的电子云;溴原子的最外层电子排布式为____ 。
(2)表中三种卤化物分子的空间构型均为平面正三角形,由此推断F—B—F的键角为____ ,BF3属于____ 分子(填“极性”或“非极性”)。
(3)解释表中三种卤化硼沸点存在差异的原因____ 。
CS2是一种重要的化工原料。
(4)工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应2S2(g)+CH4(g) CS2(g)+2H2S(g),CS2的结构式为
CS2(g)+2H2S(g),CS2的结构式为____ ,利用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单质硫,可实现废物利用,保护环境,写出其中一个反应的化学方程式____ 。
| 卤化物 | BF3 | BCl3 | BBr3 |
| 沸点/℃ | -100.3 | 12.5 | 90 |
(2)表中三种卤化物分子的空间构型均为平面正三角形,由此推断F—B—F的键角为
(3)解释表中三种卤化硼沸点存在差异的原因
CS2是一种重要的化工原料。
(4)工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应2S2(g)+CH4(g)
 CS2(g)+2H2S(g),CS2的结构式为
CS2(g)+2H2S(g),CS2的结构式为
您最近一年使用:0次
名校
9 . 氯化铵被广泛用于医药、干电池、织物印染、洗涤等领域。氯化铵T1温度下有以下平衡:
(1)N原子最外层电子有______ 种运动状态;上述平衡中物质,在晶体时属于离子晶体的是__________ 。
(2) 的电子式为
的电子式为______________ 。
(3)Cl的非金属性强于S,用原子结构的知识说明理由:_________________ 。
(4)上述该反应的平衡常数表达式为____________________________________ 。
(5)在2L密闭容器中建立平衡,不同温度下氨气浓度变化正确的是_________ 。

(6)T1温度在2L,容器中,当平衡时测得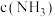 为amol/L,保持其他条件不变,压缩容器体积至1L(各物质状态不变),重新达到平衡后测得
为amol/L,保持其他条件不变,压缩容器体积至1L(各物质状态不变),重新达到平衡后测得 为bmol/L。试比较a与b的大小a
为bmol/L。试比较a与b的大小a_____ b(填“>”“<”或“=”),并说明理由:___________ 。

(1)N原子最外层电子有
(2)
 的电子式为
的电子式为(3)Cl的非金属性强于S,用原子结构的知识说明理由:
(4)上述该反应的平衡常数表达式为
(5)在2L密闭容器中建立平衡,不同温度下氨气浓度变化正确的是

(6)T1温度在2L,容器中,当平衡时测得
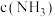 为amol/L,保持其他条件不变,压缩容器体积至1L(各物质状态不变),重新达到平衡后测得
为amol/L,保持其他条件不变,压缩容器体积至1L(各物质状态不变),重新达到平衡后测得 为bmol/L。试比较a与b的大小a
为bmol/L。试比较a与b的大小a
您最近一年使用:0次
10 . 科学家合成了一种新化合物(如图所示),其中X、Y是第三周期的非金属元素,各原子均满足8电子稳定结构。
完成下列填空:

(1)硅原子最外电子层有________ 种运动状态不同的电子,占据______ 个轨道。
(2)由题意可推知Y是Cl,推得此结论的依据是__________________ 。X和Si之间共用电子对偏离________ 。
(3)SiCl4和CCl4分子空间结构相同,则SiCl4中键角是_________ 。请说明SiCl4和CCl4沸点高低的理由。__________________________________________ 。
(4)黄磷(P4)与过量浓NaOH溶液反应,产生PH3和次磷酸钠(NaH2PO2),补全并配平该反应的化学方程式,标出电子转移的数目和方向:_____ P4+_____ NaOH+_________ →_____ PH3↑+_____ NaH2PO2,____________________ .其中氧化剂和还原剂质量比为________ 。根据题意可判断H3PO2是________ 元酸(填“一”、“二”或“三”)。
(5)已知磷酸二氢钠(NaH2PO4)溶液呈酸性,该溶液中含磷元素的离子浓度由大到小的顺序是:__________________________________________ 。
完成下列填空:

(1)硅原子最外电子层有
(2)由题意可推知Y是Cl,推得此结论的依据是
(3)SiCl4和CCl4分子空间结构相同,则SiCl4中键角是
(4)黄磷(P4)与过量浓NaOH溶液反应,产生PH3和次磷酸钠(NaH2PO2),补全并配平该反应的化学方程式,标出电子转移的数目和方向:
(5)已知磷酸二氢钠(NaH2PO4)溶液呈酸性,该溶液中含磷元素的离子浓度由大到小的顺序是:
您最近一年使用:0次



