解题方法
1 . 碱金属(Li、Na、K、Rb、Cs)及其化合物在生产、生活中有着重要的应用。
请回答:
(1)基态K原子核外有___________ 种不同的电子运动状态。
(2)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。解释X的熔点比Y高的原因:___________
(3)已知RbH2PO2是次磷酸的正盐,H3PO2的结构式为___________ ,其中P原子采取___________ 杂化方式。
(4)Al、B、H电负性分别为1.5、2.0、2.1,简要说明LiAlH4还原性比NaBH4强的原因:___________
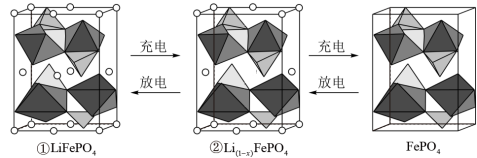
(5)锂离子电池电极材料是LiFePO4,其晶胞结构示意图如①所示。其中O围绕Fe和P分别形成4个正八面体和4个正四面体。电池充电时,LiFePO4脱出部分Li+形成Li(1-x)FePO4,其结构示意图如②所示,则Li(1-x)FePO4晶胞中n(Fe2+):n(Fe3+)=_________ 。
请回答:
(1)基态K原子核外有
(2)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。解释X的熔点比Y高的原因:
(3)已知RbH2PO2是次磷酸的正盐,H3PO2的结构式为
(4)Al、B、H电负性分别为1.5、2.0、2.1,简要说明LiAlH4还原性比NaBH4强的原因:
(5)锂离子电池电极材料是LiFePO4,其晶胞结构示意图如①所示。其中O围绕Fe和P分别形成4个正八面体和4个正四面体。电池充电时,LiFePO4脱出部分Li+形成Li(1-x)FePO4,其结构示意图如②所示,则Li(1-x)FePO4晶胞中n(Fe2+):n(Fe3+)=

您最近一年使用:0次
2023-03-12更新
|
417次组卷
|
2卷引用:浙江省浙里卷天下2022-2023学年高三百校联考3月测试化学试题
名校
解题方法
2 . 许多物质中同一元素可以存在多种化合价, 或是可以看成存在多种化合价,这样有助于把握某些反应的本质。元素R是最高化合价为+6的短周期元素,Na2R2O8是一种极强的氧化剂,该物质的某种元素可以看成存在多种化合价。注:回答下列问题时,必须用R元素的真实元素符号作答。
(1)R元素的基态原子中,具有_______ 种不同空间运动状态的电子,具有_______ 种不同运动状态的电子。
(2)已知氧化性: >
> >I2。若将Na2R2O8溶液逐滴滴加到淀粉KI试纸上,则可以看到
>I2。若将Na2R2O8溶液逐滴滴加到淀粉KI试纸上,则可以看到_______ 的现象。该过程中被还原的元素是_______ 。
(3)加热Na2R2O8溶液,可以放出一种无色无味气体,结合上述信息,写出该反应的化学方程式_______ 。
(1)R元素的基态原子中,具有
(2)已知氧化性:
 >
> >I2。若将Na2R2O8溶液逐滴滴加到淀粉KI试纸上,则可以看到
>I2。若将Na2R2O8溶液逐滴滴加到淀粉KI试纸上,则可以看到(3)加热Na2R2O8溶液,可以放出一种无色无味气体,结合上述信息,写出该反应的化学方程式
您最近一年使用:0次
3 . 绿矾 可作补血剂,其结构如图所示:
可作补血剂,其结构如图所示:
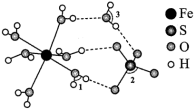
由成键一方单独提供孤电子对给予另外一方,这类“电子对给予—接受”化学键称为配位键。
(1)按照核外电子排布,可把元素周期表划分成五个区,铁元素位于元素周期表的_______ 区。
(2)基态S原子核外电子空间运动状态有___________ 种,电子占据最高能级的电子云轮廓图形状为___________ 。
(3) 中
中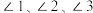 由大到小的顺序是
由大到小的顺序是___________ 。
(4)二价铁易被氧化为三价铁,结合价层电子排布式解释原因:___________ 。
 可作补血剂,其结构如图所示:
可作补血剂,其结构如图所示:
由成键一方单独提供孤电子对给予另外一方,这类“电子对给予—接受”化学键称为配位键。
(1)按照核外电子排布,可把元素周期表划分成五个区,铁元素位于元素周期表的
(2)基态S原子核外电子空间运动状态有
(3)
 中
中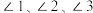 由大到小的顺序是
由大到小的顺序是(4)二价铁易被氧化为三价铁,结合价层电子排布式解释原因:
您最近一年使用:0次
4 . 近年来,我国航空航天事业成果显著,航空航天材料技术快速发展。
(1)“天宫二号”航天器使用了钛合金,质量轻,强度位于金属之首。基态钛原子的价层电子排布图为___________ 。
(2)“北斗三号”导航卫星使用的太阳能电池材料砷化镓是优良的化合物半导体,基态镓原子电子占据最高能级的电子云轮廓图为____________ 形。
(3)“C919”飞机机身使用复合材料——碳纤维和环氧树脂。
①下列电子排布图能表示碳原子的能量最低状态的是___________ (填字母)。
A.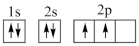 B.
B. 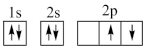 C.
C.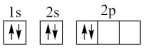 D.
D.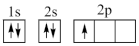
②氧原子的基态原子核外有___________ 个未成对电子。
(1)“天宫二号”航天器使用了钛合金,质量轻,强度位于金属之首。基态钛原子的价层电子排布图为
(2)“北斗三号”导航卫星使用的太阳能电池材料砷化镓是优良的化合物半导体,基态镓原子电子占据最高能级的电子云轮廓图为
(3)“C919”飞机机身使用复合材料——碳纤维和环氧树脂。
①下列电子排布图能表示碳原子的能量最低状态的是
A.
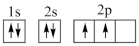 B.
B.  C.
C.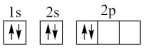 D.
D.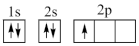
②氧原子的基态原子核外有
您最近一年使用:0次



