真题
名校
1 . 钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______ nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________ ,占据该能层电子的电子云轮廓图形状为___________ 。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________ 。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________ ,中心原子的杂化形式为________________ 。
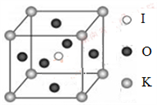
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______ nm,与K紧邻的O个数为__________ 。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______ 位置,O处于______ 位置。
 .
.
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于
 .
.
您最近一年使用:0次
2017-08-09更新
|
8917次组卷
|
22卷引用:北京市中国人民大学附属中学2020届高三教学质量监测理科综合化学试题
北京市中国人民大学附属中学2020届高三教学质量监测理科综合化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅰ卷精编版)(已下线)【中等生百日捷进提升系列-基础练测】专题2.17 物质结构与性质(已下线)【艺体生文化课百题突围系列-基础练测】专题2.17 物质结构与性质(选修)(已下线)《考前20天终极攻略》5月30日 物质结构与性质(已下线)解密21 物质的结构与性质(教师版)——备战2018年高考化学之高频考点解密西藏自治区昌都第四高级中学2019届高三下学期4月月考理科综合化学试题(已下线)《2019年高考总复习巅峰冲刺》专题12 物质结构与性质应试策略云南省富宁县民族中学2020届高三上学期开学考试化学试题四川省成都实验中学2019-2020学年度高三上学期1月月考理科综合化学试题第3章 物质的聚集状态与物质性质——C挑战区 模拟高考(鲁科版选修3)云南省大理白族自治州祥云县第一中学2020届高三下学期4月月考理综化学试题广东省梅州市五华县2018-2019学年高二上学期第六次质量监测化学试题河北省衡水中学2020届高三四月份质量监测理综化学试题(已下线)广东省深圳中学2020届高三2月份网络教学质量监测理综化学试题安徽省合肥市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题湖北省武汉市华中师范大学第一附属中学2020届高三下学期四月份网络教学质量监测理科综合化学试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练广西蒙山县第一中学2018-2019学年高二下学期第二次月考化学试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)云南省玉溪市民族中学2021-2022学年高三1月份考试理综化学试题云南省富宁县第一中学校2021-2022学年高三下学期开学考试理综化学试题
2 . 工业上用Fe(Ⅲ)作为可再生氧化剂回收工业废气中的H2S,生产单质硫。
(1)铁元素属于_______ 区(填“s”、“d”、“ds”、“p”)。
(2)Fe3+生化氧化再生法分为吸收和再生两部分。
①吸收:用Fe3+将H2S氧化为S,该反应的离子方程式是_______ 。
②再生:O2在氧化亚铁硫杆菌作用下再生Fe3+。
缺点:氧化亚铁硫杆菌生长的最佳pH范围是1.4~3.0,但酸性条件不利于H2S的吸收,结合平衡移动原理解释原因_______ 。
(3)络合铁法脱硫技术吻合节能减排、经济高效的工业化指导思想。
①碱性条件有利于H2S的吸收,但Fe3+极易形成氢氧化物和硫化物沉淀,请在图中用“↑”或“↓”补全Fe3+的电子分布图。从图中可以看出Fe3+有空轨道,可以形成溶于水的Fe3+Ln(配合物,L表示配体,n表示配位数)。_______
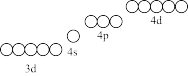
②ⅰ.写出碱性条件下Fe3+Ln氧化H2S生成S8的离子方程式_______ 。
ⅱ.O2氧化再生Fe3+Ln的离子方程式:4Fe2+Ln+O2+2H2O=4Fe3+Ln+4OH−
写出总反应的化学方程式_______ 。
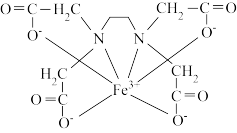
③下图是EDTA与Fe3+形成配合物的结构示意图,Fe3+外层空轨道采取sp3d2杂化,1mol该配合物中配位键有_______ mol。
(1)铁元素属于
(2)Fe3+生化氧化再生法分为吸收和再生两部分。
①吸收:用Fe3+将H2S氧化为S,该反应的离子方程式是
②再生:O2在氧化亚铁硫杆菌作用下再生Fe3+。
缺点:氧化亚铁硫杆菌生长的最佳pH范围是1.4~3.0,但酸性条件不利于H2S的吸收,结合平衡移动原理解释原因
(3)络合铁法脱硫技术吻合节能减排、经济高效的工业化指导思想。
①碱性条件有利于H2S的吸收,但Fe3+极易形成氢氧化物和硫化物沉淀,请在图中用“↑”或“↓”补全Fe3+的电子分布图。从图中可以看出Fe3+有空轨道,可以形成溶于水的Fe3+Ln(配合物,L表示配体,n表示配位数)。
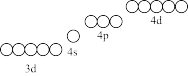
②ⅰ.写出碱性条件下Fe3+Ln氧化H2S生成S8的离子方程式
ⅱ.O2氧化再生Fe3+Ln的离子方程式:4Fe2+Ln+O2+2H2O=4Fe3+Ln+4OH−
写出总反应的化学方程式
③下图是EDTA与Fe3+形成配合物的结构示意图,Fe3+外层空轨道采取sp3d2杂化,1mol该配合物中配位键有

您最近一年使用:0次
2022-04-02更新
|
385次组卷
|
2卷引用:北京市石景山区2022届高三一模化学试题
名校
3 . 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。①~⑥表示元素在周期表中的位置,回答下列问题。
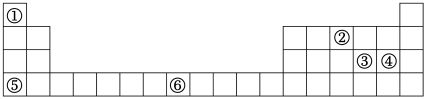
(1)①和④形成的化合物的化学式为_______ 。
(2)②的基态原子的轨道表示式为_______ ,其电子占据的最高能级的电子云轮廓是_______ 。
(3)⑤的基态原子占据的最高能层的符号是_______ ,其基态正一价离子占据的最高能级共有_______ 个原子轨道。
(4)⑥的基态正三价离子的价层电子排布式为_______ 。
(5)下列说法不正确 的是_______ 。
a.②的2px、2py、2pZ轨道互相垂直,但能量相等
b.④的p能级能量一定比s能级的能量高
c.⑥的2s、3s、4s能级的轨道数依次增多
(6)③和⑤形成的化合物的水溶液pH>7,结合离子方程式解释原因_______ 。

(1)①和④形成的化合物的化学式为
(2)②的基态原子的轨道表示式为
(3)⑤的基态原子占据的最高能层的符号是
(4)⑥的基态正三价离子的价层电子排布式为
(5)下列说法
a.②的2px、2py、2pZ轨道互相垂直,但能量相等
b.④的p能级能量一定比s能级的能量高
c.⑥的2s、3s、4s能级的轨道数依次增多
(6)③和⑤形成的化合物的水溶液pH>7,结合离子方程式解释原因
您最近一年使用:0次
2022·上海虹口·二模
名校
解题方法
4 . 锗、锡、铅均属于ⅣA族元素,它们的单质与化合物广泛应用于生活的各个领域。
Ⅰ.完成下列填空:
(1)锗元素原子核外能量最高的电子有_______ 个,它们运动所形成的电子云形状为_______ 形。
(2)氢化锗(GeH4)结构与甲烷类似,在常温常压下是具有刺激性气味的无色有毒气体。从结构角度比较GeH4与CH4沸点高低并说明理由_______ 。氢化锗的液氨溶液具有较好的导电性,主要是因为GeH4与NH3反应生成了 和
和_______ (填化学式)两种离子。
Ⅱ.三水锡酸钠(Na2SnO3·3H2O)是一种易溶于水的无色晶体,露置在空气中会逐渐转化成Na2CO3和Sn(OH)4。
(3)常温下,相同物质的量浓度的Na2SnO3溶液与Na2CO3溶液,前者pH_______ (填“大于”“小于”或“等于”)后者。
(4)写出三水锡酸钠露置在空气中发生反应的化学方程式_______ 。
Ⅲ.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、 、
、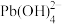 。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。
。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。

(5)Pb(NO3)2溶液中,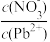
_______ 2(填“>”“=”或“<”);往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子除Na+外,还有_______ (填微粒符号)。
(6)科学家发现一种新型脱铅剂DH,能有效除去水中的痕量铅。已知DH脱铅过程中主要发生反应为:2DH(s)+Pb2+(aq) D2Pb(s)+2H+。则脱铅时最合适的pH约为
D2Pb(s)+2H+。则脱铅时最合适的pH约为_______ (选填编号)。
a.4~5 b.6~7 c.8~10 d.12~14
Ⅰ.完成下列填空:
(1)锗元素原子核外能量最高的电子有
(2)氢化锗(GeH4)结构与甲烷类似,在常温常压下是具有刺激性气味的无色有毒气体。从结构角度比较GeH4与CH4沸点高低并说明理由
 和
和Ⅱ.三水锡酸钠(Na2SnO3·3H2O)是一种易溶于水的无色晶体,露置在空气中会逐渐转化成Na2CO3和Sn(OH)4。
(3)常温下,相同物质的量浓度的Na2SnO3溶液与Na2CO3溶液,前者pH
(4)写出三水锡酸钠露置在空气中发生反应的化学方程式
Ⅲ.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、
 、
、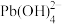 。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。
。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。
(5)Pb(NO3)2溶液中,
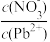
(6)科学家发现一种新型脱铅剂DH,能有效除去水中的痕量铅。已知DH脱铅过程中主要发生反应为:2DH(s)+Pb2+(aq)
 D2Pb(s)+2H+。则脱铅时最合适的pH约为
D2Pb(s)+2H+。则脱铅时最合适的pH约为a.4~5 b.6~7 c.8~10 d.12~14
您最近一年使用:0次
2022-05-29更新
|
273次组卷
|
4卷引用:2022年北京高考真题变式题1-14
(已下线)2022年北京高考真题变式题1-14(已下线)2022年北京高考真题化学试题变式题(结构与性质)上海市虹口区2022届高三下学期第二次模拟考试化学试题江西省吉安市永丰县永丰中学2022-2023学年高二上学期1月期末化学(B班)试题
5 . 氨硼烷(NH3BH3)因其高含氢量,且性质稳定,被认为是一种极具应用前景的储氢材料。
(1)氮原子中有_____ 个未成对电子。其中具有未成对电子所处能级轨道电子云轮廓图的形状为_____ (填字母)。
a.球形 b.哑铃形
(2)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),组成元素的电负性大小顺序是______ (请填元素符号),其中B的化合价为_____ 。
(3)依据对角线规则,B的化学性质与第三周期______ (请填元素符号)性质相似,原因是______ 。
(4)第一电离能I1(N)______ I1(B)(填“>”或“<”),原因是______ 。
(5)氨硼烷水解制氢可以通过催化剂进行可控放氢,Fe-Ni合金作为氨硼烷水解的催化剂,表现出很好的催化活性,写出基态Ni原子的价层电子排布式______ ,Ni属于元素周期表的______ 区。
(1)氮原子中有
a.球形 b.哑铃形
(2)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),组成元素的电负性大小顺序是
(3)依据对角线规则,B的化学性质与第三周期
(4)第一电离能I1(N)
(5)氨硼烷水解制氢可以通过催化剂进行可控放氢,Fe-Ni合金作为氨硼烷水解的催化剂,表现出很好的催化活性,写出基态Ni原子的价层电子排布式
您最近一年使用:0次
6 . 合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
(1)基态氢原子中,核外电子的电子云轮廓图形状为_______
(2)自然界中的复元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的轨道表示式为_______
② 分子中,与N原子相连的H显正电性。N、H电负性大小顺序为
分子中,与N原子相连的H显正电性。N、H电负性大小顺序为_______ 。
(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有 、
、 、
、 、
、 、
、 等氧化物中的几种。
等氧化物中的几种。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是_______ 。
②比较 、
、 第一电高能的大小:
第一电高能的大小:_______
③表中的数据从上到下是纳、镁、铝逐级失去电子的电离能。
为什么原子的逐级电高能越来越大?______ ;结合数据说明为什么 的常见化合价为
的常见化合价为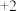 价:请解释之:
价:请解释之:_______ 。
(4)目前合成氨通常采用的压强为 温度为
温度为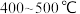 ,十分耗能。我国科研人员研制出了“
,十分耗能。我国科研人员研制出了“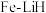 ”等催化剂,温度、压强分别降到了350℃、
”等催化剂,温度、压强分别降到了350℃、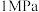 ,这是近年来合成纸反应研究中的重要突破。
,这是近年来合成纸反应研究中的重要突破。
①基态 原子的核外电子排布式为
原子的核外电子排布式为_______ 。
②比较 与
与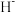 的半径大小关系:
的半径大小关系:
_______ 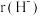 (填“>”或“<”)。
(填“>”或“<”)。
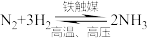
(1)基态氢原子中,核外电子的电子云轮廓图形状为
(2)自然界中的复元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的轨道表示式为
②
 分子中,与N原子相连的H显正电性。N、H电负性大小顺序为
分子中,与N原子相连的H显正电性。N、H电负性大小顺序为(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有
 、
、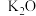 、
、 、
、 、
、 等氧化物中的几种。
等氧化物中的几种。①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是
②比较
 、
、 第一电高能的大小:
第一电高能的大小:③表中的数据从上到下是纳、镁、铝逐级失去电子的电离能。
| 元素 |  |  |  |
电离能(kJ mol-1) mol-1) | 496 | 738 | 578 |
| 4562 | 1451 | 1817 | |
| 6912 | 7733 | 2745 | |
| 9543 | 10540 | 11575 |
 的常见化合价为
的常见化合价为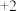 价:请解释之:
价:请解释之:(4)目前合成氨通常采用的压强为
 温度为
温度为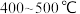 ,十分耗能。我国科研人员研制出了“
,十分耗能。我国科研人员研制出了“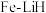 ”等催化剂,温度、压强分别降到了350℃、
”等催化剂,温度、压强分别降到了350℃、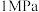 ,这是近年来合成纸反应研究中的重要突破。
,这是近年来合成纸反应研究中的重要突破。①基态
 原子的核外电子排布式为
原子的核外电子排布式为②比较
 与
与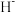 的半径大小关系:
的半径大小关系:
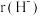 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
2021-01-24更新
|
364次组卷
|
4卷引用:北京市朝阳区2020-2021学年高二上学期期末质量检测化学试题
北京市朝阳区2020-2021学年高二上学期期末质量检测化学试题(已下线)专题二 原子结构与元素的性质-2020-2021学年高二《新题速递·化学》(人教版选修3)2月刊 (同步课堂必刷题)(已下线)专题二 原子结构与元素的性质-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修2)2月刊 (同步课堂必刷题)(已下线)1.2 原子结构与元素的性质(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)
7 . 周期表中前20种元素X、Y、Z、W原子序数依次增大,它们的结构性质等信息如下表所述:
请根据信息回答有关问题:
(1)元素X的原子核外共有_______ 种不同运动状态的电子,其基态原子中最高能级的电子云轮廓图形状是_______ 。
(2)Y的核外电子轨道表示式是_______ ,其价层电子的电子云在空间有_______ 种伸展方向。
(3)由X原子构成的共价晶体的名称是_______ ,晶体中X原子的杂化形式是_______ 。
(4)由Z和Y形成YZ3分子的电子式为_______ ,是_______ (填“极性”或“非极性”)分子。
| 元素 | 结构性质等信息 |
| X | 基态原子有三个能级,每个能级上的电子数都相等 |
| Y | 该元素原子价层电子排布式为nsnnpn+1 |
| Z | 常温常压下,该元素构成的单质是一种有毒的黄绿色气体 |
(1)元素X的原子核外共有
(2)Y的核外电子轨道表示式是
(3)由X原子构成的共价晶体的名称是
(4)由Z和Y形成YZ3分子的电子式为
您最近一年使用:0次
8 . 元素a、b、c、d、e、f在元素周期表的前四周期。
(1)元素a位于第二周期,其最高能层只有1个电子,该电子占据最高能级的符号是___________ ,占据该能级电子的电子云轮廓图为___________ 形。其离子半径___________ H-离子(填“大于”、“小于”或“等于”)。
(2)元素b的价电子排布式为nsnnpn,它的轨道表示式为___________ 。
(3)元素c、d、e为从上至下的卤族元素,关于其元素及对应单质,随核电荷数的性质变化不正确的是___________。
(4)元素f在第三周期,其各级电离能数据如下表,结合数据说明判断该元素是___________ 。
(1)元素a位于第二周期,其最高能层只有1个电子,该电子占据最高能级的符号是
(2)元素b的价电子排布式为nsnnpn,它的轨道表示式为
(3)元素c、d、e为从上至下的卤族元素,关于其元素及对应单质,随核电荷数的性质变化不正确的是___________。
A.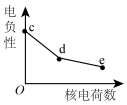 | B. | C. | D.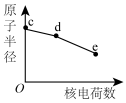 |
| 元素 | 电离能(kJ∙mol-1) | ||||
| I1 | I2 | I3 | I4 | I5 | |
| 某种元素 | 578 | 1817 | 2745 | 11575 | 14830 |
您最近一年使用:0次
解题方法
9 . 金属钛( )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
(1) 元素在周期表中的分区是位于
元素在周期表中的分区是位于___________ 区。基态 原子中含有的未成对电子数是
原子中含有的未成对电子数是___________ 。
(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为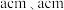 和
和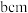 ,结构如下图所示。
,结构如下图所示。___________ , 位于距离最近的
位于距离最近的 构成的
构成的___________ 中心(填字母序号,下同)。
a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为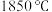 ,其晶体类型
,其晶体类型最不可 能是___________ 。
a.共价晶体 b.离子晶体 c.分子晶体
③若已知 该氧化物晶体体积为
该氧化物晶体体积为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为___________  。
。
(3)以钓铁矿 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下: 元素在元素周期表中的位置是
元素在元素周期表中的位置是___________ 。
②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:___________ 。
③结合流程及下表数据,“分离”时所需控制的最低温度应为___________  。
。
④已知 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:___________ 。
 )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。(1)
 元素在周期表中的分区是位于
元素在周期表中的分区是位于 原子中含有的未成对电子数是
原子中含有的未成对电子数是(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为
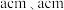 和
和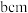 ,结构如下图所示。
,结构如下图所示。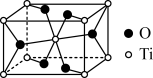
 位于距离最近的
位于距离最近的 构成的
构成的a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为
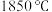 ,其晶体类型
,其晶体类型a.共价晶体 b.离子晶体 c.分子晶体
③若已知
 该氧化物晶体体积为
该氧化物晶体体积为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为 。
。(3)以钓铁矿
 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下:
 元素在元素周期表中的位置是
元素在元素周期表中的位置是②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:
③结合流程及下表数据,“分离”时所需控制的最低温度应为
 。
。 |  |  | |
熔点/ | 1668 | 651 | 714 |
沸点/ | 3287 | 1107 | 1412 |
 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:
您最近一年使用:0次
名校
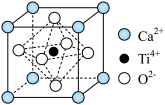
10 . 钛酸钙是最典型的钙钛矿型化合物,该类化合物具有特殊的理化性质。
(1)基态 的核外电子排布式为
的核外电子排布式为_______________ 。
(2)氧原子核外电子有__________ 种空间运动状态。比较离子半径大小
___________ 
(3)关于钛元素下列说法不正确的是________
(4)钛酸钙的阴、阳离子均可被半径相近的其它离子替代,从而衍生出多种钙钛矿型化合物。
①钛酸钙的晶胞如图所示,1个晶胞中含有 的个数是
的个数是____________
1个 周围等距且最近的
周围等距且最近的 有
有_________ 个。
②已知,钛酸钙晶体的晶胞形状为立方体,其棱长为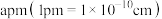 ,则钛酸钙晶体密度
,则钛酸钙晶体密度
__________  (列出计算式)。
(列出计算式)。
(5)通过离子替代可获得具有优异光电性能的有机钙钛矿型化合物 。其中有机阳离子
。其中有机阳离子 可由甲胺(
可由甲胺( )制得。
)制得。
① 中
中 的杂化方式为
的杂化方式为________________ 。
②请从化学键的角度解释由甲胺形成 的过程:
的过程:_______________ 。
(1)基态
 的核外电子排布式为
的核外电子排布式为(2)氧原子核外电子有


(3)关于钛元素下列说法不正确的是________
A.钛原子的原子轨道能量: |
| B.在钛的电子云图中,用小黑点表示绕核做高速圆周运动的电子 |
C.钛原子中,电子从 的状态跃迁到 的状态跃迁到 的状态时,将释放能量 的状态时,将释放能量 |
| D.钛在周期表中的位置是第四周期第IB族 |
(4)钛酸钙的阴、阳离子均可被半径相近的其它离子替代,从而衍生出多种钙钛矿型化合物。
①钛酸钙的晶胞如图所示,1个晶胞中含有
 的个数是
的个数是1个
 周围等距且最近的
周围等距且最近的 有
有
②已知,钛酸钙晶体的晶胞形状为立方体,其棱长为
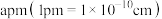 ,则钛酸钙晶体密度
,则钛酸钙晶体密度
 (列出计算式)。
(列出计算式)。(5)通过离子替代可获得具有优异光电性能的有机钙钛矿型化合物
 。其中有机阳离子
。其中有机阳离子 可由甲胺(
可由甲胺( )制得。
)制得。①
 中
中 的杂化方式为
的杂化方式为②请从化学键的角度解释由甲胺形成
 的过程:
的过程:
您最近一年使用:0次



