名校
解题方法
1 . 锗、锡、铅均属于ⅣA族元素,它们的单质与化合物广泛应用于生活的各个领域。
Ⅰ.完成下列填空:
(1)锗元素原子核外能量最高的电子有_______ 个,它们运动所形成的电子云形状为_______ 形。
(2)氢化锗(GeH4)结构与甲烷类似,在常温常压下是具有刺激性气味的无色有毒气体。从结构角度比较GeH4与CH4沸点高低并说明理由_______ 。氢化锗的液氨溶液具有较好的导电性,主要是因为GeH4与NH3反应生成了 和
和_______ (填化学式)两种离子。
Ⅱ.三水锡酸钠(Na2SnO3·3H2O)是一种易溶于水的无色晶体,露置在空气中会逐渐转化成Na2CO3和Sn(OH)4。
(3)常温下,相同物质的量浓度的Na2SnO3溶液与Na2CO3溶液,前者pH_______ (填“大于”“小于”或“等于”)后者。
(4)写出三水锡酸钠露置在空气中发生反应的化学方程式_______ 。
Ⅲ.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、 、
、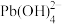 。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。
。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。

(5)Pb(NO3)2溶液中,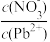
_______ 2(填“>”“=”或“<”);往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子除Na+外,还有_______ (填微粒符号)。
(6)科学家发现一种新型脱铅剂DH,能有效除去水中的痕量铅。已知DH脱铅过程中主要发生反应为:2DH(s)+Pb2+(aq) D2Pb(s)+2H+。则脱铅时最合适的pH约为
D2Pb(s)+2H+。则脱铅时最合适的pH约为_______ (选填编号)。
a.4~5 b.6~7 c.8~10 d.12~14
Ⅰ.完成下列填空:
(1)锗元素原子核外能量最高的电子有
(2)氢化锗(GeH4)结构与甲烷类似,在常温常压下是具有刺激性气味的无色有毒气体。从结构角度比较GeH4与CH4沸点高低并说明理由
 和
和Ⅱ.三水锡酸钠(Na2SnO3·3H2O)是一种易溶于水的无色晶体,露置在空气中会逐渐转化成Na2CO3和Sn(OH)4。
(3)常温下,相同物质的量浓度的Na2SnO3溶液与Na2CO3溶液,前者pH
(4)写出三水锡酸钠露置在空气中发生反应的化学方程式
Ⅲ.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、
 、
、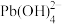 。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。
。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。
(5)Pb(NO3)2溶液中,
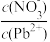
(6)科学家发现一种新型脱铅剂DH,能有效除去水中的痕量铅。已知DH脱铅过程中主要发生反应为:2DH(s)+Pb2+(aq)
 D2Pb(s)+2H+。则脱铅时最合适的pH约为
D2Pb(s)+2H+。则脱铅时最合适的pH约为a.4~5 b.6~7 c.8~10 d.12~14
您最近一年使用:0次
2022-05-29更新
|
274次组卷
|
4卷引用:江西省吉安市永丰县永丰中学2022-2023学年高二上学期1月期末化学(B班)试题
江西省吉安市永丰县永丰中学2022-2023学年高二上学期1月期末化学(B班)试题上海市虹口区2022届高三下学期第二次模拟考试化学试题(已下线)2022年北京高考真题变式题1-14(已下线)2022年北京高考真题化学试题变式题(结构与性质)
名校
2 . 合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
(1)自然界中的氨元素主要以分子的形式存在于空气中,是人工固氮的主要来源。基态氮原子核外电子最高能级的电子云轮廓图为_______ 形。
(2) 是
是____ (填“极性”或“非极性”)分子, 的键角
的键角_____ (填“>”或“<”)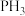 的键角。
的键角。
(3)纯叠氮酸 在常温下是一种液体,沸点较高,为
在常温下是一种液体,沸点较高,为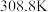 ,主要原因是
,主要原因是_______
(4)我国科研人员研制出了“ ”催化剂,将合成氨的温度、压强分别降到了
”催化剂,将合成氨的温度、压强分别降到了 、
、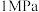 ,这是近年来合成氨反应研究中的重要突破。
,这是近年来合成氨反应研究中的重要突破。
①比较 与
与 的半径大小关系:
的半径大小关系: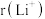
_______  (填“>”或“<”)。
(填“>”或“<”)。
② 的化合物
的化合物 是离子化合物,下图是其
是离子化合物,下图是其 循环,表示其形成过程
循环,表示其形成过程
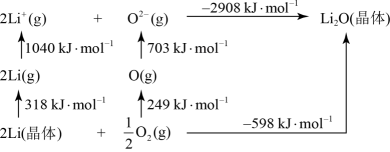
可知, 原子的第一电离能为
原子的第一电离能为_______  ,O=O键键能为
,O=O键键能为_______ 
(1)自然界中的氨元素主要以分子的形式存在于空气中,是人工固氮的主要来源。基态氮原子核外电子最高能级的电子云轮廓图为
(2)
 是
是 的键角
的键角 的键角。
的键角。(3)纯叠氮酸
 在常温下是一种液体,沸点较高,为
在常温下是一种液体,沸点较高,为 ,主要原因是
,主要原因是(4)我国科研人员研制出了“
 ”催化剂,将合成氨的温度、压强分别降到了
”催化剂,将合成氨的温度、压强分别降到了 、
、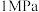 ,这是近年来合成氨反应研究中的重要突破。
,这是近年来合成氨反应研究中的重要突破。①比较
 与
与 的半径大小关系:
的半径大小关系: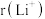
 (填“>”或“<”)。
(填“>”或“<”)。②
 的化合物
的化合物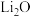 是离子化合物,下图是其
是离子化合物,下图是其 循环,表示其形成过程
循环,表示其形成过程
可知,
 原子的第一电离能为
原子的第一电离能为 ,O=O键键能为
,O=O键键能为
您最近一年使用:0次
2022-10-19更新
|
142次组卷
|
2卷引用:江西省永丰县永丰中学2022-2023学年高二上学期1月期末期末化学(A班)试题
名校
3 . FeSe、MgB2等超导材料具有广阔的应用前景。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________ ,基态Se原子的电子占据最高能级的电子云轮廓图为________ 形。
(2)向FeSe中嵌入吡啶(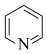 )能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为
)能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________ ;该分子内存在________ (填标号)。
A.σ键 B.π键 C.配位键 D.氢键
(3)将金属锂直接溶于液氨,得到具有很高反应活性的金属电子溶液,再通过系列反应可制得FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2。
①NH2-的空间构型为________ 。
②液氨是氨气液化的产物,氨气易液化的原因是________ 。
③金属锂溶于液氨时发生反应:Li + (m+n)NH3=X+e-(NH3)n。X的化学式为________ 。
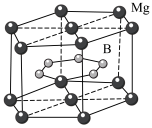
(4)MgB2晶体结构如图所示。B原子独立为一层,具有类似于石墨的结构,每个B原子周围都有________ 个与之等距离且最近的B原子;六棱柱底边边长为a cm,高为c cm,阿伏伽德罗常数的值为NA ,该晶体的密度为________ g·cm-3(列出计算式)。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)向FeSe中嵌入吡啶(
 )能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为
)能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为A.σ键 B.π键 C.配位键 D.氢键
(3)将金属锂直接溶于液氨,得到具有很高反应活性的金属电子溶液,再通过系列反应可制得FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2。
①NH2-的空间构型为
②液氨是氨气液化的产物,氨气易液化的原因是
③金属锂溶于液氨时发生反应:Li + (m+n)NH3=X+e-(NH3)n。X的化学式为
(4)MgB2晶体结构如图所示。B原子独立为一层,具有类似于石墨的结构,每个B原子周围都有
您最近一年使用:0次
2019-03-02更新
|
407次组卷
|
4卷引用:江西省泰和中学2022-2023学年高二上学期2月期末考试化学试题
名校
解题方法
4 . 据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____ 区元素,其基态原子的价电子排布式为_____ 。
(2)基态Na原子中,核外电子占据的原子轨道总数为____ ,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____ (用元素符号表示)。
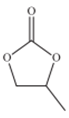
(4)CO32-的几何构型为______ ;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________ ,1mol碳酸丙烯酯中键的数目为________ .
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____ ,该配离子包含的作用力为__ (填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
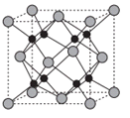
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______ ,该晶胞的密度为ρg/cm3,阿伏伽德罗常数的值为NA,则Na与O之间的最短距离为_____ cm(用含ρ、NA的代数式表示)。
回答下列问题:
(1)Te属于元素周期表中
(2)基态Na原子中,核外电子占据的原子轨道总数为
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为
(4)CO32-的几何构型为

(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为

您最近一年使用:0次
2018-04-27更新
|
459次组卷
|
5卷引用:【市级联考】江西省宜春市2019届高三上学期期末统考理科综合化学试题



