1 . 请回答下列问题:
(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况.试判断,违反了泡利原理的是________________ ,违反了洪特规则的是__________________ 。

(2)比较能及能量高低:ns________ np。(填“>”或“<”)。
(3)p电子的原子轨道呈______ 形;
(4)共价键的类型有两种分别是σ键和π键,σ键的对称方式为______ ;
(5)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为________ ;其最高价氧化物对应水化物的化学式是________ 。
(6)电负性:S______ Cl(填“>”或“<”),每个S原子有______ 对孤电子对。
(7)Na、Mg、Al三种元素中,有一种元素的电离能数据如下:
则该元素是 ______________ (填写元素符号).
(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况.试判断,违反了泡利原理的是

(2)比较能及能量高低:ns
(3)p电子的原子轨道呈
(4)共价键的类型有两种分别是σ键和π键,σ键的对称方式为
(5)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为
(6)电负性:S
(7)Na、Mg、Al三种元素中,有一种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | ...... |
| I/kJ▪mol-1 | 578 | 1817 | 2745 | 11578 | ...... |
您最近半年使用:0次
2 . 下列表达方式或说法正确的是( )
| A.基态到激发态产生的光谱是发射光谱 |
| B.每一能层的能级总是从s能级开始,且能级数不等于该能层序数 |
| C.氢原子电子云的一个小黑点表示一个电子 |
| D.电子从激发态跃迁到基态时将释放能量,光是电子释放能量的重要形式之一 |
您最近半年使用:0次
2020-09-07更新
|
612次组卷
|
3卷引用:新疆昌吉回族自治州呼图壁县第一中学2019-2020学年高二下学期期末考试化学试题
新疆昌吉回族自治州呼图壁县第一中学2019-2020学年高二下学期期末考试化学试题(已下线)第一章 原子结构与性质【过关测试基础卷】-2020-2021学年高二化学单元复习测试(新教材人教版选择性必修2)江西省吉安市永新县禾川中学2022-2023学年高二下学期4月月考化学试卷
解题方法
3 . 对核外电子运动状态的描述,较为全面的是
| A.结构示意图 | B.电子式 | C.电子排布式 | D.电子排布图 |
您最近半年使用:0次
4 . 下列说法不正确的是
| A.1s、2s、 3s的电子云轮廓图均为球形,但电子的能量不同 |
| B.最外层电子数相同的原子不一定位于同一主族,也可能在同一周期 |
C.N原子的基态电子排布图为: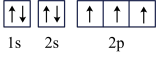 |
D.Fe3+的离子结构示意图为: |
您最近半年使用:0次
5 . 下列化学用语正确的是
| A.葡萄糖的实验式CH2O | B.硝基苯的结构简式 |
C.CO2分子填充模型 | D.p-p σ键电子云模型 |
您最近半年使用:0次
6 . 一种新型漂白剂(见下图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,Y的最外层p能级上只有一个单电子, X是地壳中含量最多的元素。W、Y、Z的最外层电子数之和等于X的最外层电子数,W、 X对应的简单离子核外电子排布相同。下 列叙述不正确的是
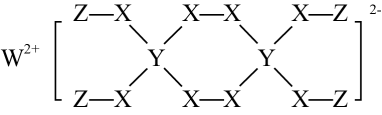

| A.Z原子中只有1个电子,故其核外只有1个原子轨道 |
| B.原子序数:W>X,对应的简单离子半径顺序:W<X |
| C.基态Y原子中有3种能量不同的电子,这些电子的运动状态共5种 |
| D.元素M是与Y同主族的短周期元素,则金属性W>M, 第一电离能W<M |
您最近半年使用:0次
2020-08-30更新
|
231次组卷
|
3卷引用:重庆市第八中学2019-2020学年高二下学期阶段性测试化学试题
名校
解题方法
7 . 下列说法正确的是( )
| A.电子在原子核外排布时,总是尽量先排在能量最低的电子层上 |
B.单核离子最外层电子数一定满足 或 或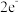 的稳定结构 的稳定结构 |
| C.元素的性质随着元素相对原子质量的递增而呈周期性变化的规律叫元素周期律 |
| D.周期表中元素种类最多的族是VⅢ族,VⅢ族有三个纵行 |
您最近半年使用:0次
2020-08-30更新
|
331次组卷
|
3卷引用:浙江省名校新高考研究联盟(Z20联盟)2020届高三第三次联考化学试题
名校
解题方法
8 . 下列有关原子核外电子的说法错误的是()
| A.在含有多个电子的原子里,电子分别在能量不同的区域内运动 |
| B.电子总是尽可能地先从内层排起,当一层充满后再填充下一层 |
| C.每个电子层作为最外层时,最多可容纳8个电子 |
| D.离原子核近的电子能量低,离原子核远的电子能量高 |
您最近半年使用:0次
2020-08-27更新
|
463次组卷
|
4卷引用:甘肃省古浪县第二中学2019-2020学年高一下学期期中考试化学期中模拟试题
甘肃省古浪县第二中学2019-2020学年高一下学期期中考试化学期中模拟试题(已下线)第01章 原子结构与元素性质(A卷基础强化篇)-2020-2021学年高二化学选择性必修2同步单元AB卷(新教材鲁科版)(已下线)人教必修第一册第4章第1节第1课时原子结构(课后)福建省华安县第一中学2022-2023学年高一上学期第二次月考化学试题
9 . 以下原子能产生发射光谱的是
| A.1s22s1 | B.1s22s22p1 | C.1s22s12p2 | D.1s22s22p3 |
您最近半年使用:0次
2020-08-24更新
|
352次组卷
|
2卷引用:江苏省常州市第二中学2019-2020学年高二上学期12月月考化学试题
10 . (1)写出碳原子最外电子层的轨道表示式___ 。
(2)钛(Ti)是22号元素,它是___ (选填编号)
a.主族元素 b.副族元素 c.短周期元素 d.长周期元素
(3)CS2分子的电子式为____ ;其熔沸点比CO2高的原因是___ 。
(4)氟化钠溶液中,不存在的微粒间作用力是___ (填标号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(5)金属铜单独与氨水或过氧化氢均不能反应,但可与过氧化氢和过量氨水的混合溶液反应生成一种配位化合物,其反应的化学方程式可表示为_____ 。
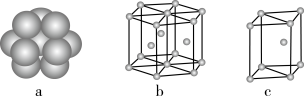
(6)镁单质晶体中原子的堆积模型为六方最密堆积(如图),它的晶胞是图中的___ (填a、b或c);配位数是____ ;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2acm3,镁单质的密度为ρg•cm-3,已知阿伏加 德罗常数为NA,则镁的摩尔质量的计算式是__ 。
(2)钛(Ti)是22号元素,它是
a.主族元素 b.副族元素 c.短周期元素 d.长周期元素
(3)CS2分子的电子式为
(4)氟化钠溶液中,不存在的微粒间作用力是
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(5)金属铜单独与氨水或过氧化氢均不能反应,但可与过氧化氢和过量氨水的混合溶液反应生成一种配位化合物,其反应的化学方程式可表示为

(6)镁单质晶体中原子的堆积模型为六方最密堆积(如图),它的晶胞是图中的
您最近半年使用:0次



