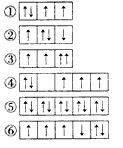
1 . (I)(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理____________ ,哪些违反了洪特规则_______________ 。哪些既没有违反泡利原理又没有违反洪特规则_______________ 。
(Ⅱ)等电子原理:原子数相同、最外层电子总数相同的分子互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第二周期元素组成的分子中,互为等电子体的是:______ 和______ ;______ 和______ .
(2)此后,等电子原理又有所发展.例如,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征.在短周期元素组成的物质中,与NO2-互为等电子体的分子有:______ 、______ .

(Ⅱ)等电子原理:原子数相同、最外层电子总数相同的分子互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第二周期元素组成的分子中,互为等电子体的是:
(2)此后,等电子原理又有所发展.例如,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征.在短周期元素组成的物质中,与NO2-互为等电子体的分子有:
您最近一年使用:0次
2 . 前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有几种
| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
名校
解题方法
3 . 下列说法错误的是
| A.电子排布(21Sc)1s22s22p63s23p63d3违反了能量最低原理 |
| B.电子排布式(6C)1s22s22px2违反了洪特规则 |
| C.ns电子的能量不一定高于(n-1)p电子的能量,根据构造原理,原子核外电子填充顺序为1s2s2p3s3p4s3d4p5s5p4d6s4f5d6p |
| D.电子排布式(22Ti) 1s22s22p63s23p10违反了泡利原理 |
您最近一年使用:0次
4 . 中国营养学会修订颁布的“每日膳食营养素供给量”将硒(Se)列为15种每日膳食营养素之一,提出一个成年人每天对硒的适宜摄入量是50 ~250μg。回答下列有关问题:
(1) Se 原子的价电子排布式为_______ ,基态78 Se 原子中,核外存在______ 对自旋方向相反的电子。
(2)碱金属的硒化物溶液能够溶解硒,生成多硒化合物(M2Sex)。如多硒化钠Na2Se8,该物质中,化学键类型是________ ,Se原子之间形成的空间构型为_________________ 。
(3)As、S在元素周期表中均与Se 相邻,其氢化物分别是AsH3、H2Se和H2S其氢化物的稳定性强弱顺序为______________________ 。
(4)SeCl2和BeCl2均为1:2组成的分子,SeCl2中Se的轨道杂化类型是_______ ,BeCl2中Be的轨道杂化类型是_________________ 。
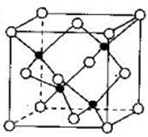
(5)Zn与Se同周期,S与Se同主族。由Zn与S形成的ZnS可用于制白色的颜料及玻璃、发光粉、橡胶、塑料、发光油漆等。ZnS晶胞结构如图所示,黑球代表的原子在晶胞内,白球代表的原子除在顶点外,其余的原子在晶胞_________ (填“内部”“棱上”或“面心”),若该晶体的密度为ρg·㎝-3,阿伏伽德罗常数为NA mol-1,则立方晶胞的棱长=_____ ㎝(用含p、NA的代数式表示)。
(1) Se 原子的价电子排布式为
(2)碱金属的硒化物溶液能够溶解硒,生成多硒化合物(M2Sex)。如多硒化钠Na2Se8,该物质中,化学键类型是
(3)As、S在元素周期表中均与Se 相邻,其氢化物分别是AsH3、H2Se和H2S其氢化物的稳定性强弱顺序为
(4)SeCl2和BeCl2均为1:2组成的分子,SeCl2中Se的轨道杂化类型是
(5)Zn与Se同周期,S与Se同主族。由Zn与S形成的ZnS可用于制白色的颜料及玻璃、发光粉、橡胶、塑料、发光油漆等。ZnS晶胞结构如图所示,黑球代表的原子在晶胞内,白球代表的原子除在顶点外,其余的原子在晶胞
您最近一年使用:0次
5 . 现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)A基态原子中能量最高的电子,其电子云在空间有___________ 个方向,原子轨道呈___________ 形。
(2)某同学根据上述信息,所画的B电子排布图如图

违背了___________ 原理。
(3)F位于___________ 族___________ 区,其基态原子有___________ 种运动状态。
(4)CD3 中心原子的杂化方式为___________ ,用价层电子对互斥理论推测其分子空间构型为___________ 。
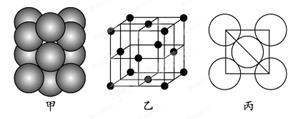
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为___________ ,该单质晶体中原子的堆积方式为四种基本堆积方式中的___________ 。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为___________ g·cm-3(用字母表示)。
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
(2)某同学根据上述信息,所画的B电子排布图如图

违背了
(3)F位于
(4)CD3 中心原子的杂化方式为
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为

您最近一年使用:0次
2016-12-09更新
|
1088次组卷
|
5卷引用:2012-2013学年河北省衡水市第十四中学高二下学期期末考试化学试卷
(已下线)2012-2013学年河北省衡水市第十四中学高二下学期期末考试化学试卷(已下线)2013-2014宁夏银川一中高二下学期期末考试化学试卷2014-2015学年宁夏宁大附中高二上学期期中考试化学试卷2016届湖南省益阳市高三下学期4月调研理综化学试卷河南省宏力学校2018-2019学年高二下学期期中考试化学试题
9-10高二下·江苏·期末
解题方法
6 . 已知锰的核电荷数为25,以下是一些同学绘制的基态锰原子核外电子的轨道表示式(即电子排布图),其中最能准确表示基态锰原子核外电子运动状态的是
A. | B.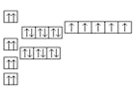 |
C. | D.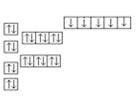 |
您最近一年使用:0次
11-12高二上·湖北宜昌·期末
7 . 在原子结构理论中,有四个原理,分别是①构造原理,②泡利原理,③洪特规则,④能量最低原理。在以下的现象中主要决定的因素是(填序号,各只填一项)
(1)各能级最多容纳的电子数是该能级原子轨道数的2倍_____________ ;
(2)碳原子的核外电子排布基态时是1s22s22p2而不是1s22s12p3___________ ;
(3)最外层电子数不会超过8个,次外层电子数不会超过18个_____________ ;
(4)铬(24Cr)的电子排布式是1s22s22p63s23p63d54s1而不是1s22s22p63s23p63d44s2________ ;
(5)磷原子的基态原子结构中,有3个未成对的单电子____________ 。
(1)各能级最多容纳的电子数是该能级原子轨道数的2倍
(2)碳原子的核外电子排布基态时是1s22s22p2而不是1s22s12p3
(3)最外层电子数不会超过8个,次外层电子数不会超过18个
(4)铬(24Cr)的电子排布式是1s22s22p63s23p63d54s1而不是1s22s22p63s23p63d44s2
(5)磷原子的基态原子结构中,有3个未成对的单电子
您最近一年使用:0次



