名校
解题方法
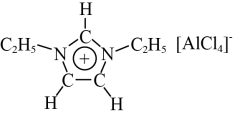
1 . 离子液体是一种全部由离子组成的液体,它具有独特的性能,被广泛应用于化学研究的各个领域中。某离子液体由如图所示正离子和负离子构成。
(1)正离子中各元素的电负性由小到大的顺序为_____ (用元素符号表示);正离子中C原子的杂化方式为______ 。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的N原子,其电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的N原子,其电子自旋磁量子数的代数和为_____ 或_____ 。
(3)正离子中存在的作用力有_____ (填标号)。
a.极性共价键 b.非极性共价键 c.氢键 d.离子键
(4)基态Cl原子的价层电子的轨道表示式为_____ 。
(5)负离子的空间结构为_____ 形。
(6)分子中的大π键可用符号π 表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数,如苯(
表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数,如苯(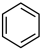 )中的大π键可表示为π
)中的大π键可表示为π 。则正离子中的大π键可表示为
。则正离子中的大π键可表示为_____ 。
(1)正离子中各元素的电负性由小到大的顺序为
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的N原子,其电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的N原子,其电子自旋磁量子数的代数和为(3)正离子中存在的作用力有
a.极性共价键 b.非极性共价键 c.氢键 d.离子键
(4)基态Cl原子的价层电子的轨道表示式为
(5)负离子的空间结构为
(6)分子中的大π键可用符号π
 表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数,如苯(
表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数,如苯( )中的大π键可表示为π
)中的大π键可表示为π 。则正离子中的大π键可表示为
。则正离子中的大π键可表示为
您最近一年使用:0次
2023-02-28更新
|
304次组卷
|
3卷引用:辽宁省锦州市2022-2023学年高二上学期期末考试化学试题
2023高三·全国·专题练习
名校
2 . 下列对分子的性质的解释,不正确的是
| A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 |
| B.水在结冰时体积膨胀,是由于水分子之间存在氢键 |
C. 分子中硅氯键的极性比 分子中硅氯键的极性比 中碳氯键的弱 中碳氯键的弱 |
D.青蒿素分子式为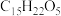 ,结构如图,该分子中包含7个手性碳原子 ,结构如图,该分子中包含7个手性碳原子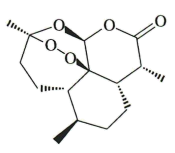 |
您最近一年使用:0次
解题方法
3 . W、X、Y、Z、R是五种短周期主族元素,原子序数依次增大。W元素的一种离子与 具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为3:2,X与Z同主族,Z的价层电子排布式为
具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为3:2,X与Z同主族,Z的价层电子排布式为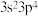 。下列说法错误的是
。下列说法错误的是
 具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为3:2,X与Z同主族,Z的价层电子排布式为
具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为3:2,X与Z同主族,Z的价层电子排布式为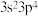 。下列说法错误的是
。下列说法错误的是| A.简单气态氢化物的热稳定性:Z>Y |
| B.W与Li的原子半径:W<Li |
| C.X和Y的第一电离能:X>Y |
| D.X、Z、R的电负性:R<Z<X |
您最近一年使用:0次
名校
4 . 某农药杀虫剂中含有的成分如图。已知X、Y、Z、N、M为原子序数依次增大的短周期元素,已知Y、Z位于同一个周期,X、N位于同一主族。则下列说法错误的是
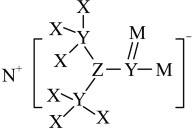
A.电负性大小排序: |
| B.该化合物难溶于水,不能与水形成氢键 |
C.该化合物可与 、 、 等形成配合物 等形成配合物 |
| D.M的最高价氧化物的水化物形成的浓溶液能与M的气态氢化物反应 |
您最近一年使用:0次
2023-01-12更新
|
479次组卷
|
7卷引用:辽宁省葫芦岛市普通高中2022-2023学年高三第一次模拟考试(一模) 化学试题
名校
解题方法
5 . 金属钛被誉为“二十一世纪金属”,有“生物金属,海洋金属,太空金属”的美称,具有广泛的应用前景。回答下列问题:
(1)钛在周期表中的位置_______ ,钛原子核外有_______ 种空间运动状态不同的电子,Ti2+电子占据的最高能层的电子排布式为_______ 。
(2)磷酸钛铝锂可用作锂离子电池的正极材料,PO 的空间构型是
的空间构型是_______ ,第一电离能介于Al、P之间的第三周期元素为_______ (填元素符号)。
(3)Ti(BH4)2是一种储氢材料,其中所含元素的电负性由小到大排列顺序为_______ ,B原子的杂化方式是_______ ,其中的BH 可由BH3和H-结合而成。BH
可由BH3和H-结合而成。BH 含有
含有_______ (填序号)
①σ键②π键③氢键④配位键 ⑤离子键
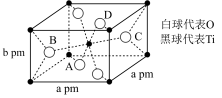
(4)TiO2在自然界中有三种同素异形态,即金红石型、锐钛型和斜钛型三种,其中金红石型是三种变体中最稳定的一种,其晶胞如图所示,该晶体的密度为_______ g·cm-3(设阿伏加德罗常数的值为NA,用含a、b、NA的代数式表示)。
(1)钛在周期表中的位置
(2)磷酸钛铝锂可用作锂离子电池的正极材料,PO
 的空间构型是
的空间构型是(3)Ti(BH4)2是一种储氢材料,其中所含元素的电负性由小到大排列顺序为
 可由BH3和H-结合而成。BH
可由BH3和H-结合而成。BH 含有
含有①σ键②π键③氢键④配位键 ⑤离子键
(4)TiO2在自然界中有三种同素异形态,即金红石型、锐钛型和斜钛型三种,其中金红石型是三种变体中最稳定的一种,其晶胞如图所示,该晶体的密度为

您最近一年使用:0次
2023-01-11更新
|
509次组卷
|
3卷引用:辽宁省沈阳市第十五中学2022-2023学年高二下学期4月月考化学试题
名校
解题方法
6 . 短周期元素X、Y、Z原子序数依次增大,X元素基态原子有2个未成对电子,Y元素基态原子的核外p电子数比s电子数少1个,Z的一种“超原子”( )具有40个价电子,下列说法错误的是
)具有40个价电子,下列说法错误的是
 )具有40个价电子,下列说法错误的是
)具有40个价电子,下列说法错误的是A.X、Y、Z的电负性和电离能均为: |
B.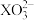 的空间构型为平面三角形 的空间构型为平面三角形 |
C.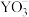 中心原子的杂化方式为 中心原子的杂化方式为 杂化 杂化 |
D.简单离子半径: |
您最近一年使用:0次
2023-01-05更新
|
402次组卷
|
3卷引用:辽宁省部分重点中学2022-2023学年高二上学期期末联考化学试题
辽宁省部分重点中学2022-2023学年高二上学期期末联考化学试题辽宁省丹东市第二中学 大石桥市第三高级中学2022-2023学年高二上学期期末联考化学试题(已下线)专题01 物质的结构与性质-备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)
7 . 下列说法不正确的是
| A.原子半径:Mg>Al>N | B.第一电离能:S>P>Si |
C.酸性: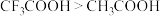 | D.电负性:F>Cl>S |
您最近一年使用:0次
2022-12-29更新
|
320次组卷
|
2卷引用:辽宁省大连市2022-2023学年高二上学期期末考试化学试题
名校
8 . 某离子化合物(如图所示)广泛应用于电镀工艺,Q、X、Y、W、Z为原子序数依次增大的短周期元素,Y原子核外电子数是Z原子核外电子数的一半。下列叙述正确的是
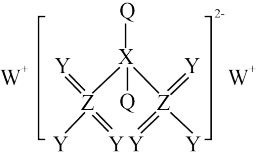

| A.Y元素单质的熔点高于W |
| B.元素电负性大小的顺序为Y>Z>Q>X |
| C.这五种元素分别位于4个不同主族 |
| D.化合物XZ2的空间构型为直线形 |
您最近一年使用:0次
2022-12-20更新
|
430次组卷
|
6卷引用:辽宁省锦州市渤海大学附属高级中学2023-2024学年高三上学期第三次考试化学试题
辽宁省锦州市渤海大学附属高级中学2023-2024学年高三上学期第三次考试化学试题甘肃省会宁县第三中学2021-2022学年高三上学期第三次月考化学试题(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(选择题1-5)山东省济宁市第一中学2022-2023学年高二下学期期中考试化学试题江苏省扬州中学2022-2023学年高三下学期3月月考化学试题(已下线)选择题11-14
名校
9 . 镍氢电池有着广泛的应用,旧电池的回收和再利用同样的重要。废旧镍氢电池中常含有NiOOH、 、及少量
、及少量 、FeO等,以下为金属分离以及镍的回收流程,按要求回答下列问题:
、FeO等,以下为金属分离以及镍的回收流程,按要求回答下列问题:
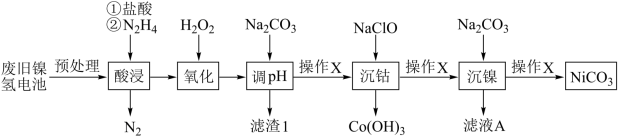
(1) 的电子排布式为:
的电子排布式为:___________________________ 。
(2)“酸浸”中,加入 的主要作用是
的主要作用是_______________________________ 。
(3)“氧化”过程中与 有关的离子方程式是
有关的离子方程式是_____________ ,滤渣1的化学式是___________ 。
(4)滤液A的主要溶质是________ ;操作X是_________ 。
(5)丁二酮肟( )是检验溶液中
)是检验溶液中 的灵敏试剂,常与
的灵敏试剂,常与 形成图A所示的配合物,图B是硫代氧的结果;
形成图A所示的配合物,图B是硫代氧的结果;
A.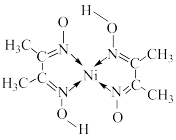 B.
B.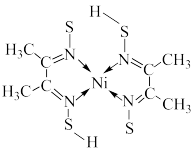
①下列说法正确的有_________ (填字母)。
a.A中所含元素中N元素的电负性最大 B.在A中C-C-C键角是180°
C.在B中-SH上的S原子采取 杂化 D.在B中存在σ键、π键与配位键
杂化 D.在B中存在σ键、π键与配位键
②化合物A的熔、沸点高于化合物B的原因是_________ 。
 、及少量
、及少量 、FeO等,以下为金属分离以及镍的回收流程,按要求回答下列问题:
、FeO等,以下为金属分离以及镍的回收流程,按要求回答下列问题:
(1)
 的电子排布式为:
的电子排布式为:(2)“酸浸”中,加入
 的主要作用是
的主要作用是(3)“氧化”过程中与
 有关的离子方程式是
有关的离子方程式是(4)滤液A的主要溶质是
(5)丁二酮肟(
 )是检验溶液中
)是检验溶液中 的灵敏试剂,常与
的灵敏试剂,常与 形成图A所示的配合物,图B是硫代氧的结果;
形成图A所示的配合物,图B是硫代氧的结果;A.
 B.
B.
①下列说法正确的有
a.A中所含元素中N元素的电负性最大 B.在A中C-C-C键角是180°
C.在B中-SH上的S原子采取
 杂化 D.在B中存在σ键、π键与配位键
杂化 D.在B中存在σ键、π键与配位键②化合物A的熔、沸点高于化合物B的原因是
您最近一年使用:0次
名校
解题方法
10 . 短周期主族元素X、Y、Z、W、M、N的原子序数依次增大,X核外电子只有1种运动状态,Y、W的2p轨道均含有2个未成对电子,M的单质被称为“国防金属”,N的氢氧化物具有两性,下列说法正确的是
| A.电负性:Z<Y<W | B.Y的氢化物沸点不一定低于W的氢化物 |
| C.第一电离能:M<N | D.N的单质可以在高温下还原M的氧化物 |
您最近一年使用:0次
2022-12-16更新
|
128次组卷
|
2卷引用:辽宁省葫芦岛市兴城市高级中学等四校2022-2023学年高二上学期12月月考化学试题



