名校
解题方法
1 . 下列有关比较中错误的是
| A.元素的电负性:N<O<F | B.元素的金属性:Na>Mg>Al |
| C.元素的第一电离能:C<N<O | D.元素的最高正价:P<S<Cl |
您最近一年使用:0次
2022-01-24更新
|
185次组卷
|
5卷引用:辽宁省朝阳市建平县实验中学2021-2022学年高二上学期期末考试化学试题
2 . 铜是人类最早使用的金属之一,用黄铜矿(主要成分为CuFeS2)生产粗铜的反应原理如下:
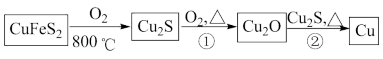
回答下列问题:
(1)第三周期主族元素中电负性比S小的元素有______ 种,H2S分子的空间结构名称为______ ,H2S的沸点比H2O的______ (填“高”或“低”),原因是_____ 。
(2)Cu2O和Cu2S均为________ 晶体,Cu2O的熔点为1235℃,Cu2S的熔点为1130℃,Cu2O熔点较高的原因是______ 。
(3)反应①、②中会生成气体SO2,其中心原子的杂化方式为______ 。
(4)铜的两种氧化物的晶胞如图1、图2所示,图1表示______ (填化学式),图2中,A原子坐标参数为(0,0,0),B原子为( ,
, ,
, ),则C原子的坐标参数为
),则C原子的坐标参数为_____ 。若图2表示的晶体的密度为 ,阿伏加德罗常数的值为NA,则图2晶胞中Cu原子与O原子之间的最小距离为
,阿伏加德罗常数的值为NA,则图2晶胞中Cu原子与O原子之间的最小距离为_____ (用含 和NA的式子表示)pm。
和NA的式子表示)pm。
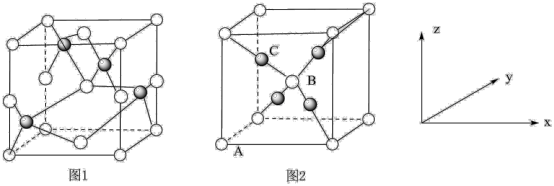
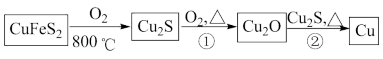
回答下列问题:
(1)第三周期主族元素中电负性比S小的元素有
(2)Cu2O和Cu2S均为
(3)反应①、②中会生成气体SO2,其中心原子的杂化方式为
(4)铜的两种氧化物的晶胞如图1、图2所示,图1表示
 ,
, ,
, ),则C原子的坐标参数为
),则C原子的坐标参数为 ,阿伏加德罗常数的值为NA,则图2晶胞中Cu原子与O原子之间的最小距离为
,阿伏加德罗常数的值为NA,则图2晶胞中Cu原子与O原子之间的最小距离为 和NA的式子表示)pm。
和NA的式子表示)pm。
您最近一年使用:0次
2022-01-24更新
|
251次组卷
|
2卷引用:辽宁省县级重点高中协作体2021-2022学年高二上学期期末考试化学试题
3 . 下列各说法中正确的是
| A.N-O键的极性比C-O键的极性大 |
| B.元素周期表中的第IA族和第VIIA族元素的原子间不能形成共价键 |
| C.C=C键的键能等于C-C键键能的2倍 |
| D.O-H键的键能小于H-F键的键能 |
您最近一年使用:0次
2022-01-24更新
|
270次组卷
|
2卷引用:辽宁省县级重点高中协作体2021-2022学年高二上学期期末考试化学试题
解题方法
4 . 治疗新冠肺炎药物瑞德西韦的主要成分结构如图。下列说法错误的是


A.分子中存在 键、 键、 键 键 |
B.分子中的 键的键能小于 键的键能小于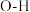 键的键能 键的键能 |
C.分子中N、O、P原子的第一电离能由大到小的关系为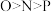 |
| D.分子中含有手性碳原子 |
您最近一年使用:0次
2022-01-23更新
|
447次组卷
|
4卷引用:辽宁省锦州市2021-2022学年高二上学期期末考试化学试题
辽宁省锦州市2021-2022学年高二上学期期末考试化学试题(已下线)第二章 分子结构与性质 章节过关检测-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)河北鸡泽县第一中学2021-2022学年高二下学期开学考试化学试题山东省烟台市华夏学校2021-2022学年高二上学期期中考试化学试题
5 . a、b、c、d、e五种短周期元素的最低负化合价和电负性数据如表所示。下列判断正确的是
| 元素 | a | b | c | d | e |
| 最低负化合价 |  |  |  |  |  |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| A.元素a的最高能级轨道中无自旋方向相同的电子 |
| B.a、c形成化合物的熔沸点小于a、e形成化合物的熔沸点 |
C.b、c、e的原子半径由大到小的顺序为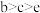 |
| D.c、d、e的氢化物之间都可以形成氢键 |
您最近一年使用:0次
名校
解题方法
6 . 硅及其化合物广泛应用于光电材料领域,其中SiCl4与N-甲基咪唑(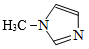 )反应可以得到M2+,其结构如图所示。下列叙述错误的是
)反应可以得到M2+,其结构如图所示。下列叙述错误的是

 )反应可以得到M2+,其结构如图所示。下列叙述错误的是
)反应可以得到M2+,其结构如图所示。下列叙述错误的是
| A.SiCl4的空间构型为正四面体 |
| B.1个M2+中含有42个σ键。 |
| C.H、C、N的电负性由大到小的顺序为N>C>H |
| D.N-甲基咪唑分子中碳原子的杂化轨道类型为sp2、sp3 |
您最近一年使用:0次
2022-01-22更新
|
898次组卷
|
6卷引用:辽宁省沈阳市三校2023届高三下学期联合模拟考试化学试题
辽宁省沈阳市三校2023届高三下学期联合模拟考试化学试题山东省菏泽市2021~2022学年高三上学期期末考试化学(A卷 )试题(已下线)提升卷03-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)湖北省枣阳市第一中学2021-2022学年高三下学期2月月考化学试题(已下线)化学(山东A卷)-学易金卷:2023年高考第一次模拟考试卷山东省实验中学2022-2023学年高三下学期开学考试化学试题
名校
解题方法
7 . 具有下列电子层结构或性质的原子:①2p轨道上有2对成对电子的原子;②外围电子构型为2s22p3的原子;③短周期第一电离能最小;④第三周期离子半径最小。则下列有关比较中正确的是
| A.原子半径:④>③>②>① | B.电负性:①>②>④>③ |
| C.第一电离能:①>④>②>③ | D.最高正化合价:①>②>④>③ |
您最近一年使用:0次
2022-01-19更新
|
437次组卷
|
7卷引用:辽宁省沈阳市市级重点高中联合体2021-2022学年高二上学期期末考试化学试题
名校
解题方法
8 . 短周期元素A、B、C、D的原子序数依次增加。X、Y、M、N为分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质。若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,N为一种常见的液体,上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中正确的是
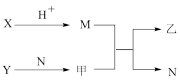

A.M、N分子的空间结构均为V形,且沸点: |
| B.X、Y中所含的化学键类型相同 |
C.四种元素的电负性大小顺序: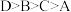 |
| D.D的最高价氧化物对应的水化物为强碱 |
您最近一年使用:0次
9 . 一种常用的分析试剂A,结构如图所示,其中X、W、Z为同一短周期元素,Y、Z形成的化合物易溶于水,其水溶液显弱酸性。下列叙述正确的是
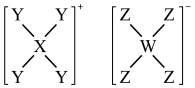
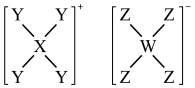
| A.W的最高价氧化物对应的水化物是三元弱酸 |
| B.1mol该化合物中有1mol配位键 |
| C.X、Z、W三种元素的电负性顺序为Z>W>X |
| D.第二周期元素中第一电离能介于X和W之间的元素有三种 |
您最近一年使用:0次
10 . 据媒体报道,某公司日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。回答下列问题:
(1)Co属于元素周期表中_______ 区元素,其基态原子的价电子排布图为_______ ,和Co同周期的元素中,基态原子具有1个未成对电子的元素有_______ 种。
(2)基态Na原子中,核外电子的空间运动状态有_______ 种,其占据的最高能级电子云轮廓图形状为_______ 。
(3)C、O、Cl的电负性由大到小的顺序为_______ (用“>”连接,下同)。用离子符号表示NaClO4中三种元素所对应的简单离子半径由大到小的顺序为_______ 。第一电离能介于B、N之间的第二周期元素有_______ 种。
(4)O的简单氢化物的沸点比下一周期同主族元素的简单氢化物沸点高,其原因是_______ 。
(5)等电子体是指价电子数和原子数相同的分子、离子或原子团。
①下列各组不互为等电子体的是_______ 。
A.PO 与ClO
与ClO B.CO
B.CO 与NO
与NO C.N2与CN-D.NO2与CS2
C.N2与CN-D.NO2与CS2
②互为等电子体的分子或离子具有相似的化学键特征,请写出CO的结构式_______ 。
(1)Co属于元素周期表中
(2)基态Na原子中,核外电子的空间运动状态有
(3)C、O、Cl的电负性由大到小的顺序为
(4)O的简单氢化物的沸点比下一周期同主族元素的简单氢化物沸点高,其原因是
(5)等电子体是指价电子数和原子数相同的分子、离子或原子团。
①下列各组不互为等电子体的是
A.PO
 与ClO
与ClO B.CO
B.CO 与NO
与NO C.N2与CN-D.NO2与CS2
C.N2与CN-D.NO2与CS2②互为等电子体的分子或离子具有相似的化学键特征,请写出CO的结构式
您最近一年使用:0次



