名校
解题方法
1 . 化学物质在材料领域有着广泛用途:黄血盐 常用作颜料、染料,
常用作颜料、染料, 属于超导材料。
属于超导材料。
(1)上述涉及的元素中属于d区元素的有_______ 。电负性最大的元素的价层电子轨道表示式为_______ 。
(2)金属的熔点:K小于Fe,理由是_______ 。
(3)可溶性氰化物(如KCN)有剧毒,但黄血盐 的毒性极低,请从结构角度解释黄血盐毒性极低的原因是
的毒性极低,请从结构角度解释黄血盐毒性极低的原因是_______ 。
(4) 晶体的晶胞结构如图所示。与S原子距离最近且等距离的Ni原子数目为
晶体的晶胞结构如图所示。与S原子距离最近且等距离的Ni原子数目为_______ ,一个晶胞的质量为_______ g。

 常用作颜料、染料,
常用作颜料、染料, 属于超导材料。
属于超导材料。(1)上述涉及的元素中属于d区元素的有
(2)金属的熔点:K小于Fe,理由是
(3)可溶性氰化物(如KCN)有剧毒,但黄血盐
 的毒性极低,请从结构角度解释黄血盐毒性极低的原因是
的毒性极低,请从结构角度解释黄血盐毒性极低的原因是(4)
 晶体的晶胞结构如图所示。与S原子距离最近且等距离的Ni原子数目为
晶体的晶胞结构如图所示。与S原子距离最近且等距离的Ni原子数目为
您最近一年使用:0次
名校
2 . 氮及其化合物在工农业生产中用途广泛。
(1)基态氮原子的外围电子轨道表示式为________________________ ;与N同周期的主族元素中,电负性大于N的有_______ 种。
(2)在高压下,氮气会聚合生成高聚氮。在高聚氮晶体中,每个氮原子都通过三个单键与其它氮原子结合并向空间发展,构成立体网状结构。已知该晶体中N—N的键能为160kJ/mol,而氮气中N≡N的键能为942kJ/mol,则1mol N2聚合生成高聚氮能量变化是_______ kJ。
(3)NaN3在强烈撞击的情况下快速分解并产生大量氮气,可用于汽车安全气囊的制造。写出一种与 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:____________ , 的空间构型为
的空间构型为_________ 。
(4)据报道美国科学家合成了一种名为“N5”的物质,具有极强的爆炸性,又称为 “盐粒炸弹”。“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是____ 个单位正电荷。
(5)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。

①分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),已知
),已知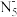 为平面结构且含有大π键,则
为平面结构且含有大π键,则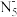 中的大π键应表示为
中的大π键应表示为____________ 。
②图中虚线代表氢键,其表示式为( )N—H···Cl、(
)N—H···Cl、( )N—H…N(
)N—H…N(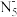 )、
)、______________ 。
(6)用干燥的液氨作用于S2Cl2的CCl4溶液中可制S4N4(结构如图),化学反应方程为:6S2Cl2+16NH3=S4N4+S8+12NH4Cl上述反应过程中,没有破坏或形成的微粒间作用力是_______ 。

a.离子键 B.配位键 C.金属键 D.氢键 E.范德华力 F.极性键 G.非极性键
(1)基态氮原子的外围电子轨道表示式为
(2)在高压下,氮气会聚合生成高聚氮。在高聚氮晶体中,每个氮原子都通过三个单键与其它氮原子结合并向空间发展,构成立体网状结构。已知该晶体中N—N的键能为160kJ/mol,而氮气中N≡N的键能为942kJ/mol,则1mol N2聚合生成高聚氮能量变化是
(3)NaN3在强烈撞击的情况下快速分解并产生大量氮气,可用于汽车安全气囊的制造。写出一种与
 互为等电子体的分子的化学式:
互为等电子体的分子的化学式: 的空间构型为
的空间构型为(4)据报道美国科学家合成了一种名为“N5”的物质,具有极强的爆炸性,又称为 “盐粒炸弹”。“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是
(5)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。

①分子中的大π键可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),已知
),已知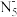 为平面结构且含有大π键,则
为平面结构且含有大π键,则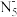 中的大π键应表示为
中的大π键应表示为②图中虚线代表氢键,其表示式为(
 )N—H···Cl、(
)N—H···Cl、( )N—H…N(
)N—H…N( )、
)、(6)用干燥的液氨作用于S2Cl2的CCl4溶液中可制S4N4(结构如图),化学反应方程为:6S2Cl2+16NH3=S4N4+S8+12NH4Cl上述反应过程中,没有破坏或形成的微粒间作用力是

a.离子键 B.配位键 C.金属键 D.氢键 E.范德华力 F.极性键 G.非极性键
您最近一年使用:0次
名校
3 . 磷及其化合物在生产、生活中具有广泛的用途,回答下列问题:
(1)白磷(结构如图1所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。
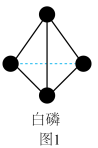
①白磷(P4)的相对分子质量为___________ 。
②基态P原子中成对电子数与未成对电子数之比为___________ 。
③电负性:P___________ (填“>”“<”或“=”)O。
(2)磷,及其部分重要化合物的相互转化如图2所示。
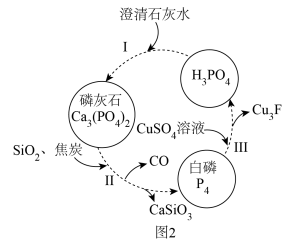
①基态钙原子的简化电子排布式为___________ 。
②第一电离能:Si___________ (填“>”“<”或“=”)C。
③CO2和CO的组成元素相同,但二者的性质不完全相同,其原因为___________ 。
④常温下,H3PO4与少量NaOH溶液反应的化学方程式为___________ 。
(3)反应Ⅲ的离子方程式为___________ (已知:Cu3P不溶于水)。
(1)白磷(结构如图1所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。

①白磷(P4)的相对分子质量为
②基态P原子中成对电子数与未成对电子数之比为
③电负性:P
(2)磷,及其部分重要化合物的相互转化如图2所示。

①基态钙原子的简化电子排布式为
②第一电离能:Si
③CO2和CO的组成元素相同,但二者的性质不完全相同,其原因为
④常温下,H3PO4与少量NaOH溶液反应的化学方程式为
(3)反应Ⅲ的离子方程式为
您最近一年使用:0次
2024-01-10更新
|
135次组卷
|
2卷引用:福建省泉州市永春第一中学2023-2024学年高二下学期开学化学试题
解题方法
4 . 钛及其化合物在生产、生活中有着广泛的用途。回答下列问题:
(1)Ti(BH4)3是一种储氢材料。BH 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为___ ;Ti、B、H元素的电负性由大到小排列顺序为_____ 。
(2)已知Ti3+易形成多种配合物,[TiCl(H2O)5]Cl2·H2O是其中的一种。
①1mol该配合物中含有_______ molσ键。
②Ti3+具有较强还原性的原因是___________ 。
(3)研究表明,TiO2通过氮掺杂反应可生成TiO2-xNy,能使TiO2对可见光具有活性,反应如图所示。
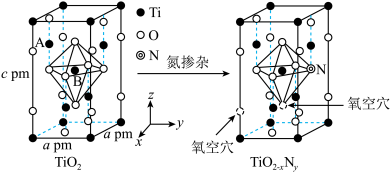
①上图TiO2晶胞中钛原子占据___________ 个氧原子围成的八面体空隙。
②已知所有的Ti-O键键长为rpm,B点原子的分数坐标为( ,
, ,
, ),则A点原子的分数坐标为(
),则A点原子的分数坐标为( ,0,
,0,___________ )。
③TiO2-xNy晶体中x=___________ 。
(1)Ti(BH4)3是一种储氢材料。BH
 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为(2)已知Ti3+易形成多种配合物,[TiCl(H2O)5]Cl2·H2O是其中的一种。
①1mol该配合物中含有
②Ti3+具有较强还原性的原因是
(3)研究表明,TiO2通过氮掺杂反应可生成TiO2-xNy,能使TiO2对可见光具有活性,反应如图所示。

①上图TiO2晶胞中钛原子占据
②已知所有的Ti-O键键长为rpm,B点原子的分数坐标为(
 ,
, ,
, ),则A点原子的分数坐标为(
),则A点原子的分数坐标为( ,0,
,0,③TiO2-xNy晶体中x=
您最近一年使用:0次
5 . 钛和锆为同族的元素,它们形成的化合物用途广泛。
(1)锆为第五周期元素,基态原子的价层电子排布式为_______ 。
(2)钛与EDTA(乙二胺四乙酸根离子,结构如图1)形成的配位离子如图2所示。
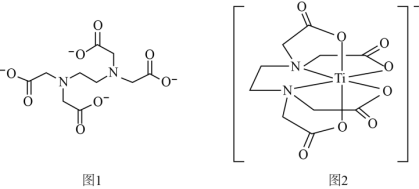
①EDTA中所含元素的电负性从大到小的顺序为_______ ;
②EDTA中键角∠NCC_______ (填“>”、“<”或“=”)∠CNC;
③钛与EDTA形成的配位离子中配位数为_______ 。
(3)常温下TiCl4为液体,ZrCl4为易升华的固体。两者熔点不同的原因是_______ 。
(4)ZrO2是制作全瓷牙的主要原料。ZrO2的晶体有立方晶相(如图3)、单斜晶相(如图4,微粒未画出,微粒分布与立方晶相相似,晶胞参数α=γ=900≠β,apm、bpm、cpm)等。
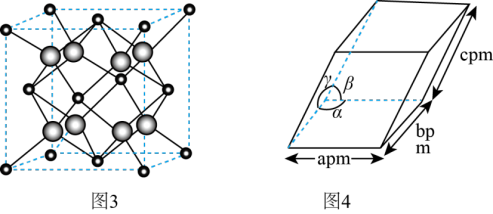
①ZrO2立方晶相中,与Zr等距离且最近的O围成的几何图形是_______ 。
②设阿伏加德罗常数的值为NA,则单斜晶相ZrO2的密度为_______ g·cm-3(列出含字母的计算表达式)。
(1)锆为第五周期元素,基态原子的价层电子排布式为
(2)钛与EDTA(乙二胺四乙酸根离子,结构如图1)形成的配位离子如图2所示。

①EDTA中所含元素的电负性从大到小的顺序为
②EDTA中键角∠NCC
③钛与EDTA形成的配位离子中配位数为
(3)常温下TiCl4为液体,ZrCl4为易升华的固体。两者熔点不同的原因是
(4)ZrO2是制作全瓷牙的主要原料。ZrO2的晶体有立方晶相(如图3)、单斜晶相(如图4,微粒未画出,微粒分布与立方晶相相似,晶胞参数α=γ=900≠β,apm、bpm、cpm)等。

①ZrO2立方晶相中,与Zr等距离且最近的O围成的几何图形是
②设阿伏加德罗常数的值为NA,则单斜晶相ZrO2的密度为
您最近一年使用:0次
名校
6 . 铜及其化合物有广泛的用途。回答下列问题:
(1)同周期元素中,与Cu最外层电子数相同的元素还有___________ 种。
(2)往 中逐滴加入氨水至沉淀恰好溶解,将该溶液冷却结晶,得到蓝色晶体。
中逐滴加入氨水至沉淀恰好溶解,将该溶液冷却结晶,得到蓝色晶体。
①该晶体中各元素电负性由大到小顺序为___________ ;
②该晶体中不存在的作用力为___________ 。
A.离子键 B.氢键 C.金属键 D.σ键 E.范德华力 F.配位键
③已知 分子中键角为107°,则上述晶体中氮氢之间的键角
分子中键角为107°,则上述晶体中氮氢之间的键角___________ 107°(填选项标号)。
A.大于 B.小于 C.等于 D.无法确定
(3)已知铜的某些化合物的熔点如表所示。三者熔点出现差异的原因是:___________ 。
(4)溴化亚铜(CuBr)常用作有机合成原料和反应催化剂,其晶胞结构如下图所示。

已知①、②号铜原子坐标分数依次为(0,0,0)、( ,
, ,0),则③号溴原子的坐标分数为
,0),则③号溴原子的坐标分数为_______ ;设CuBr的密度为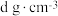 ,
, ,
, 为阿伏加德罗常数,则Cu原子与Br原子的核间距离为
为阿伏加德罗常数,则Cu原子与Br原子的核间距离为________ cm(用含a、d、 的代数式表示)。
的代数式表示)。
(1)同周期元素中,与Cu最外层电子数相同的元素还有
(2)往
 中逐滴加入氨水至沉淀恰好溶解,将该溶液冷却结晶,得到蓝色晶体。
中逐滴加入氨水至沉淀恰好溶解,将该溶液冷却结晶,得到蓝色晶体。①该晶体中各元素电负性由大到小顺序为
②该晶体中不存在的作用力为
A.离子键 B.氢键 C.金属键 D.σ键 E.范德华力 F.配位键
③已知
 分子中键角为107°,则上述晶体中氮氢之间的键角
分子中键角为107°,则上述晶体中氮氢之间的键角A.大于 B.小于 C.等于 D.无法确定
(3)已知铜的某些化合物的熔点如表所示。三者熔点出现差异的原因是:
| CuO | CuS | CuSe | |
| 熔点(℃) | 1326 | 220 | 387 |
(4)溴化亚铜(CuBr)常用作有机合成原料和反应催化剂,其晶胞结构如下图所示。

已知①、②号铜原子坐标分数依次为(0,0,0)、(
 ,
, ,0),则③号溴原子的坐标分数为
,0),则③号溴原子的坐标分数为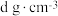 ,
, ,
, 为阿伏加德罗常数,则Cu原子与Br原子的核间距离为
为阿伏加德罗常数,则Cu原子与Br原子的核间距离为 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2022-03-05更新
|
489次组卷
|
2卷引用:福建省龙岩市2022届高三下学期第一次教学质量检测化学试题
名校
解题方法
7 . 按要求回答下列问题
(1)中国古代四大发明之一-黑火药,它的爆炸反应为:2KNO3 + 3C+S A + N2↑+ 3CO2↑(已配平)
A + N2↑+ 3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为_______ 。
②在生成物中,A的电子式_______ ,含极性共价键的分子的中心原子轨道杂化类型为_______ 。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为_______ 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为_______ ,Q2+的未成对电子数是_______ 。
(3)ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
①O、S、Se原子的第一电离能由大到小的顺序为_______ 。
②H2Se的酸性比H2S_______ (填“强”或“弱”)。气态SeO3分子的价层电子对互斥模型为_______ ,SeO 离子中Se的杂化方式为
离子中Se的杂化方式为_______ 。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______ 。
(5)已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体的配合物,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤,经洗涤干燥后称量,发现绿色晶体产生沉淀的质量为紫色晶体产生沉淀质量的三分之二。则绿色晶体的配合物为_______ 。
(1)中国古代四大发明之一-黑火药,它的爆炸反应为:2KNO3 + 3C+S
 A + N2↑+ 3CO2↑(已配平)
A + N2↑+ 3CO2↑(已配平)①除S外,上列元素的电负性从大到小依次为
②在生成物中,A的电子式
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为
(3)ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
①O、S、Se原子的第一电离能由大到小的顺序为
②H2Se的酸性比H2S
 离子中Se的杂化方式为
离子中Se的杂化方式为(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是
(5)已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体的配合物,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤,经洗涤干燥后称量,发现绿色晶体产生沉淀的质量为紫色晶体产生沉淀质量的三分之二。则绿色晶体的配合物为
您最近一年使用:0次
8 . 乙二胺四乙酸(EDTA)及其盐类能与多种金属离子发生络合反应,具有广泛用途。EDTA的分子结构如图所示。
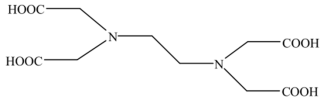
(1)EDTA所含元素电负性有小到大的顺序为_______ 。
(2)EDTA分子中碳原子采取的杂化类型为_______ 。基态氧原子核外电子有_______ 种运动状态。
(3)EDTA可以与 形成盐,
形成盐, 分子的VSEPR模型为
分子的VSEPR模型为_______ 。氨熔沸点低,铵盐熔沸点高,原因是_______ 。
(4)EDTA及其盐可与 形成稳定络合物,用于测定水的硬度,这一性质与EDTA分子中
形成稳定络合物,用于测定水的硬度,这一性质与EDTA分子中_______ 原子能够提供孤电子对有关。

(1)EDTA所含元素电负性有小到大的顺序为
(2)EDTA分子中碳原子采取的杂化类型为
(3)EDTA可以与
 形成盐,
形成盐, 分子的VSEPR模型为
分子的VSEPR模型为(4)EDTA及其盐可与
 形成稳定络合物,用于测定水的硬度,这一性质与EDTA分子中
形成稳定络合物,用于测定水的硬度,这一性质与EDTA分子中
您最近一年使用:0次
2022-09-28更新
|
478次组卷
|
4卷引用:福建省福州市三校2022-2023学年高三上学期期中联考化学试题
9 . 科学工作者合成了含镁、镍、碳3种元素的超导材料,具有良好的应用前景,回答下列问题:
(1)镍元素位于周期表第_______ 列,基态镍原子d轨道中成对电子与单电子的数量比为_______ 。
(2)在CO分子中,C与O之间形成_______ 个σ键、_______ 个π键,在这些化学键中,O原子共提供了_______ 个电子。
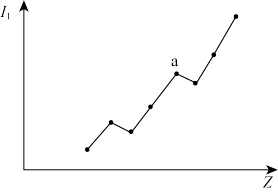
(3)第二周期元素的第一电离能(I1)随原子序数(Z)的变化情况如图。I1随Z的递增而呈增大趋势的原因是_______ 。原子核对外层电子的引力增大,导致I1在a点出现齿峰的原因是_______ 。
(4)VA族元素及其化合物在生产、生活中用途广泛。如P4S3常用于制造火柴,As4S4俗称雄黄,那么
①P、S、As电负性由大到小的顺序是_______ 。
②NH3、PH3、AsH3中沸点最高的是_______ ,其主要原因是_______ 。
(1)镍元素位于周期表第
(2)在CO分子中,C与O之间形成
(3)第二周期元素的第一电离能(I1)随原子序数(Z)的变化情况如图。I1随Z的递增而呈增大趋势的原因是
(4)VA族元素及其化合物在生产、生活中用途广泛。如P4S3常用于制造火柴,As4S4俗称雄黄,那么
①P、S、As电负性由大到小的顺序是
②NH3、PH3、AsH3中沸点最高的是

您最近一年使用:0次
2021-05-11更新
|
128次组卷
|
2卷引用:福建省泉州一中2020-2021学年高三上学期期末化学试题
名校
10 . 碳族元素的单质及其化合物是一类重要物质。请回答下列问题:
(1)锗(Ge)是用途很广的半导体材料,基态Ge原子的核外电子中,有_______ 个未成对电子。
(2) 光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是_______ 。
(3) COCl2俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为_______ ,其中碳氧原子之间共价键是_______ (填序号)。
a.2个σ键 b.2个π键 c.1个σ键,1个π键
(4) GeCl4可水解生成一种氧化物和一种无氧酸,其化学反应方程式为:_______ 。
(5) Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是_______ 。
(1)锗(Ge)是用途很广的半导体材料,基态Ge原子的核外电子中,有
(2) 光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是
(3) COCl2俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为
a.2个σ键 b.2个π键 c.1个σ键,1个π键
(4) GeCl4可水解生成一种氧化物和一种无氧酸,其化学反应方程式为:
(5) Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是
您最近一年使用:0次



