名校
解题方法
1 . 按要求回答下列问题
(1)中国古代四大发明之一-黑火药,它的爆炸反应为:2KNO3 + 3C+S A + N2↑+ 3CO2↑(已配平)
A + N2↑+ 3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为_______ 。
②在生成物中,A的电子式_______ ,含极性共价键的分子的中心原子轨道杂化类型为_______ 。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为_______ 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为_______ ,Q2+的未成对电子数是_______ 。
(3)ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
①O、S、Se原子的第一电离能由大到小的顺序为_______ 。
②H2Se的酸性比H2S_______ (填“强”或“弱”)。气态SeO3分子的价层电子对互斥模型为_______ ,SeO 离子中Se的杂化方式为
离子中Se的杂化方式为_______ 。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______ 。
(5)已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体的配合物,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤,经洗涤干燥后称量,发现绿色晶体产生沉淀的质量为紫色晶体产生沉淀质量的三分之二。则绿色晶体的配合物为_______ 。
(1)中国古代四大发明之一-黑火药,它的爆炸反应为:2KNO3 + 3C+S
 A + N2↑+ 3CO2↑(已配平)
A + N2↑+ 3CO2↑(已配平)①除S外,上列元素的电负性从大到小依次为
②在生成物中,A的电子式
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为
(3)ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
①O、S、Se原子的第一电离能由大到小的顺序为
②H2Se的酸性比H2S
 离子中Se的杂化方式为
离子中Se的杂化方式为(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是
(5)已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体的配合物,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤,经洗涤干燥后称量,发现绿色晶体产生沉淀的质量为紫色晶体产生沉淀质量的三分之二。则绿色晶体的配合物为
您最近一年使用:0次
名校
解题方法
2 . 下列说法错误的是
| A.石墨晶体中层内导电性强于层间导电性 |
| B.基态Cr3+的最高能层中成对电子与未成对电子的数目比为8∶3 |
| C.(CH3COO)2Ni·4H2O的空间构型为八面体,中心离子的配位数为6 |
| D.N元素的电负性比P元素的大,可推断NCl3分子的极性比PCl3的大 |
您最近一年使用:0次
2022-03-03更新
|
780次组卷
|
7卷引用:福建省漳平第二中学2021-2022学年高二下学期第一次月考化学试题
福建省漳平第二中学2021-2022学年高二下学期第一次月考化学试题山东省淄博市2022届高三下学期第一次模拟考试化学试题(已下线)提升卷05-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)(已下线)必刷卷03-2022年高考化学考前信息必刷卷(山东专用)湖北武汉市2022届高三5月第一次模拟考试化学试题(已下线)化学预测卷(四)-预测卷(浙江专版)江西省铜鼓中学2022-2023学年高二下学期4月月考化学试题
名校
3 . 短周期元素W、X、Y、Z的原子序数依次增大,其中基态W原子的s能级电子总数是p能级电子总数的2倍,Y与W同主族,X的最简单氢化物的水溶液呈碱性,基态Z原子的核外电子中只有一个未成对电子。下列说法错误的是
| A.电负性:Z>W>Y | B.最简单氢化物的沸点:X>W>Y |
| C.原子半径:Y>W>X | D.Z的单质具有强氧化性 |
您最近一年使用:0次
名校
解题方法
4 . 下列对有关事实的原因分析错误的是
| 事实 | 原因 | |
| A | 白磷(P4)为正四面体分子 | 白磷分子中P−P键间的夹角是109°28′ |
| B | 分子内不同化学键之间存在一定的夹角 | 共价键具有方向性 |
| C | 键的极性H−O键>H−S键 | O的电负性大于S的电负性 |
| D | 通常状况下,1体积水溶解700体积氨气 | 氨是极性分子且有氢键的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-24更新
|
1069次组卷
|
9卷引用:福建省连城县第一中学2021-2022学年高二下学期第一次月考化学试题
福建省连城县第一中学2021-2022学年高二下学期第一次月考化学试题山东省烟台市2021-2022学年高二上学期期末考试化学试题(已下线)第二章 分子结构与性质 章节过关检测-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)湖北省新高考联考协作体2021-2022学年高二3月考试化学试题山东省枣庄市第三中学2021-2022学年高二3月质量检测化学试题广东省佛山市顺德区第一中学 2021-2022学年高二下学期期中考试化学试题山东省沂南第一中学2021-2022学年高二4月月考化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)广东省深圳市盐田高级中学2022-2023学年高二下学期第一次月考化学试题
名校
解题方法
5 . 回答下列问题:
(1)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。

①组成氨基酸锌的C、N、O的电负性由大到小的顺序是___________ 。
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的是___________ 。
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为___________ 。
(2)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(II)双核配合物的内界。

①配合物中每个中心离子的配位数为___________ 。
②Co2+的最高能层电子排布式为___________ 。
③下列状态的钴中,电离最外层一个电子所需能量最大的是___________ (填标号)
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
(3)二氯甲醛的结构简式为 ,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是
,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是___________ 。
(4)碳酸亚乙酯( )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因___________ 。
(5)化学上有一种见解,认为含氧酸的通式可以写成(HO)mROn,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱___________ 。
(6)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。

该晶胞中由O2-形成的正八面体的空隙数为___________ 。
②晶胞中距离最近的两个O2-之间的距离为a pm,MnO晶体的密度为ρ g·cm-3,则阿伏加德罗常数的值为___________ (用含a和ρ的最简代数式表示)
(1)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。

①组成氨基酸锌的C、N、O的电负性由大到小的顺序是
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的是
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为
(2)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(II)双核配合物的内界。

①配合物中每个中心离子的配位数为
②Co2+的最高能层电子排布式为
③下列状态的钴中,电离最外层一个电子所需能量最大的是
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
(3)二氯甲醛的结构简式为
 ,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是
,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是(4)碳酸亚乙酯(
 )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因(5)化学上有一种见解,认为含氧酸的通式可以写成(HO)mROn,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱
(6)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。

该晶胞中由O2-形成的正八面体的空隙数为
②晶胞中距离最近的两个O2-之间的距离为a pm,MnO晶体的密度为ρ g·cm-3,则阿伏加德罗常数的值为
您最近一年使用:0次
名校
6 . 下列叙述正确的是
| A.钾原子由激发态转变为基态可获得吸收光谱 |
B.磷化铜(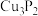 )用于制造磷青铜,电负性: )用于制造磷青铜,电负性: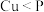 |
C.用原子轨道描述氢分子中化学键的形成: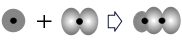 |
D.俗称光气的二氯甲醛(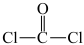 )分子中 )分子中 键角恰好为 键角恰好为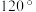 |
您最近一年使用:0次
2021-07-20更新
|
243次组卷
|
3卷引用:福建省连城县第一中学2021-2022学年高二下学期月考(二)化学试题



