名校
1 . 下列比较中,正确的是
| A.第一电离能:Na<Mg<Al | B.电负性:Cl>S>As |
| C.原子半径:O>F>Na | D.最高正化合价:F>S>N |
您最近一年使用:0次
2024-03-01更新
|
147次组卷
|
3卷引用:福建省漳州市华安县第一中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
2 . 咔唑(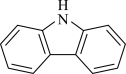 )是一种新型有机液体储氢介质。下列说法错误的是
)是一种新型有机液体储氢介质。下列说法错误的是
 )是一种新型有机液体储氢介质。下列说法错误的是
)是一种新型有机液体储氢介质。下列说法错误的是| A.电负性:N>C>H |
| B.同周期元素中第一电离能小于N的有4种 |
C.咔唑的沸点比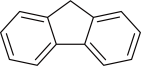 的沸点高 的沸点高 |
D.基态氮原子的外围电子轨道表示式不能写为 ,因为违背了洪特规则原理 ,因为违背了洪特规则原理 |
您最近一年使用:0次
2023-09-22更新
|
121次组卷
|
3卷引用:福建省漳州市华安县第一中学2023-2024学年高三上学期10月月考化学试题
3 . 实验室用邻二氮菲(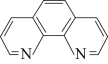 )与
)与 形成的红色配合离子(图1)测定
形成的红色配合离子(图1)测定 的浓度。回答下列问题:
的浓度。回答下列问题:

(1)Fe元素在周期表中的位置为__________ ,该配合物中心离子的配位数为__________ 。
(2)该配合离子所含元素的电负性最大的是__________ ,C原子的杂化方式为__________ 。
(3)该配合离子存在的化学键类型有__________ 。
a.离子键 b.配位键 c.极性键 d.非极性键 e.金属键 f.氢键
(4)从结构角度分析, 易被氧化成
易被氧化成 的原因是
的原因是__________ 。
(5)合成氨反应中铁催化剂表面吸附氮原子,图2为氮原子在铁的晶面上的单层附着局部示意图,图中铁原子与氮原子的个数比为__________ 。
(6)铁晶体中的原子堆积方式如图3所示, 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为 ,若晶胞密度为
,若晶胞密度为 ,则
,则
__________ (列出表达式)。
 )与
)与 形成的红色配合离子(图1)测定
形成的红色配合离子(图1)测定 的浓度。回答下列问题:
的浓度。回答下列问题:
(1)Fe元素在周期表中的位置为
(2)该配合离子所含元素的电负性最大的是
(3)该配合离子存在的化学键类型有
a.离子键 b.配位键 c.极性键 d.非极性键 e.金属键 f.氢键
(4)从结构角度分析,
 易被氧化成
易被氧化成 的原因是
的原因是(5)合成氨反应中铁催化剂表面吸附氮原子,图2为氮原子在铁的晶面上的单层附着局部示意图,图中铁原子与氮原子的个数比为
(6)铁晶体中的原子堆积方式如图3所示,
 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为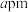 ,若晶胞密度为
,若晶胞密度为 ,则
,则
您最近一年使用:0次
名校
解题方法
4 . 据《科学》报道,中国科学家首次实现超导体(Bi2Te3/NBSe2)中分段费米面。回答下列问题:
(1)Bi与P位于同主族,基态P原子的价层电子排布式为___________ 。基态Se原子核外电子云轮廓图呈哑铃形的能级上共有___________ 个电子。
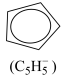
(2)二氯二茂铌的组成为(C5H5)2NbCl2.环戊二烯阴离子(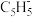 )的平面结构简式如图所示:
)的平面结构简式如图所示:
①C、H、Cl的电负性由大到小的顺序为___________ 。
②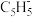 中C原子的杂化类型是
中C原子的杂化类型是___________ 。
③已知分子中的大π键可以用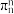 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则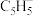 中大π键可以表示为
中大π键可以表示为___________ 。
(3)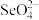 的空间构型为
的空间构型为___________ 。
(4)四氟化铌(NbF4)的熔点为72℃,它的晶体类型为___________ 。
(1)Bi与P位于同主族,基态P原子的价层电子排布式为
(2)二氯二茂铌的组成为(C5H5)2NbCl2.环戊二烯阴离子(
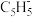 )的平面结构简式如图所示:
)的平面结构简式如图所示:
①C、H、Cl的电负性由大到小的顺序为
②
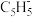 中C原子的杂化类型是
中C原子的杂化类型是③已知分子中的大π键可以用
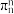 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则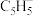 中大π键可以表示为
中大π键可以表示为(3)
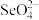 的空间构型为
的空间构型为(4)四氟化铌(NbF4)的熔点为72℃,它的晶体类型为
您最近一年使用:0次
2022-03-25更新
|
233次组卷
|
2卷引用:福建省漳州市第三中学2022-2023学年高二下学期3月质量检测化学试题
5 . 2021年5月15日,“天问一号” 火星控测器成功着陆火星。“天问一号”的着陆巡视器突破了高强度铝合金贮箱壳体材料、焊接、250N发动机硅化钼高温抗氧化涂层等多项关键技术,为“天问一号”提供了可靠、精准、稳定的动力。回答下列问题:
(1)钼与铬为同族元素,则钼位于周期表的___________ 区。
(2)铝锂合金是航天飞机低温外贮箱的壳体材料。在合金中加入钪,可大大增加合金的强度。基态钪原子的电子排布式为___________ 。
(3)氢气还原SiHCl3(Si的化合价为+4价),得到高纯硅。将高纯硅和钼高温化合制得硅化钼。SiHCl3的分子空间构型是___________ ;SiHCl3中所含元素电负性由大到小的顺序为___________ 。
(4)火星大气层的主要成分是二氧化碳,其次是氮气、氩气,此外还含有少量的氧气和水蒸气,若将这几种气体降温液化,最先液化的气体是___________ ,原因是___________ 。
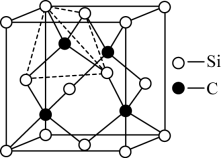
(5)文献报道,硅化钼涂层可提高碳化硅电热元件高温抗氧化性能,SiC的晶胞结构如图所示。晶体中硅原子的配位数为___________ 。图中晶胞含有硅原子数为___________ 。
(1)钼与铬为同族元素,则钼位于周期表的
(2)铝锂合金是航天飞机低温外贮箱的壳体材料。在合金中加入钪,可大大增加合金的强度。基态钪原子的电子排布式为
(3)氢气还原SiHCl3(Si的化合价为+4价),得到高纯硅。将高纯硅和钼高温化合制得硅化钼。SiHCl3的分子空间构型是
(4)火星大气层的主要成分是二氧化碳,其次是氮气、氩气,此外还含有少量的氧气和水蒸气,若将这几种气体降温液化,最先液化的气体是
(5)文献报道,硅化钼涂层可提高碳化硅电热元件高温抗氧化性能,SiC的晶胞结构如图所示。晶体中硅原子的配位数为

您最近一年使用:0次
名校
解题方法
6 . 下列说法中错误的是
| A.SO2、SO3都是极性分子 |
B.在 和[Cu(NH3)4]2+中都存在配位键 和[Cu(NH3)4]2+中都存在配位键 |
| C.元素电负性越大的原子,吸引电子的能力越强 |
| D.CO可以和很多金属形成配合物,如Ni(CO)2,Ni与CO之间的键型为配位键 |
您最近一年使用:0次
解题方法
7 . 金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。
(1)在基态Ti原子中,核外存在_____ 对自旋相反的电子,核外电子占据最高能层的符号是___ ,占据该能层电子的电子云轮廓图形状为____ 。
(2)TiCl3 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应:nCH3CH=CH2
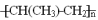 ,该反应中涉及的物质中碳原子的杂化轨道类型有
,该反应中涉及的物质中碳原子的杂化轨道类型有_______ ;反应中涉及的元素中电负性最大的是______ 。 三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是__________ 。
(3)[TiO(H2O2)2]2+配离子呈黄色。提供中心原子孤电子对的成键原子是_____ (填元素符号);配体之一H2O2分子中氧原子的价层电子对互斥模型是___ 。
(4)科学家通过X射线探明一种氮化钛的晶体与NaCl的晶体结构相似。氮化钛熔点(2950℃)比氯化钠的高,主要原因是________________ 。
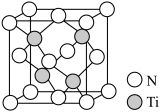
(5)有一种氮化钛晶体的晶胞如图所示,该晶体中Ti原子周围与Ti原子距离最近且相等的N原子的个数为_____ 。已知晶体的密度为ρ g·cm-3,阿伏加 德罗常数为NA,则晶胞边长为____ cm(用含ρ、NA的式子表示)。
(1)在基态Ti原子中,核外存在
(2)TiCl3 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应:nCH3CH=CH2

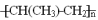 ,该反应中涉及的物质中碳原子的杂化轨道类型有
,该反应中涉及的物质中碳原子的杂化轨道类型有(3)[TiO(H2O2)2]2+配离子呈黄色。提供中心原子孤电子对的成键原子是
(4)科学家通过X射线探明一种氮化钛的晶体与NaCl的晶体结构相似。氮化钛熔点(2950℃)比氯化钠的高,主要原因是
(5)有一种氮化钛晶体的晶胞如图所示,该晶体中Ti原子周围与Ti原子距离最近且相等的N原子的个数为

您最近一年使用:0次
名校
解题方法
8 . 氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2(如图1)。
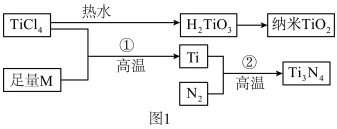
图中的M是短周期金属元素,M的部分电离能如表:
请回答下列问题:
(1)Ti的基态原子外围电子排布式为________________ 。
(2)M是________ (填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为____ 。
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。化合物甲的分子中采取sp2方式杂化的碳原子有________ 个,化合物乙中采取sp3方式杂化的原子3对应的元素的电负性由大到小的顺序为________________ 。
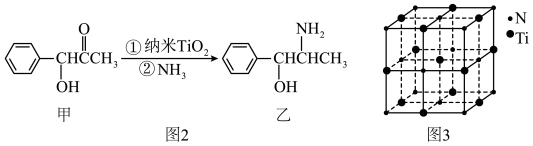
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为________________ g/cm3 (NA为阿伏加 德罗常数的值,只列计算式)。该晶体中与氮原子距离相等且最近的氮原子有________ 个。
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据:
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为__________________ 。

图中的M是短周期金属元素,M的部分电离能如表:
I1 | I2 | I3 | I4 | I5 | |
| 电离能/(kJ/mol) | 738 | 1451 | 7733 | 10540 | 13630 |
请回答下列问题:
(1)Ti的基态原子外围电子排布式为
(2)M是
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。化合物甲的分子中采取sp2方式杂化的碳原子有

(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ/mol) | 786 | 715 | 3401 |
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为
您最近一年使用:0次
2020-03-30更新
|
296次组卷
|
7卷引用:2016届福建省漳州八校高三下学期第三次联考理科综合化学试卷



