名校
1 . 下列说法错误的是
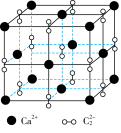
| A.CO2与SiO2的键角相等 |
| B.SiH4、CO2均是由极性键构成的非极性分子 |
| C.HCNO中元素的电负性:O>N>C>H |
| D.CaC2晶胞如图所示,Ca2+的配位数为6 |
您最近一年使用:0次
名校
解题方法
2 . 酞菁和酞菁钴可制得光动力学中的光敏剂,分子结构如图,其中酞菁分子中所有原子共平面,下列说法正确的是
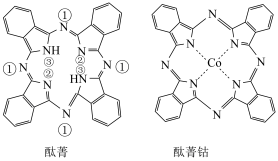
| A.酞菁钴中钴的化合价为+4 |
| B.直径为1.5×10–9 m的酞菁钴分子能透过半透膜 |
| C.酞菁钴中元素的电负性由大到小的顺序为N>C>H>Co |
| D.标注①②的N原子的杂化方式是sp2,③的N原子的杂化方式是sp3 |
您最近一年使用:0次
2024-03-13更新
|
483次组卷
|
2卷引用:福建省厦门第一中学2023-2024学年高三下学期2月第一次月考化学试卷
名校
3 . 某电池的电解液部分微观结构如图,“---”表示微粒间存在较强静电作用。M、N、W、X、Y、Z为原子序数依次增大的短周期元素。下列说法错误的是
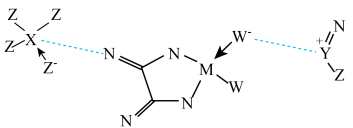
A.未成对电子数: | B.电负性: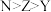 |
C.最简单氢化物的沸点: | D.熔点: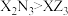 |
您最近一年使用:0次
2024-03-07更新
|
342次组卷
|
2卷引用:福建省厦门市2024届高三下学期第二次质检化学试题
名校
解题方法
4 . 2022年12月,首架国产大飞机C919正式交付,国之重器,世界瞩目。铼( )是生产飞机发动机叶片必不可少的材料。X、Y、Z、Q、W是原子序数依次增大且位于不同主族的短周期元素,其中X、Y、Z三种元素可与铼元素组成一种化合物(结构如图),该化合物与X的单质反应可得到铼。Q是地壳中含量最丰富的金属元素,Z与W形成的化合物为共价晶体。下列说法正确的是
)是生产飞机发动机叶片必不可少的材料。X、Y、Z、Q、W是原子序数依次增大且位于不同主族的短周期元素,其中X、Y、Z三种元素可与铼元素组成一种化合物(结构如图),该化合物与X的单质反应可得到铼。Q是地壳中含量最丰富的金属元素,Z与W形成的化合物为共价晶体。下列说法正确的是
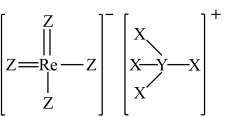
 )是生产飞机发动机叶片必不可少的材料。X、Y、Z、Q、W是原子序数依次增大且位于不同主族的短周期元素,其中X、Y、Z三种元素可与铼元素组成一种化合物(结构如图),该化合物与X的单质反应可得到铼。Q是地壳中含量最丰富的金属元素,Z与W形成的化合物为共价晶体。下列说法正确的是
)是生产飞机发动机叶片必不可少的材料。X、Y、Z、Q、W是原子序数依次增大且位于不同主族的短周期元素,其中X、Y、Z三种元素可与铼元素组成一种化合物(结构如图),该化合物与X的单质反应可得到铼。Q是地壳中含量最丰富的金属元素,Z与W形成的化合物为共价晶体。下列说法正确的是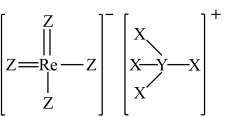
| A.电负性:Z>Y>Q>W |
| B.图中的阳离子存在三个共价键和一个配位键,四个键的性质不同 |
| C.熔点:W晶体小于W、Y形成的晶体 |
| D.Q的氧化物可以和氨水反应 |
您最近一年使用:0次
名校
解题方法
5 . 阴离子 和二脲基分子能通过一种弱相互作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法正确的是
和二脲基分子能通过一种弱相互作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法正确的是
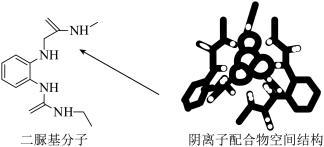
 和二脲基分子能通过一种弱相互作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法正确的是
和二脲基分子能通过一种弱相互作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法正确的是
A.所含元素电负性最大的是 |
| B.二脲基分子中所有碳原子不可能共平面 |
C. 离子与 离子与 离子的空间结构不同 离子的空间结构不同 |
D.二脲基分子中 的 的 和 和 离子的 离子的 形成氢键 形成氢键 |
您最近一年使用:0次
名校
解题方法
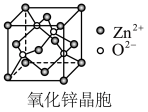
6 . 氧化锌晶体常用于液晶显示器,该晶体可用醋酸锌[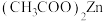 ]为原料在高温下分解制得。下列说法不正确的是
]为原料在高温下分解制得。下列说法不正确的是
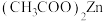 ]为原料在高温下分解制得。下列说法不正确的是
]为原料在高温下分解制得。下列说法不正确的是
A.ZnO中 的配位数为4 的配位数为4 |
| B.ZnO、ZnS均为离子晶体,ZnO的熔点低于ZnS |
C.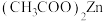 中非金属元素电负性: 中非金属元素电负性: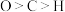 |
D.若氧化锌晶胞参数为a,则两个 的最近距离为 的最近距离为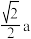 |
您最近一年使用:0次
7 . 短周期元素W、X、Y、Z原子序数依次递增,X、Z同主族,W、Y同主族。由上述元素组成的物质甲~已转化关系如图,乙、丙、丁、戊都是二元化合物,丁的焰色反应为黄色,己为淡黄色单质。下列说法错误的是
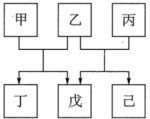

| A.只有甲的水溶液为碱性 | B.键角:丙>戊 |
| C.沸点:己>乙 | D.电负性: |
您最近一年使用:0次
8 . Ⅰ.已知A、B、C、D、E、F、G、H8种短周期元素的原子半径和某些化合价如下表所示:
(1)将D、F两种元素的元素符号填入如图所示元素周期表中的相应位置_______ 。
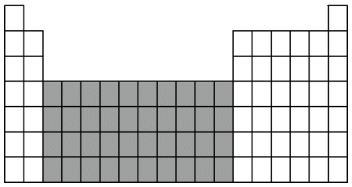
(2)上图中阴影部分所示区域的元素称为_______ 元素,下列元素属于该区域的是_______ 。
A.Ba B.Fe C.Br D.Rb
Ⅱ.现有A、B、C、D、E、F、G、H元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
(3)G2D2的电子式为_______ 。(D、G为字母代号,请将字母代号用元素符号表示,下同)。
(4)某同学推断E元素基态原子的核外电子轨道表示式为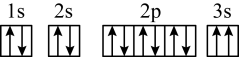 。该同学所画的电子轨道表示式违背了
。该同学所画的电子轨道表示式违背了_______ ,该元素的I3远远大于I2,其原因是_______ 。
(5)D、E、F三种元素的简单离子半径由大到小的顺序是_______ 。
(6)H位于元素周期表中_______ 区(按电子排布分区),其基态原子的价电子排布式为_______ 。与元素H位于同一周期,其原子基态时未成对电子数在同周期中最多的元素是_______ (填元素符号)。
(7)写出一种由A、B、C、D四种元素组成离子化合物_______ 。
(8)GeO2不能形成类似CO2分子中的π键,原因是_______ 。
| 元素 | A | B | C | D | E | F | G | H |
| 化合价 | -2 | +5、-3 | +4、-4 | +6、-2 | +2 | +1 | +7、-1 | +4、-4 |
| 原子半径/nm | 0.073 | 0.075 | 0 077 077 | 0.102 | 0 130 130 | 0.154 | 0 099 099 | 0.111 |

(2)上图中阴影部分所示区域的元素称为
A.Ba B.Fe C.Br D.Rb
Ⅱ.现有A、B、C、D、E、F、G、H元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素是形成化合物种类最多的元素 |
| C元素基态原子的核外p能级电子数比s能级电子数少1 |
| D元素基态原子的核外p轨道中有两个未成对电子 |
| E元素的气态基态原子的第一至第四电离能分别是I1=738kJ/mol,I2=1451kJ/mol,I3=7733kJ/mol,I4=10540kJ/mol |
| F元素的主族序数与周期数的差为4 |
| G元素是前四周期中电负性最小的元素 |
| H元素位于元素周期表中的第8列 |
(4)某同学推断E元素基态原子的核外电子轨道表示式为
 。该同学所画的电子轨道表示式违背了
。该同学所画的电子轨道表示式违背了(5)D、E、F三种元素的简单离子半径由大到小的顺序是
(6)H位于元素周期表中
(7)写出一种由A、B、C、D四种元素组成离子化合物
(8)GeO2不能形成类似CO2分子中的π键,原因是
您最近一年使用:0次
解题方法
9 . W、R、X、Y、Z为原子序数依次增大的短周期元素.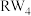 、
、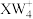 和
和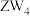 三种微粒的空间构型相同,Y原子的电子层数等于最外层电子数。以下说法错误的是
三种微粒的空间构型相同,Y原子的电子层数等于最外层电子数。以下说法错误的是
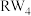 、
、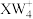 和
和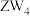 三种微粒的空间构型相同,Y原子的电子层数等于最外层电子数。以下说法错误的是
三种微粒的空间构型相同,Y原子的电子层数等于最外层电子数。以下说法错误的是A.氢化物稳定性: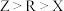 | B.最高价氧化物对应水化物酸性: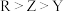 |
C.电负性: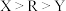 | D.原子晶体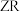 中Z的配位数为4 中Z的配位数为4 |
您最近一年使用:0次
名校
解题方法
10 . 据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。回答下列问题:
(1)Co 属于元素周期表中___________ 区元素,其基态原子的价电子排布式为___________ 。
(2)基态Na原子中,核外电子占据的原子轨道总数为___________ ,最高能层电子云轮廓图形状为___________
(3)结合题中信息判断:C、O、Cl的电负性由小到大的顺序为___________ (用元素符号表示)。
(4)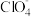 的几何构型为
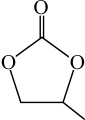
的几何构型为___________ ;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为___________ ,1mol碳酸丙烯酯中 键的数目为
键的数目为___________ 。
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是___________ ,该配离子包含的作用力为___________ (填选项字母)。
A.离子键 B.金属键 C.配位键 D.氢键 E.极性键
(1)Co 属于元素周期表中
(2)基态Na原子中,核外电子占据的原子轨道总数为
(3)结合题中信息判断:C、O、Cl的电负性由小到大的顺序为
(4)
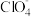 的几何构型为
的几何构型为 键的数目为
键的数目为
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是
A.离子键 B.金属键 C.配位键 D.氢键 E.极性键
您最近一年使用:0次



