名校
解题方法
1 . 运用物质结构与性质的相关知识,回答下列问题:
(1) 分子中,与
分子中,与 原子相连的
原子相连的 呈正电性
呈正电性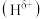 ,与
,与 原子相连的
原子相连的 呈负电性
呈负电性 电负性大小顺序是
电负性大小顺序是_______ 。基态 原子中能量最高的电子所在的原子轨道的电子云在空间上有
原子中能量最高的电子所在的原子轨道的电子云在空间上有_____ 个伸展方向,原子轨道呈______ 形。
(2) 的价层电子排布式为
的价层电子排布式为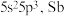 在周期表中的位置为
在周期表中的位置为________ , 价电子轨道表示式为
价电子轨道表示式为________ 。
(3) 是离子晶体,其晶格能可通过Born-Haber循环计算得到。
是离子晶体,其晶格能可通过Born-Haber循环计算得到。
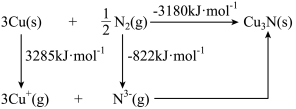
通过图中数据________ (填“能”或“不能”)计算出 原子的第一电离能,
原子的第一电离能, 的晶格能为
的晶格能为________  。
。
(4)GaAs的晶胞结构如图甲。将Mn掺杂到GaAs的晶体中得到稀磁性半导体材料(图乙)。
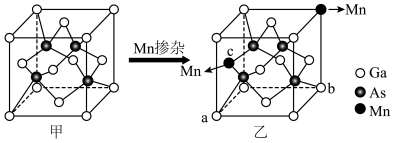
①GaAs晶胞中距离Ga原子最近As原子的个数为________ 。
②掺杂 之后,晶体中
之后,晶体中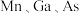 的原子个数比为
的原子个数比为________ (化为最简整数比)。
(1)
 分子中,与
分子中,与 原子相连的
原子相连的 呈正电性
呈正电性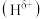 ,与
,与 原子相连的
原子相连的 呈负电性
呈负电性 电负性大小顺序是
电负性大小顺序是 原子中能量最高的电子所在的原子轨道的电子云在空间上有
原子中能量最高的电子所在的原子轨道的电子云在空间上有(2)
 的价层电子排布式为
的价层电子排布式为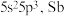 在周期表中的位置为
在周期表中的位置为 价电子轨道表示式为
价电子轨道表示式为(3)
 是离子晶体,其晶格能可通过Born-Haber循环计算得到。
是离子晶体,其晶格能可通过Born-Haber循环计算得到。
通过图中数据
 原子的第一电离能,
原子的第一电离能, 的晶格能为
的晶格能为 。
。(4)GaAs的晶胞结构如图甲。将Mn掺杂到GaAs的晶体中得到稀磁性半导体材料(图乙)。

①GaAs晶胞中距离Ga原子最近As原子的个数为
②掺杂
 之后,晶体中
之后,晶体中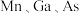 的原子个数比为
的原子个数比为
您最近一年使用:0次
名校
2 . Zn2+、三乙撑二胺和对苯二甲酸根离子可形成晶体M,其晶胞示意图如图。
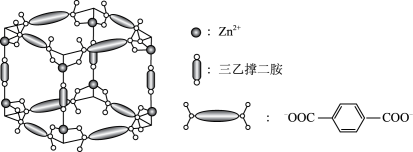
(1)Zn2+的价层电子排布式是_____ 。
(2)C、N、O的电负性从大到小 的顺序是_____ ;C、N、O的第一电离能从大到小 的顺序是_____ 。
(3)三乙撑二胺(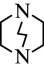 )与
)与 能形成配位键的原因是
能形成配位键的原因是_____ 。
(4)下列事实可用“水分子间存在氢键”解释的是_____ (填字母序号 )。
a.常压下,4℃时水的密度最大
b.水的沸点比硫化氢的沸点高160℃
c.水的热稳定性比硫化氢强
(5)对苯二甲酸(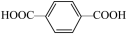 )中苯环上的碳原子的杂化方式为
)中苯环上的碳原子的杂化方式为_____ ,羧基上碳原子的杂化方式为____ ,对苯二甲酸中最多有_____ 个原子共平面。

(1)Zn2+的价层电子排布式是
(2)C、N、O的电负性
(3)三乙撑二胺(
 )与
)与 能形成配位键的原因是
能形成配位键的原因是(4)下列事实可用“水分子间存在氢键”解释的是
a.常压下,4℃时水的密度最大
b.水的沸点比硫化氢的沸点高160℃
c.水的热稳定性比硫化氢强
(5)对苯二甲酸(
 )中苯环上的碳原子的杂化方式为
)中苯环上的碳原子的杂化方式为
您最近一年使用:0次
3 . 我国科学家在寻找“点击反应”的砌块过程中,发现一种新的化合物,结构如下图所示,其中X、Y、Z和W是原子序数依次增大的短周期主族元素,Y与W是同一主族元素。下列说法正确的是
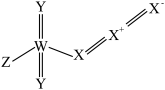

| A.元素电负性:Z>Y>W | B.简单氢化物沸点:X>Y>W |
| C.简单离子半径:Z>Y>X | D.X、W氧化物的水化物均为强酸 |
您最近一年使用:0次
名校
4 . 某种离子液体的结构如图所示,X、Y、Z、M、Q为原子序数依次增大的短周期元素,Y、Z、M为同周期相邻元素,Z的原子序数等于X、Y原子序数之和,Q为非金属性最强的元素。下列说法正确的是
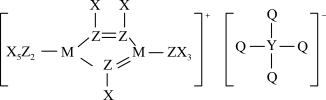
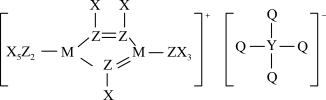
| A.基态原子未成对电子数:Y=Q |
| B.化合物M2X4中只含有极性共价键 |
| C.Q是周期表中电负性和第一电离能都最大的元素 |
| D.X与Q形成的化合物的水溶液可以保存在玻璃瓶中 |
您最近一年使用:0次
2023-04-08更新
|
467次组卷
|
3卷引用:福建省莆田第二十五中学2022-2023学年高二下学期期中考试化学试题
名校
解题方法
5 . 下列有关化学用语的表示错误的是
A.四氯化碳分子的球棍模型: |
B.次氯酸的电子式: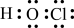 |
C.质子数、中子数分别为11、12的核素: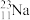 |
| D.从电负性的角度分析,CF3I水解反应的方程式为:CF3I+H2O→CF3OH+HI |
您最近一年使用:0次
6 . 下列按电负性减小顺序排列的是
| A.K、Na、Li | B.As、P、N | C.N、O、F | D.O、S、Se |
您最近一年使用:0次
7 . 下列曲线表示卤族元素某种性质随核电荷数递增的变化趋势,其中正确的是
A.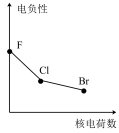 | B.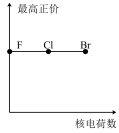 | C.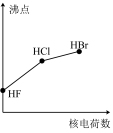 | D.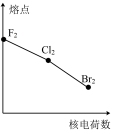 |
您最近一年使用:0次
2022-08-25更新
|
532次组卷
|
39卷引用:【全国百强校】福建省莆田第一中学2018-2019学年高二下学期期中考试化学试题
【全国百强校】福建省莆田第一中学2018-2019学年高二下学期期中考试化学试题福建省莆田第一中学2020-2021学年高二下学期期中考试化学试题2014-2015学年浙江省台州中学高二下第一次统练化学试卷2015-2016学年山西省大同一中高二下3月月考化学试卷2015-2016学年山西大学附中高二5月模块诊断化学试卷2016-2017学年山东省滨州市高二下学期第一次阶段性测试化学试卷安徽省淮北市第一中学2016-2017学年高二下学期期中考试化学试题山西省临汾第一中学等五校2017-2018学年高二上学期期末联考化学试题山西省大同市第三中学2017-2018学年高二下学期4月月考化学试题吉林省延边市第二中学2017-2018学年高二下学期第一次月考化学试题山东师范大学附属中学2017-2018学年高二下学期期中考试(理)化学试题山东省师范大学附属中学2017-2018学年高二下学期第七次学分认定考试(期中)(理)化学试题【全国百强校】山西省大同市第一中学2017-2018学年高二5月月考化学试题【全国百强校】天津市第一中学2017-2018学年高一下学期期中考试化学试题【全国校级联考】新疆昌吉市教育共同体四校2017-2018学年高二下学期期末联考化学试题宁夏回族自治区银川市长庆高级中学2018-2019学年高二下学期第二次月考化学试题新疆石河子第二中学2018-2019学年高二下学期期末考试化学试题宁夏银川一中2018-2019学年高二下学期期末考试化学试题河南省洛阳市2019-2020学年高二上学期期末考试化学试题四川省眉山市2018-2019学年高一下学期期末教学质量检测化学试题江苏省如东高级中学2019-2020学年高一下学期第二次阶段测试化学试题北京市朝阳区2020届高三5月适应性模拟化学试卷陕西省西安市西安高新第一中学2018-2019学年高二下学期期末考试化学试题人教版(2019)高一必修第一册 第四章 物质结构 元素周期律 章末综合检测卷江苏省东台创新高级中学2019-2020学年高二下学期4月份月检测化学试题山东潍坊高密一中2020-2021学年高二上学期12月化学月考试题(已下线)专题4.1.4 卤族元素(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)甘肃省张掖市第二中学 2021-2022学年高一下学期3月月考化学试题陕西省宝鸡市长岭中学2021-2022学年高二下学期期中考试化学试题专题2 原子结构与元素性质 第二单元 元素性质的递变规律 第2课时 元素第一电离能和电负性的周期性变化山东师范大学附属中学2021-2022学年高一下学期第一次月考化学试题江苏省盐城市田家炳中学2021-2022学年高二下学期期中考试化学试题浙江省浦江中学、长兴中学、余杭高中2021-2022学年高二下学期三校联考(3月)化学试题新疆伊犁州新源县2021-2022学年高二下学期期末考试化学试题安徽省 淮北师范大学附属实验中学2022-2023学年高二下学期第一次月考化学试题湖北省武汉重点中学5G联合体2022-2023学年高二下学期期中考试化学试题2.2.2元素第一电离能和电负性的周期性变化 课后北京市中关村中学2023-2024学年高三上学期开学考试化学试卷 江苏省无锡市匡园双语学校2022-2023学年高二下学期第一次月考化学试卷
解题方法
8 . 前四周期的A、B、C、D、E、F六种元素,原子序数依次增大。基态A原子核外电子的L层电子数是K层的2倍;B原子基态时的2p轨道上未成对的电子数最多;C元素为最活泼的非金属元素;D元素核外有3个电子层,最外层电子数是核外电子总数的 ;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。
(1)E元素在周期表中位置为_______ ,E3+价电子轨道表示式为_______ 。
(2)B、C、F三种元素电负性由大到小的顺序为_______ (用元素符号表示),第一电离能D_______ (填“>”、“<”或“=”)Al,其原因是_______ 。
(3)相同条件下,A、B的简单氢化物在水中溶解度较大的是_______ (填化学式),理由是_______ 。
(4)F元素可能的性质_______ (填标号)。
 ;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。(1)E元素在周期表中位置为
(2)B、C、F三种元素电负性由大到小的顺序为
(3)相同条件下,A、B的简单氢化物在水中溶解度较大的是
(4)F元素可能的性质
| A.其单质可作半导体材料 |
| B.存在-3、+3、+5等多种化合价 |
| C.最高价氧化物对应的水化物是强酸 |
| D.单质还原性弱于磷单质 |
您最近一年使用:0次
2022-04-16更新
|
298次组卷
|
3卷引用:福建省仙游县枫亭中学2021-2022学年高二下学期期中考试化学试题
名校
解题方法
9 . 根据元素性质递变规律,下列判断不正确的是
| A.酸性:H2SiO3 < H3PO4 < H2SO4 | B.电负性:F > Cl > Br > I |
| C.第一电离能:Na < Mg < Al | D.原子半径:N > O > F |
您最近一年使用:0次
2021-12-03更新
|
206次组卷
|
3卷引用:福建省莆田华侨中学2021-2022学年高二下学期期中考试化学试题
福建省莆田华侨中学2021-2022学年高二下学期期中考试化学试题浙江省绍兴市诸暨中学2021-2022学年高二上学期期中考试(平行班)化学试题(已下线)第1.2.2讲 元素周期律-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)
解题方法
10 . Al、Fe、Cu是重要的材料元素,在生产生活中有着广泛的应用。回答下列问题:
(1)Fe4[Fe(CN)6]3是较早发现的CN-配合物,其中铁元素呈现两种不同的价态。配离子的中心原子核外电子排布式为___ 。
(2)铁单质在一定条件下可与CO反应生成配位化合物——羰基铁[Fe(CO)5],沸点102.8℃,熔点-21℃,羰基铁[Fe(CO)5]属于___ 晶体。从电负性角度分析,Fe(CO)5中与Fe形成配位键的是原子___ (填名称)。
(3)已知Al的第一电离能为578 kJ/mol、第二电离能为1817 kJ/mol、第三电离能为2745 kJ/mol、第四电离能为11575 kJ/mol。请解释其第二电离能增幅较大的原因___ 。
(4)甲醇重整制氢反应中,铜基催化剂如CuO/SiO2具有重整温度低、催化选择性高的优点。Cu、Si、O元素电负性由大到小的顺序是___ ;SiO2中Si原子采取___ 杂化。
(5)金刚砂(SiC)晶胞如图所示:
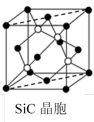
沿晶胞图中虚线方向的切面图为___ (填标号)。
a.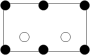 b.
b.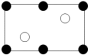
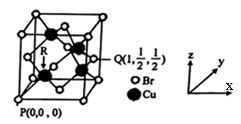
(6)一种铜的溴化物晶胞结构如图所示,该晶胞中铜的配位数是___ ,由图中P点和Q点的原子坐标参数可确定R点的原子坐标参数为___ ;已知晶胞参数为a pm,其密度为___ g/cm3。(列出计算式即可)
(1)Fe4[Fe(CN)6]3是较早发现的CN-配合物,其中铁元素呈现两种不同的价态。配离子的中心原子核外电子排布式为
(2)铁单质在一定条件下可与CO反应生成配位化合物——羰基铁[Fe(CO)5],沸点102.8℃,熔点-21℃,羰基铁[Fe(CO)5]属于
(3)已知Al的第一电离能为578 kJ/mol、第二电离能为1817 kJ/mol、第三电离能为2745 kJ/mol、第四电离能为11575 kJ/mol。请解释其第二电离能增幅较大的原因
(4)甲醇重整制氢反应中,铜基催化剂如CuO/SiO2具有重整温度低、催化选择性高的优点。Cu、Si、O元素电负性由大到小的顺序是
(5)金刚砂(SiC)晶胞如图所示:

沿晶胞图中虚线方向的切面图为
a.
 b.
b.
(6)一种铜的溴化物晶胞结构如图所示,该晶胞中铜的配位数是

您最近一年使用:0次



