名校
解题方法
1 . 下列叙述正确的是
| A.某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7 |
| B.钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能 |
| C.通过比较氯的化合价即可确定氧化性:高氯酸>次氯酸 |
| D.元素电负性大的原子第一电离能也一定大 |
您最近一年使用:0次
名校
解题方法
2 . 一种元素原子的价电子构型为2s22p5,下列有关它的描述正确的有
| A.在周期表中电负性最大 | B.在周期表中第一电离能最大 |
| C.在周期表中原子半径最小 | D.核外电子只有7种运动状态 |
您最近一年使用:0次
名校
解题方法
3 . 磷化铜(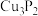 )用于制造磷青铜,磷青铜是含少量金属锡、磷的铜合金,主要用作耐磨零件和弹性原件,磷化铜与水作用产生有毒的
)用于制造磷青铜,磷青铜是含少量金属锡、磷的铜合金,主要用作耐磨零件和弹性原件,磷化铜与水作用产生有毒的 ,下列判断错误的是
,下列判断错误的是
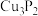 )用于制造磷青铜,磷青铜是含少量金属锡、磷的铜合金,主要用作耐磨零件和弹性原件,磷化铜与水作用产生有毒的
)用于制造磷青铜,磷青铜是含少量金属锡、磷的铜合金,主要用作耐磨零件和弹性原件,磷化铜与水作用产生有毒的 ,下列判断错误的是
,下列判断错误的是A. 中心原子的杂化方式为 中心原子的杂化方式为 |
| B.电负性:Cu<P |
C.熔沸点: > > |
D.基态Cu原子的价电子轨道表示式为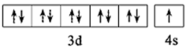 |
您最近一年使用:0次
2021-02-02更新
|
365次组卷
|
4卷引用:福建省莆田第二十五中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
4 . 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素:

(1)I的最高化合价为________ ,K的元素名称为________ 。
(2)基态时Q元素原子的电子排布式_________________________________ ,J元素原子的外围电子排布式______________________ 。
(3)下列对比正确的是________ 。
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是________ 。
a.L位于元素周期表中第5周期ⅠA族,属于s区元素
b.O位于元素周期表中第7周期ⅧB族,属于d区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
(5)由P、A、C三种元素形成的某化合物,对氢气的相对密度为15,则该分子的键角约为________ 。
(6)元素B和C的气态氢化物热稳定性较强的是________ (填化学式)。
(7)K的常见离子和B的最简单氢化物形成的配离子的名称为________ ,其水溶液颜色为________ 。Ag和元素K同族,且在K的下一周期,则Ag元素的原子序数为________ ,Ag也可以和B的最简单氢化物形成配离子,配位数为2,该配离子的符号为________ 。

(1)I的最高化合价为
(2)基态时Q元素原子的电子排布式
(3)下列对比正确的是
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是
a.L位于元素周期表中第5周期ⅠA族,属于s区元素
b.O位于元素周期表中第7周期ⅧB族,属于d区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
(5)由P、A、C三种元素形成的某化合物,对氢气的相对密度为15,则该分子的键角约为
(6)元素B和C的气态氢化物热稳定性较强的是
(7)K的常见离子和B的最简单氢化物形成的配离子的名称为
您最近一年使用:0次
5 . 已知X、Y、Z、W是短周期元素。X元素原子的2p能级处于半充满状态;Y元素原子L电子层上s电子数和p电子数相等;Z元素的+2价阳离子的核外电子排布与氖原子相同;W元素原子的M电子层有1个未成对的p电子。下列说法一定正确的是
| A.含有X元素的化合物一定是共价化合物 |
| B.Y元素的电负性大于X元素的电负性 |
| C.W元素的单质能与NaOH溶液反应放出氢气 |
| D.X元素的单质与Z元素的单质在一定条件下能发生化合反应 |
您最近一年使用:0次
2020-05-14更新
|
612次组卷
|
11卷引用:福建省仙游第一中学2022-2023学年高二下学期第一次月考化学试题
福建省仙游第一中学2022-2023学年高二下学期第一次月考化学试题人教化学选修3第一章第二节课时5第1章 原子结构——B拓展区综合拓展(鲁科版选修3)江苏省南通中学2019-2020学年高二下学期期中考试化学试题新疆昌吉回族自治州第二中学2019-2020学年高二下学期期中考试化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 C高考挑战区宁夏吴忠市吴忠中学2020-2021学年高二3月月考化学试题新疆乌鲁木齐市第八中学2021-2022学年高二下学期期中考试化学试题江苏省苏州市相城区陆慕高级中学2021-2022学年高二下学期第一次月考化学试题安徽省合肥市第一中学2022-2023学年高二下学期第一次质量检测化学试题河南省焦作市2022-2023学年第四中学高二下学期3月月考 化学试卷
名校
解题方法
6 . 砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:
(1)Ga基态原子核外电子排布式为________________ ,As基态原子核外有__________ 个未成对电子。
(2)Ga、As、Se的第一电离能由大到小的顺序是__________ ,Ga、As、Se的电负性由大到小的顺序是__________________ 。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________ ,GaF的熔点超过1000℃,可能的原因是__________________________ 。
(4)二水合草酸镓的结构如图1所示,其中镓原子的配位数为__________ ,草酸根离子中碳原子的杂化轨道类型为__________ 。
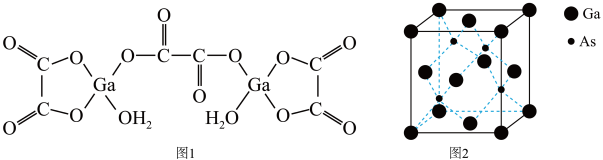
(5)砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为__________ g·cm-3(设NA为阿伏加 德罗常数的值,列出计算式即可)。
(1)Ga基态原子核外电子排布式为
(2)Ga、As、Se的第一电离能由大到小的顺序是
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:
| 镓的卤化物 | CaCl3 | CaBr3 | CaI3 |
| 熔点/℃ | 77.75 | 122.3 | 211.5 |
| 沸点/℃ | 201.2 | 279 | 346 |
(5)砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为

您最近一年使用:0次
2020-02-11更新
|
240次组卷
|
6卷引用:福建省莆田市第九中学2019届高三上学期第一次调研考试理科综合化学试题
名校
解题方法
7 . I.双氰胺结构简式如图。

(1)双氰胺的晶体类型为_____ 。
(2)双氰胺所含元素中,_____ (填元素名称)元素基态原子核外未成对电子数最多。
(3)双氰胺分子中σ键和π键数目之比为_____
II.硼的最简单氢化物——乙硼烷球棍模型如图,由它制取硼氢化锂的反应为:2LiH + B2H6 =2LiBH4

(4)乙硼烷分子中硼原子的杂化轨道类型为______ 。
(5)BH4-为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为____ (填序号)。
A 离子键 B 金属键 C 氢键 D 配位键 E 极性键 F 非极性键
(6)根据以上反应判断,其中涉及元素的电负性从小到大的顺序为____ (填元素符号)。
Ⅲ.金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。

(7)晶体铝中原子的堆积方式为_____ 。
(8)已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏伽德罗常数的值为NA,则晶体铝的密度ρ=___ g·cm-3(用含a、M、NA的代数式来表示)。

(1)双氰胺的晶体类型为
(2)双氰胺所含元素中,
(3)双氰胺分子中σ键和π键数目之比为
II.硼的最简单氢化物——乙硼烷球棍模型如图,由它制取硼氢化锂的反应为:2LiH + B2H6 =2LiBH4

(4)乙硼烷分子中硼原子的杂化轨道类型为
(5)BH4-为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为
A 离子键 B 金属键 C 氢键 D 配位键 E 极性键 F 非极性键
(6)根据以上反应判断,其中涉及元素的电负性从小到大的顺序为
Ⅲ.金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。

(7)晶体铝中原子的堆积方式为
(8)已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏伽德罗常数的值为NA,则晶体铝的密度ρ=
您最近一年使用:0次
名校
解题方法
8 . 铁触媒是重要的催化剂,铁触媒在500 ℃左右时的活性最大,这也是合成氨反应一般选择在500 ℃左右进行的重要原因之一。CO易与铁触媒作用导致其失去催化活性:Fe+5CO===Fe(CO)5;在溶液中除去CO的化学方程式为[Cu(NH3)2]OOCCH3+CO+NH3 = 刹[Cu(NH3)3(CO)]OOCCH3。请回答下列问题:
(1)基态Fe原子的核外电子排布式为[Ar]___ ;C、N、O的电负性由大到小的顺序为______ 。
(2)Cu2+在水中呈现蓝色是因为形成了四水合铜(Ⅱ)离子,其化学式为______ ;配合物[Cu(NH3)2]OOCCH3中,铜显___ 价,碳原子的杂化轨道类型是______ ,NH3价电子对互斥理论模型是______ 。
(3)用[Cu(NH3)2]OOCCH3溶液除去CO的反应中,肯定有________ (填字母)形成。
A.离子键 B.配位键 C.非极性键 D.σ键
(4)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是________ 。
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为________ ,面心立方堆积与体心立方堆积的两种铁晶体的密度之比为________ (写出已化简的比例式即可)。(两种堆积中最邻近的铁原子的核间距相等)

(1)基态Fe原子的核外电子排布式为[Ar]
(2)Cu2+在水中呈现蓝色是因为形成了四水合铜(Ⅱ)离子,其化学式为
(3)用[Cu(NH3)2]OOCCH3溶液除去CO的反应中,肯定有
A.离子键 B.配位键 C.非极性键 D.σ键
(4)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为

您最近一年使用:0次
2019-05-07更新
|
428次组卷
|
2卷引用:【校级联考】福建省莆田第一中学、第四中学2019届高三下学期一模理科综合化学试题
9 . 科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为______ 。
(2)下列关于CH4和CO2的说法正确的是______ (填序号)。
a.固态CO2属于分子晶体
b. CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的电子排布式为____________ ,Ni该元素位于元素周期表的第___ 族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有_____ molσ键。
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”。


①“可燃冰”中分子间存在的2种作用力是______ 。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是___________________________ 。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为
(2)下列关于CH4和CO2的说法正确的是
a.固态CO2属于分子晶体
b. CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的电子排布式为
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”。


①“可燃冰”中分子间存在的2种作用力是
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是
您最近一年使用:0次
2016-12-09更新
|
1727次组卷
|
3卷引用:【全国百强校】福建省莆田第一中学2017-2018学年高二下学期期中考试化学试题



