名校
解题方法
1 . A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,相关信息如下表:
请用化学用语填空:
(1)A元素在元素周期表中的位置___________ ;C元素和F元素的电负性比较,较小的是___________ (填元素符号)。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为___________ ,B元素所形成的单质分子中σ键与π键数目之比为___________ 。
(3)F元素原子的价电子的轨道表示式是___________ ;G的高价阳离子的溶液与H单质反应的离子方程式为___________ ;元素X与元素E在周期表中呈对角线关系,且元素X的最高价氧化物的水化物也具有两性,试写出X元素的最高价氧化物的水化物与D元素的最高价氧化物的水化物反应的化学方程式___________ 。
| 元素 | 元素相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为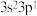 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
(1)A元素在元素周期表中的位置
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为
(3)F元素原子的价电子的轨道表示式是
您最近一年使用:0次
名校
2 . 某电池的电解液部分微观结构如图,“---”表示微粒间存在较强静电作用。M、N、W、X、Y、Z为原子序数依次增大的短周期元素。下列说法错误的是
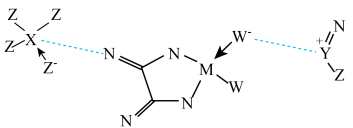
A.未成对电子数: | B.电负性: |
C.最简单氢化物的沸点: | D.熔点: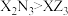 |
您最近一年使用:0次
2024-03-07更新
|
342次组卷
|
2卷引用:福建省福州第二中学2023-2024学年高二下学期4月期中考试化学试题
3 . 氮氧化物会导致光化学烟雾和酸雨,在 的催化作用下,
的催化作用下, 可将NO还原为无污染的气体,反应历程如图,下列说法正确的是
可将NO还原为无污染的气体,反应历程如图,下列说法正确的是
 的催化作用下,
的催化作用下, 可将NO还原为无污染的气体,反应历程如图,下列说法正确的是
可将NO还原为无污染的气体,反应历程如图,下列说法正确的是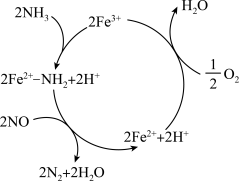
A.基态 的价层电子排布式为 的价层电子排布式为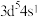 |
| B.电负性:N>O>H>Fe |
| C.该过程中存在极性键和非极性键的断裂和形成 |
D.图中的总反应可表示为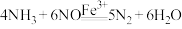 |
您最近一年使用:0次
2024-02-25更新
|
267次组卷
|
5卷引用:福建省福州第三中学2023-2024学年高三上学期第五次质量检测化学试题
名校
4 . 碳、硫、氧、氮是中学常见元素,下列说法不正确的是
A. 、 、 、 、 都是直线形分子 都是直线形分子 |
B. 、 、 、 、 的键角依次减小 的键角依次减小 |
C. 、 、 分子的中心原子都是 分子的中心原子都是 化 化 |
| D.C、N、F元素的电负性依次增大 |
您最近一年使用:0次
2023-06-08更新
|
144次组卷
|
5卷引用:福建省福州外国语学校2023-2024学年高二下学期4月期中化学试题
名校
解题方法
5 . 中国科学家首次在月球上发现新矿物,将其命名为“嫦娥石”,“嫦娥石”中包含了Fe、Cu、Ti、Cr、Ni、Mo、N、O等多种元素。
(1)鉴定月球土壤的元素组成,可采用的方法是___________ 。
A.光谱分析 B.X-射线衍射分析
(2)在第二周期中,第一电离能比N高的主族元素是___________ 。氮原子的电子排布图表示的状态中,能量由低到高的顺序是___________ (填序号)。
A.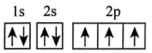 B.
B.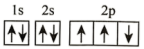
C.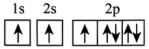 D.
D.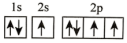
(3)已知有关氮、磷的单键和三键的键能( )如下表:
)如下表:
从能量角度看,氮以 、而白磷以
、而白磷以 (结构式可表示为
(结构式可表示为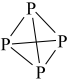 )形式存在的原因是
)形式存在的原因是___________ 。
(4)已知 分子的键角约为107°,而同主族磷的氢化物
分子的键角约为107°,而同主族磷的氢化物 分子的键角约为94°,试用价层电子对互斥模型解释
分子的键角约为94°,试用价层电子对互斥模型解释 的键角比
的键角比 的键角大的原因:
的键角大的原因:___________
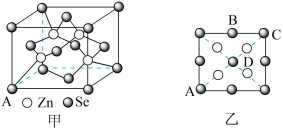
(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,已知晶胞边长为apm,乙图为甲图的俯视图,若原子坐标A为(0,0,0),B为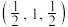 ,则D原子坐标为
,则D原子坐标为___________ ;若该晶胞密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数 为
为_________________ 。
(1)鉴定月球土壤的元素组成,可采用的方法是
A.光谱分析 B.X-射线衍射分析
(2)在第二周期中,第一电离能比N高的主族元素是
A.
 B.
B.
C.
 D.
D.
(3)已知有关氮、磷的单键和三键的键能(
 )如下表:
)如下表:| N-N |  | P-P |  |
| 193 | 946 | 197 | 489 |
从能量角度看,氮以
 、而白磷以
、而白磷以 (结构式可表示为
(结构式可表示为 )形式存在的原因是
)形式存在的原因是(4)已知
 分子的键角约为107°,而同主族磷的氢化物
分子的键角约为107°,而同主族磷的氢化物 分子的键角约为94°,试用价层电子对互斥模型解释
分子的键角约为94°,试用价层电子对互斥模型解释 的键角比
的键角比 的键角大的原因:
的键角大的原因:(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,已知晶胞边长为apm,乙图为甲图的俯视图,若原子坐标A为(0,0,0),B为
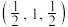 ,则D原子坐标为
,则D原子坐标为 ,则阿伏加德罗常数
,则阿伏加德罗常数 为
为
您最近一年使用:0次
名校
解题方法
6 . 立方氮化硼硬度高,耐磨性好,在机械加工行业有广泛应用。制备立方氮化硼的一种方法为 ,下列说法错误的是
,下列说法错误的是
 ,下列说法错误的是
,下列说法错误的是A. 的分子构型为三角锥型 的分子构型为三角锥型 |
B.元素电负性大小为 |
| C.反应混合物中所有化学键均为共价键 |
D.形成 时B原子先激发后杂化,其激发态价电子轨道表示式为: 时B原子先激发后杂化,其激发态价电子轨道表示式为: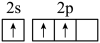 |
您最近一年使用:0次
名校
解题方法
7 . 法匹拉韦是治疗新冠肺炎的一种药物,其结构如图所示。下列说法错误的是


| A.该分子中所含元素中电负性最小的是H |
| B.该分子中C﹣F键的键能大于C﹣N键的键能 |
| C.该分子中所有C原子都为sp2杂化 |
| D.该分子中σ键与π键数目之比为7:2 |
您最近一年使用:0次
2023-01-13更新
|
582次组卷
|
5卷引用:福建省福州市连江第一中学2022-2023学年高二下学期4月期中化学试题
名校
解题方法
8 . 某锂电池材料的结构如图,M、W、X、Y、Z是原子序数依次增大的同周期主族元素,Y元素原子的价电子数是W的两倍。下列说法正确的是
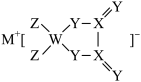
| A.简单氢化物沸点:X>Y |
| B.第一电离能:M>Z |
| C.元素X与Y原子轨道中含有的未成对电子数相同 |
| D.五种元素电负性最大的是X |
您最近一年使用:0次
2022-12-23更新
|
546次组卷
|
4卷引用:福建省福州市高级中学2023-2024学年高二下学期4月阶段训练化学试题
9 . “律动世界”国际化学元素周期表主题年活动报告中,提到了一种具有净水作用的物质,它由Q、W、X、Y、Z五种原子序数依次增大的元素组成。该五种元素的性质或结构信息如下表:
下列说法正确的是
| 元素 | 信息 |
| Q | 基态原子只有一种形状的轨道填有电子,并容易形成共价键 |
| W | 基态原子有5个原子轨道填充有电子,有2个未成对电子 |
| X | 最高价氧化物对应的水化物与Y、Z最高价氧化物对应的水化物都能反应 |
| Y | 在元素周期表中位于第3周期、第ⅥA族 |
| Z | 焰色反应为紫色 |
| A.电负性:Q<W<Y | B.第一电离能:W<X<Z |
| C.简单离子半径:X<W<Z<Y | D.这种物质只含离子键 |
您最近一年使用:0次
2022-11-02更新
|
1042次组卷
|
6卷引用:福建省福州高级中学2022-2023学年高二下学期4月期中考试化学试题
10 . 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为_______ ,最高能级电子的电子云轮廓形状为_______ 。
(2)比较下列锗卤化物的熔点和沸点,分析其变化的原因_______ 。
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是_______ 。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______ ,微粒之间存在的作用力是_______ 。
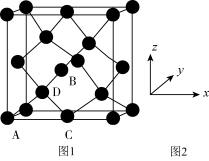
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为(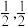 ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为_______ 。
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76pm,其密度为_______ g·cm-3(列出计算式即可)。
(1)基态Ge原子的核外电子排布式为
(2)比较下列锗卤化物的熔点和沸点,分析其变化的原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为(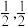 ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76pm,其密度为
您最近一年使用:0次



