1 . 有机物M由原子序数依次增大的短周期主族非金属元素W、X、Y、Z组成,基态Y原子含有2个未成对电子,Z的原子序数是Y的2倍。M的质谱图如下。下列说法正确的是
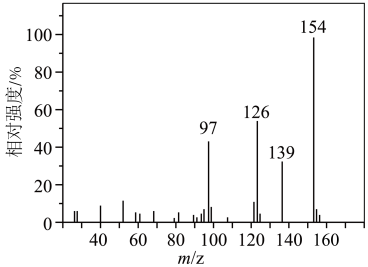
| A.原子半径:Z>Y>X>W | B.M的相对分子质量为154 |
C. : :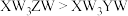 | D.X、Y、Z的最简单氢化物均为极性分子 |
您最近一年使用:0次
名校
2 . 碳、硫、氧、氮是中学常见元素,下列说法不正确的是
A. 、 、 、 、 都是直线形分子 都是直线形分子 |
B. 、 、 、 、 的键角依次减小 的键角依次减小 |
C. 、 、 分子的中心原子都是 分子的中心原子都是 化 化 |
| D.C、N、F元素的电负性依次增大 |
您最近一年使用:0次
2023-06-08更新
|
144次组卷
|
5卷引用:福建省三明市四地四校2021-2022学年高二下学期期中联考化学试题
名校
解题方法
3 . 已知 号元素的离子
号元素的离子 、
、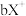 、
、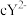 、
、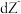 都具有相同电子层结构,下列关系正确的是
都具有相同电子层结构,下列关系正确的是
 号元素的离子
号元素的离子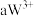 、
、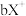 、
、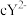 、
、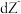 都具有相同电子层结构,下列关系正确的是
都具有相同电子层结构,下列关系正确的是A.质子数: ,离子的还原性: ,离子的还原性: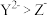 |
B.电负性: |
C.氢化物的稳定性: |
D.原子半径: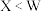 ,第一电离能: ,第一电离能: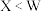 |
您最近一年使用:0次
2022-12-02更新
|
1063次组卷
|
33卷引用:福建省三明市第一中学2016-2017学年高二下学期半期考试化学试题
福建省三明市第一中学2016-2017学年高二下学期半期考试化学试题2015-2016学年贵州省思南中学高二下第一次月考化学试卷2015-2016学年山西大学附属中学高二下3月月考化学试卷2015-2016学年吉林省汪清六中高二3月月考化学试卷2015-2016学年山西大学附中高二下3月月考化学试卷2016-2017学年河北省衡水中学高二上学期五调考试化学试卷2016-2017学年河南省洛阳市第一高级中学高二(平行班)3月月考化学试卷2016-2017学年山西省大同市第一中学高二3月月考化学试卷贵州省思南中学2016-2017学年高二下学期期中考试化学试题人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质1河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题【全国百强校】甘肃省嘉峪关市酒钢三中2017-2018学年高二下学期期中考试化学试题【全国百强校】宁夏吴忠中学2017-2018学年高二6月月考化学试题2020届高三化学二轮物质结构题型专攻——元素性质的递变规律【选择提升专练】福建省厦门市思明区厦门外国语学校2019-2020学年高二上学期周末练习10——化学试题河南省林州市林虑中学2019-2020学年高二3月线上考试化学试题河北省石家庄市启明中学2019-2020学年高二四月月考化学试题吉林省白山市第七中学2019-2020学年高二下学期3月份月考化学试题鲁科版(新)必修第二册第一章检测题辽宁省六校协作体2019-2020学年高二下学期期中考试化学试卷(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 第3节 元素性质及其变化规律(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质(人教版2019)选择性必修2第一章 原子结构与性质 第二节 原子结构与元素的性质 第3课时 元素的电负性及其变化规律鲁科版2019选择性必修2第1章 原子结构与元素性质 第3节 元素性质及其变化规律 第2课时 元素的电负性及其变化规律(已下线)模块同步卷03 第一章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)专题强化练2 电离能和电负性的应用吉林省辉南县第六中学2022-2023学年高二上学期期中考试化学试题湖南省长沙市周南中学2022-2023学年高二上学期期末考试化学试题安徽省池州市第一中学2022-2023学年高二下学期第一次月考化学试题北京市第三十五中学2021-2022学年高三上学期期中考试化学试题四川省内江市资中县第二中学2023-2024学年高二下学期3月月考化学试题黑龙江省黑河市第一中学2023-2024学年高二下学期4月月考化学试题
解题方法
4 . 1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
请仔细分析,回答下列有关问题:
(1)预测周期表中电负性最大的元素应为_______ ;估计钙元素的电负性的取值范围:_______ <X<_______ 。
(2)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为_______ 。
(3)请你预测Br与I元素的X数值的大小关系:X(Br)_______ X(I)。
(4)某有机化合物分子中含有S—N键,你认为该共用电子对偏向于_______ 原子(填元素符号)。
(5)根据表中的所给数据分析: 同主族内的不同元素的X值变化的规律是_______ ;
(6)化合物NaH能与水反应产生氢气,所以可用做生氢剂,写出该反应的化学方程式:_______ 。
(7)下列表述中,不能证明氯的非金属性比硫强的是_______ 。
A.气态氢化物的稳定性:HCl>H2S
B.两元素的电负性:S<Cl
C.最高价含氧酸的酸性:HClO4>H2SO4
D.常温时,硫单质为固态,氯单质为气态
E.两者间可发生反应:Cl2+H2S=2HCl+S↓
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
(1)预测周期表中电负性最大的元素应为
(2)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为
(3)请你预测Br与I元素的X数值的大小关系:X(Br)
(4)某有机化合物分子中含有S—N键,你认为该共用电子对偏向于
(5)根据表中的所给数据分析: 同主族内的不同元素的X值变化的规律是
(6)化合物NaH能与水反应产生氢气,所以可用做生氢剂,写出该反应的化学方程式:
(7)下列表述中,不能证明氯的非金属性比硫强的是
A.气态氢化物的稳定性:HCl>H2S
B.两元素的电负性:S<Cl
C.最高价含氧酸的酸性:HClO4>H2SO4
D.常温时,硫单质为固态,氯单质为气态
E.两者间可发生反应:Cl2+H2S=2HCl+S↓
您最近一年使用:0次
5 . 双极膜电渗析法制备缩水甘油(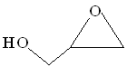 )的原理:将3-氯-1,2-丙二醇的水溶液通过膜M与双极膜之间的电渗析室,最终得到的缩水甘油纯度很高(几乎不含无机盐)。在直流电场的作用下,双极膜复合层间的
)的原理:将3-氯-1,2-丙二醇的水溶液通过膜M与双极膜之间的电渗析室,最终得到的缩水甘油纯度很高(几乎不含无机盐)。在直流电场的作用下,双极膜复合层间的 解离成
解离成 和
和 并分别通过阴膜和阳膜。下列说法正确的是
并分别通过阴膜和阳膜。下列说法正确的是
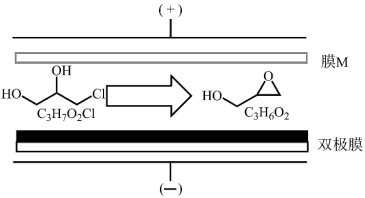
 )的原理:将3-氯-1,2-丙二醇的水溶液通过膜M与双极膜之间的电渗析室,最终得到的缩水甘油纯度很高(几乎不含无机盐)。在直流电场的作用下,双极膜复合层间的
)的原理:将3-氯-1,2-丙二醇的水溶液通过膜M与双极膜之间的电渗析室,最终得到的缩水甘油纯度很高(几乎不含无机盐)。在直流电场的作用下,双极膜复合层间的 解离成
解离成 和
和 并分别通过阴膜和阳膜。下列说法正确的是
并分别通过阴膜和阳膜。下列说法正确的是
| A.装置工作时,3-氯-1,2-丙二醇被氧化 |
| B.3-氯-1,2-丙二醇生成缩水甘油的过程中均有极性键和非极性键的断裂和生成 |
| C.上述转化物质涉及元素的第一电离能大到小排列顺序和电负性大到小排列顺序一致 |
D.装置工作时,阴极上发生的电极反应: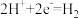 ↑ ↑ |
您最近一年使用:0次
2022-03-14更新
|
129次组卷
|
2卷引用:福建省三明第一中学2021-2022学年高二下学期第一次月考化学试题
解题方法
6 . 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。回答下列问题:
(1)镍能形成很多配合物,其中一种配合物二丁二酮肟合镍(Ⅱ)的结构如下图。
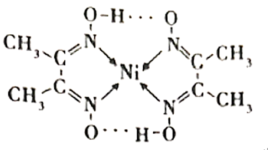
①基态Ni原子的电子排布式为___________ ,该元素在元素周期表中的位置是___________ 。
②元素C、N、O的电负性由大到小顺序为___________ 。
③二丁二酮肟合镍中存在的化学键有___________ (填标号)。
A.共价键 B.配位键 C.氢键 D.离子键 E.范德华力
④二丁二酮肟合镍中氮原子的杂化类型为___________ 。
(2)工业上采用反应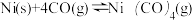 提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有
提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有___________ 个δ键。
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下。
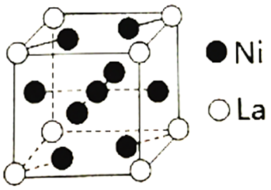
①测知镧镍合金晶胞边长为anm,则镧镍合金的晶体密度为___________ g·cm-3。
②若储氢后,氢原子占据晶胞上下底面的面心及棱的中点,则形成的储氢化合物的化学式为___________ 。
(1)镍能形成很多配合物,其中一种配合物二丁二酮肟合镍(Ⅱ)的结构如下图。

①基态Ni原子的电子排布式为
②元素C、N、O的电负性由大到小顺序为
③二丁二酮肟合镍中存在的化学键有
A.共价键 B.配位键 C.氢键 D.离子键 E.范德华力
④二丁二酮肟合镍中氮原子的杂化类型为
(2)工业上采用反应
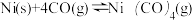 提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有
提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下。

①测知镧镍合金晶胞边长为anm,则镧镍合金的晶体密度为
②若储氢后,氢原子占据晶胞上下底面的面心及棱的中点,则形成的储氢化合物的化学式为
您最近一年使用:0次
名校
解题方法
7 . 氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的电子轨道排布式是_______ 。
(2)C、N、O三种元素第一电离能从小到大的顺序是_______ 。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是_______ 。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1;若该反应中有2 mol N-H键断裂,则形成的π键有_______ mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内存在_______ (填标号)。
a.离子键 b.共价键 c.范德华力 d.配位键
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是_______ (填标号)。
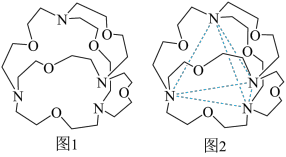
a.CF4 b.NH c.H2O d.CH4
c.H2O d.CH4
(5)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),该分子中所有原子电负性由大到小顺序是_______ 。
(1)基态氮原子的电子轨道排布式是
(2)C、N、O三种元素第一电离能从小到大的顺序是
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1;若该反应中有2 mol N-H键断裂,则形成的π键有
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内存在
a.离子键 b.共价键 c.范德华力 d.配位键
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是

a.CF4 b.NH
 c.H2O d.CH4
c.H2O d.CH4(5)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),该分子中所有原子电负性由大到小顺序是
您最近一年使用:0次
2021-05-14更新
|
126次组卷
|
2卷引用:福建省三明市三地三校2020-2021学年高二下学期期中联考化学试题
解题方法
8 . 测量司机是否酒后驾驶的反应原理为:3C2H5OH+2CrO3+3H2SO4=3CH3CHO+Cr2(SO4)3+6H2O请回答下列问题:
(1)该反应涉及元素中,基态原子核外未成对电子数最多的元素在元素周期表中的位置为___________ ,价电子排布式___________ 。
(2)对于Cr2(SO4)3的组成元素,电负性从小到大的顺序为___________ 。(用元素符号表示)
(3)HOCH2CN的结构简式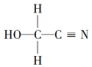 ,该分子中碳原子轨道的杂化类型分别是
,该分子中碳原子轨道的杂化类型分别是___________ 和___________ 。
(4)将CrCl3·6H2O溶解在适量水中,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在,[Cr(H2O)5Cl]2+中含有σ键的数目为___________ ;
(1)该反应涉及元素中,基态原子核外未成对电子数最多的元素在元素周期表中的位置为
(2)对于Cr2(SO4)3的组成元素,电负性从小到大的顺序为
(3)HOCH2CN的结构简式
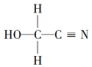 ,该分子中碳原子轨道的杂化类型分别是
,该分子中碳原子轨道的杂化类型分别是(4)将CrCl3·6H2O溶解在适量水中,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在,[Cr(H2O)5Cl]2+中含有σ键的数目为
您最近一年使用:0次
9 . 现有两种元素的基态原子的电子排布式如下:
① 1s22s22p63s23p4 ② 1s22s22p63s23p3 。则下列有关比较中正确的是
① 1s22s22p63s23p4 ② 1s22s22p63s23p3 。则下列有关比较中正确的是
| A.未成对电子数:①>② | B.原子半径大小:①>② |
| C.电负性大小:②>① | D.第一电离能大小:②>① |
您最近一年使用:0次
2021-01-29更新
|
206次组卷
|
3卷引用:福建省三明市四地四校2021-2022学年高二下学期期中联考化学试题
10 . 现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的1/6 ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)G的元素名称为____________ 。
(2)A、B、C三种元素电负性由大到小的顺序为_____________ (用元素符号表示),第一电离能D______ Al(填“>”“<”或“=”),其原因是______________________ 。
(3)E3+的离子符号为________________ 。
(4)F元素基态原子的电子排布式为________________ 。
(5)G元素可能的性质_______________ 。
A.其单质可作为半导体材料 B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸 D.其第一电离能小
(1)G的元素名称为
(2)A、B、C三种元素电负性由大到小的顺序为
(3)E3+的离子符号为
(4)F元素基态原子的电子排布式为
(5)G元素可能的性质
A.其单质可作为半导体材料 B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸 D.其第一电离能小
您最近一年使用:0次
2020-08-08更新
|
126次组卷
|
2卷引用:福建省三明第一中学2019-2020学年高二下学期期中考试化学试题



