解题方法
1 . 石灰氮( )是一种新型氮肥,与土壤中的
)是一种新型氮肥,与土壤中的 反应生成氰胺(
反应生成氰胺( ),氰胺可进一步转化为尿素[
),氰胺可进一步转化为尿素[ ]。下列说法正确的是
]。下列说法正确的是
 )是一种新型氮肥,与土壤中的
)是一种新型氮肥,与土壤中的 反应生成氰胺(
反应生成氰胺( ),氰胺可进一步转化为尿素[
),氰胺可进一步转化为尿素[ ]。下列说法正确的是
]。下列说法正确的是A. 和 和 空间构型相同,键角: 空间构型相同,键角: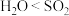 |
B. 为非极性分子 为非极性分子 |
C.中子数为20的钙原子可表示为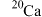 |
D. 分子中各元素的电负性大小关系为 分子中各元素的电负性大小关系为 |
您最近一年使用:0次
解题方法
2 . 如图甲,铜离子与有机物HA可形成一种螯合物 ,从而萃取水中的铜离子。
,从而萃取水中的铜离子。
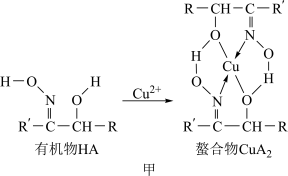
图中的R、R′均为烷烃基,该萃取反应可简单表示为2HA+Cu2+ CuA2+2H+
CuA2+2H+
回答下列问题:
(1)基态铜原子的价电子排布式为_______ 。
(2)有机物HA中,C、N、O三种元素电负性由大到小的顺序是_______ 。
(3)螯合物 中的氮原子杂化方式为
中的氮原子杂化方式为_______ ,氧原子的杂化方式为_______ 。
(4)下列关于螯合物 的说法中,正确的是
的说法中,正确的是_______ (填序号)。
① 中O的配位能力比N强
中O的配位能力比N强
②与 配位的4个原子可能呈平面构型
配位的4个原子可能呈平面构型
③ 既溶于水又溶于有机溶剂
既溶于水又溶于有机溶剂
④每个 分子中含2个氢键、2个π键
分子中含2个氢键、2个π键
(5)萃取后,铜离子进入有机相中,反萃取时,螯合物释放出铜离子,铜离子进入水相,可用于铜离子的富集及提纯,则反萃取时常加入的试剂是_______ 。
(6)金属铜与铝可形成多种不同的合金,其中一种合金的晶胞如图乙所示,晶胞参数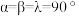 ,
, ,
,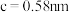 ,按图乙中阴影面进行投影得到图丙。
,按图乙中阴影面进行投影得到图丙。
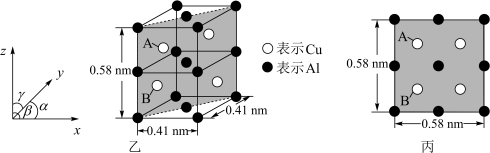
该晶体的化学式为_______ ,密度为_______  (结果保留两位有效数字)。
(结果保留两位有效数字)。
 ,从而萃取水中的铜离子。
,从而萃取水中的铜离子。
图中的R、R′均为烷烃基,该萃取反应可简单表示为2HA+Cu2+
 CuA2+2H+
CuA2+2H+回答下列问题:
(1)基态铜原子的价电子排布式为
(2)有机物HA中,C、N、O三种元素电负性由大到小的顺序是
(3)螯合物
 中的氮原子杂化方式为
中的氮原子杂化方式为(4)下列关于螯合物
 的说法中,正确的是
的说法中,正确的是①
 中O的配位能力比N强
中O的配位能力比N强②与
 配位的4个原子可能呈平面构型
配位的4个原子可能呈平面构型③
 既溶于水又溶于有机溶剂
既溶于水又溶于有机溶剂④每个
 分子中含2个氢键、2个π键
分子中含2个氢键、2个π键(5)萃取后,铜离子进入有机相中,反萃取时,螯合物释放出铜离子,铜离子进入水相,可用于铜离子的富集及提纯,则反萃取时常加入的试剂是
(6)金属铜与铝可形成多种不同的合金,其中一种合金的晶胞如图乙所示,晶胞参数
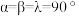 ,
, ,
,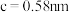 ,按图乙中阴影面进行投影得到图丙。
,按图乙中阴影面进行投影得到图丙。
该晶体的化学式为
 (结果保留两位有效数字)。
(结果保留两位有效数字)。
您最近一年使用:0次
名校
3 . 铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下。
(1)基态铝原子的核外电子排布式为___________ 。
(2)基态氮原子的价层电子排布图为___________(填编号)。
(3)化合物I中碳原子的杂化轨道类型为___________ ,化合物II中阳离子的空间构型为___________ 。
(4)化合物III中O、F、S电负性由大到小的顺序为___________ 。
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是___________ 。
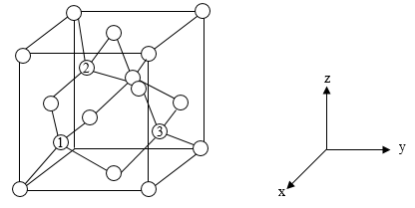
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。___________ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为( ,
, ,
, ),原子2的坐标为(
),原子2的坐标为( ,
, ,
, ),则原子3的坐标为
),则原子3的坐标为_____ 。
③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体的密度为______ g·cm-3(列出计算式)。
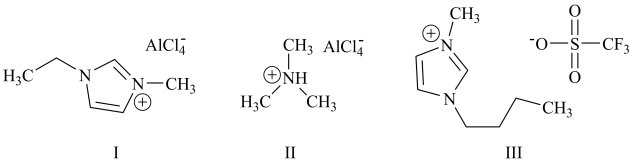
(1)基态铝原子的核外电子排布式为
(2)基态氮原子的价层电子排布图为___________(填编号)。
A.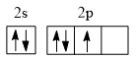 | B.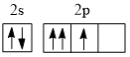 | C.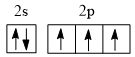 | D.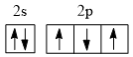 |
(4)化合物III中O、F、S电负性由大到小的顺序为
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为(
 ,
, ,
, ),原子2的坐标为(
),原子2的坐标为( ,
, ,
, ),则原子3的坐标为
),则原子3的坐标为③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体的密度为
您最近一年使用:0次
2022-03-17更新
|
2751次组卷
|
10卷引用:江西省新余市2022届高三第二次模拟考试理综化学试题
江西省新余市2022届高三第二次模拟考试理综化学试题广东省广州市2022届高三一模考试化学试题(已下线)必刷卷01-2022年高考化学考前信息必刷卷(全国乙卷)(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)吉林省长春市吉林省实验中学2022届高三最后一次模拟考试理综化学试题(已下线)广东省广州市2022届高三一模考试(结构与性质)广东省广州市2021-2022学年高三下学期一模考试化学试题2024届四川省兴文第二中学校高三上学期一诊模拟考试理综试题(已下线)热点25 物质结构与性质综合题广东省广州市第六中学2023-2024学年高二下学期期中考试化学试题
名校
4 . 乙二胺在电刷镀铜溶液中能起到稳定剂的作用。回答下列问题。
(1)基态Cu原子最高能级组电子数为___________ 个。
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:
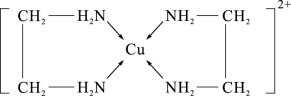
①配离子中含有的化学键类型有___________ 。
②C、N、O的第一电离能由大到小的顺序是___________ 。
③乙二胺分子中氮原子轨道的杂化类型为___________ 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是___________ 。
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的 ,此时晶体的导电性大大增强,导电性增强的原因
,此时晶体的导电性大大增强,导电性增强的原因___________ ;在氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则___________ 是Na+最可能通过途径迁移到空位处(填图中序号)。
·
(4)某镍白铜合金的立方晶胞结构如图所示。
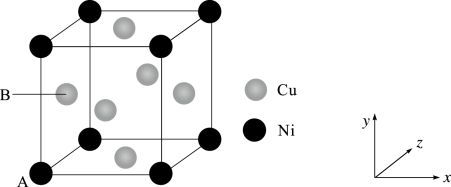
①原子A的原子坐标为(0,0,0),原子B的原子坐标为___________ 。
②若合金的密度为ρg/cm3,Ni原子之间最短距离为___________ nm(列出计算式)。
(1)基态Cu原子最高能级组电子数为
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:

①配离子中含有的化学键类型有
②C、N、O的第一电离能由大到小的顺序是
③乙二胺分子中氮原子轨道的杂化类型为
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的
 ,此时晶体的导电性大大增强,导电性增强的原因
,此时晶体的导电性大大增强,导电性增强的原因·

(4)某镍白铜合金的立方晶胞结构如图所示。

①原子A的原子坐标为(0,0,0),原子B的原子坐标为
②若合金的密度为ρg/cm3,Ni原子之间最短距离为
您最近一年使用:0次
2021-05-07更新
|
980次组卷
|
6卷引用:江西省抚州市临川第一中学2021届高考5月模拟考试理综化学试题
江西省抚州市临川第一中学2021届高考5月模拟考试理综化学试题2022届江西省赣州市高三适应性考试(二模)理综化学试题安徽省宿州市2021届高三下学期第三次模拟考试理综化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题(已下线)押山东卷第17题 物质结构与性质综合题-备战2021年高考化学临考题号押题(山东卷)2021年山东高考化学试题变式题11-20
名校
解题方法
5 . (NH4)3[Fe(SCN)6]、[Fe(TCNE)(NCCH3)2][FeCl4] 、K4[Fe(CN)6]·3H2O等铁的配合物用途非常广泛。回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______ 。
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是____ 。
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是_____ 。
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(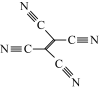 )。
)。
①CH3CN中碳原子的杂化方式是____ 和_____ 。
②TCNE中第一电离能较大的是___ (填元素符号),分子中所有原子____ (填“在”或“不在”)同一平面,分子中σ 键与π键的数目之比是 ___ 。
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:

Fe3C的密度为___ (列出计算式)g·cm-3。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(
 )。
)。①CH3CN中碳原子的杂化方式是
②TCNE中第一电离能较大的是
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:

Fe3C的密度为
您最近一年使用:0次
2020-04-06更新
|
618次组卷
|
4卷引用:江西省九江市十校2020届高三下学期模拟考试理综化学试题
江西省九江市十校2020届高三下学期模拟考试理综化学试题河南等省五岳2020届高三4月联考(全国I卷)理综化学试题河南省临颍县南街高级中学2020届高三下学期第一次月考理综化学试题(已下线)01 物质结构与性质综合题型集训(1) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
解题方法
6 . 2019年诺贝尔化学奖授予三位化学家,以表彰其对研究开发锂离子电池作出的卓越贡献。LiFePO4、聚乙二醇、LiPF6、LiAsF6和LiCl等可作锂离子聚合物电池的材料。回答下列问题:
(1)Fe的价层电子排布式为___ 。
(2)Li、F、P、As四种元素的电负性由大到小的顺序为___ 。
(3)乙二醇(HOCH2CH2OH)的相对分子质量与丙醇(CH3CH2CH2OH)相近,但沸点高出100℃,原因是___ 。
(4)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。
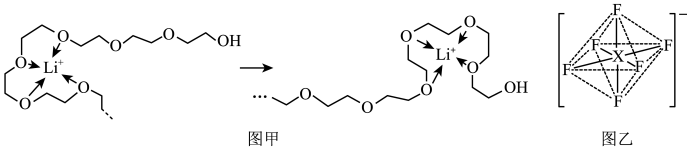
①聚乙二醇分子中,碳、氧的杂化类型分别是___ 、___ 。
②从化学键角度看,Li+迁移过程发生___ (填“物理变化”或“化学变化”)。
③PF6中P的配位数为___ 。
④相同条件,Li+在___ (填“LiPF6”或“LiAsF6”)中迁移较快,原因是___ 。
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。据此推断该晶胞中Cl原子的数目为___ 。LiCl·3H2O的摩尔质量为Mg·mol-1,设NA为阿伏加 德罗常数的值,则LiCl·3H2O晶体的密度为___ g·cm-3(列出计算表达式)。
(1)Fe的价层电子排布式为
(2)Li、F、P、As四种元素的电负性由大到小的顺序为
(3)乙二醇(HOCH2CH2OH)的相对分子质量与丙醇(CH3CH2CH2OH)相近,但沸点高出100℃,原因是
(4)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。

①聚乙二醇分子中,碳、氧的杂化类型分别是
②从化学键角度看,Li+迁移过程发生
③PF6中P的配位数为
④相同条件,Li+在
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。据此推断该晶胞中Cl原子的数目为

您最近一年使用:0次
2020-03-13更新
|
293次组卷
|
2卷引用:江西省上饶市2020届高三5月第三次模拟考试理综化学试题
名校
解题方法
7 . 图1是元素周期表的一部分,已知A、B、C、D、E、F、G都是周期表中的前四周期元素,它们在周期表中的位置如图1所示。
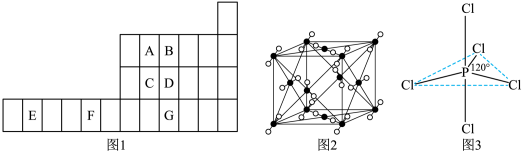
试回答下列问题:
(1)F元素基态原子的核外电子排布式为_________________ 。
(2)ABC的第一电离能由大到小的顺序______________ (用元素符号表示)。
(3)B元素单质分子中的_______ 个π键,与其互为等电子体的阴离子为____________________ 。
(4)图2为A元素某种氧化物的晶胞,其分子中心原子采用________ 杂化,每个分子周围有_____ 个分子与之距离相等且最近。若晶胞棱长为a pm,则该晶体密度的表达式为________ g·cm-3。
(5)G元素的氢化物分子的空间构型为________ ,其沸点与B元素的氢化物相比________ (填高或低),其原因是________ 。
(6)向CuSO4溶液中滴加入B 元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,请写出沉淀溶解的离子方程式________ 。
(7)知道B 的电负性大于氯,则B 与F2或Cl2形成的化合物水解,产物是否相同__________ ?(填“相同”或“不同”)。

试回答下列问题:
(1)F元素基态原子的核外电子排布式为
(2)ABC的第一电离能由大到小的顺序
(3)B元素单质分子中的
(4)图2为A元素某种氧化物的晶胞,其分子中心原子采用
(5)G元素的氢化物分子的空间构型为
(6)向CuSO4溶液中滴加入B 元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,请写出沉淀溶解的离子方程式
(7)知道B 的电负性大于氯,则B 与F2或Cl2形成的化合物水解,产物是否相同
您最近一年使用:0次
解题方法
8 . 金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。
请回答下列问题:
(1)Ti的基态原子价电子排布式为_______ 。
(2)纳米TiO2常用作下述反应的催化剂。
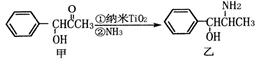
化合物甲的分子中采取sp2方式杂化的碳原子有_______ 个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为_______ 。
(3)含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2·H2O,其配离子中含有的化学键类型是_______ ,1 mol该配合物中含有的 键数目是
键数目是_______ 。
(4)通过X—射线探知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据如下:
KCl、MgO、CaO、TiN四种离子晶体熔点由高到低的顺序为_______ 。
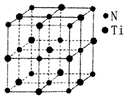
(5)某种氮化钛晶体的晶胞如图所示,该晶体中与N原子距离相等且最近的N原子有_______ 个:Ti原子的配位数为_______ ;此配位原子构成的空间构型为_______ ;该晶胞中N、Ti原子之间的最近距离为a nm。则该氮化钛晶体的密度为_______ g·cm-3、NA为阿伏伽德罗常数的值,只列计算式)。
请回答下列问题:
(1)Ti的基态原子价电子排布式为
(2)纳米TiO2常用作下述反应的催化剂。

化合物甲的分子中采取sp2方式杂化的碳原子有
(3)含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2·H2O,其配离子中含有的化学键类型是
 键数目是
键数目是(4)通过X—射线探知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据如下:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
(5)某种氮化钛晶体的晶胞如图所示,该晶体中与N原子距离相等且最近的N原子有

您最近一年使用:0次
2017-04-13更新
|
293次组卷
|
2卷引用:2017届江西省南昌市十所省重点中学命制高三第二次模拟突破冲刺(一)理综化学试卷



