名校
1 . 利用平衡移动原理,分析一定温度下 在不同pH的
在不同pH的 (起始浓度为
(起始浓度为 )体系中的可能产物。
)体系中的可能产物。
已知:
ⅰ.图1中曲线表示 体系中各含碳粒子的物质的量分数与pH的关系。
体系中各含碳粒子的物质的量分数与pH的关系。
ⅱ.图2表示不同pH下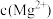 的变化。
的变化。
 在不同pH的
在不同pH的 (起始浓度为
(起始浓度为 )体系中的可能产物。
)体系中的可能产物。已知:
ⅰ.图1中曲线表示
 体系中各含碳粒子的物质的量分数与pH的关系。
体系中各含碳粒子的物质的量分数与pH的关系。ⅱ.图2表示不同pH下
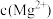 的变化。
的变化。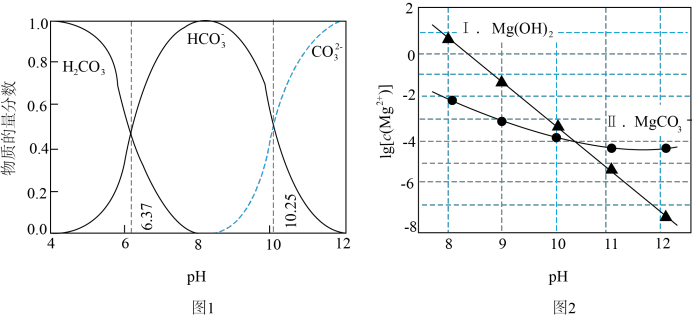
A.由图1,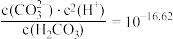 |
B.在 时,一定存在 时,一定存在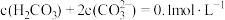 |
C.由图2,初始状态 、 、 ,无沉淀生成 ,无沉淀生成 |
D.由图1和图2,初始状态 、 、 ,主要发生反应: ,主要发生反应: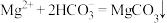  |
您最近一年使用:0次
7日内更新
|
105次组卷
|
2卷引用:2024届江西省部分学校高三下学期5月第一次适应性考试大联考化学试题
名校
2 . 氢化铝钠( )等复合氢化物是重要的有机还原剂。
)等复合氢化物是重要的有机还原剂。 晶胞结构如图所示,设阿伏加德罗常数的值为
晶胞结构如图所示,设阿伏加德罗常数的值为 ,下列说法正确的是
,下列说法正确的是
 )等复合氢化物是重要的有机还原剂。
)等复合氢化物是重要的有机还原剂。 晶胞结构如图所示,设阿伏加德罗常数的值为
晶胞结构如图所示,设阿伏加德罗常数的值为 ,下列说法正确的是
,下列说法正确的是
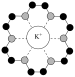
A. 晶体中,与Na+紧邻且等距的 晶体中,与Na+紧邻且等距的 有6个 有6个 |
B.晶体的密度为 |
C. 与 与 之间的最短距离为 之间的最短距离为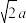 nm nm |
D. 中4个共价键不同 中4个共价键不同 |
您最近一年使用:0次
3 . 宏观辨识与微观探析是化学学科核心素养之一,下列反应方程式书写错误的是
A.久置于空气中的 溶液变质: 溶液变质: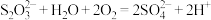 |
B.用醋酸和碘化钾淀粉溶液检验加碘盐中的 : : |
C.向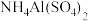 溶液中加入等物质的量的 溶液中加入等物质的量的 溶液: 溶液: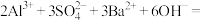 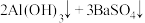 |
D.用饱和碳酸钠溶液处理锅炉水垢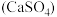 : : |
您最近一年使用:0次
名校
解题方法
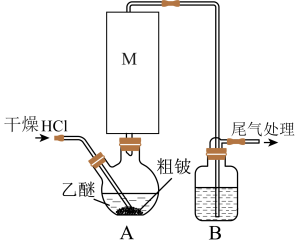
4 . 某实验小组以粗铍(含少量的Mg、Fe、Al、Cu、Si等)为原料制备、提纯BeCl2,并测定产品中BeCl2的含量。利用如图所示装置(夹持装置略)制BeCl2,实验开始前先通入一段时间的氩气。
②BeCl2溶于乙醚,不溶于苯,易发生水解;
③AlCl3溶于乙醚且溶于苯,FeCl2、MgCl2不溶于乙醚和苯;
④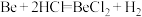 为放热反应。
为放热反应。
请回答下列问题:
(1)装置A中方框内的仪器M应为________ (填“直形冷凝管”或“球形冷凝管”),实验中装置A需置于温度15℃左右的水浴中,其主要目的是________ 。
(2)装置B中盛放的试剂为________ 。
(3)反应后,装置A中BeCl2的乙醚溶液先经过滤除去杂质________ ,再蒸馏滤液将乙醚蒸出得“固体”。为了除去“固体”中的其余杂质,可采取的操作为________ 。
(4)取 g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用
g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用 mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸
mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸 mL(已知:
mL(已知: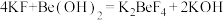 ;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为
;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为________ %(用含 、
、 和
和 的字母表示)。
的字母表示)。
(5)氯化铍在气态时存在BeCl2分子(a)和二聚分子[(BeCl2)2](b),固态时则具有如下图所示的链状结构(c)。____ 。
②BeCl2溶于乙醚,不溶于苯,易发生水解;
③AlCl3溶于乙醚且溶于苯,FeCl2、MgCl2不溶于乙醚和苯;
④
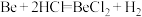 为放热反应。
为放热反应。请回答下列问题:
(1)装置A中方框内的仪器M应为
(2)装置B中盛放的试剂为
(3)反应后,装置A中BeCl2的乙醚溶液先经过滤除去杂质
(4)取
 g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用
g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用 mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸
mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸 mL(已知:
mL(已知: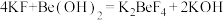 ;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为
;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为 、
、 和
和 的字母表示)。
的字母表示)。(5)氯化铍在气态时存在BeCl2分子(a)和二聚分子[(BeCl2)2](b),固态时则具有如下图所示的链状结构(c)。
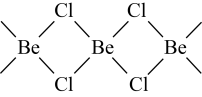
您最近一年使用:0次
解题方法
5 . 二甘氨酸合锌是常用的补锌药品,化学式为 ,针状白色晶体,可溶于水。制备过程如下:
,针状白色晶体,可溶于水。制备过程如下:
I.称取3.00 g 固体溶于25 mL水,滴加氨水产生大量白色沉淀,过滤,洗涤。
固体溶于25 mL水,滴加氨水产生大量白色沉淀,过滤,洗涤。
II.称取1.50 g甘氨酸,溶于40 mL水形成甘氨酸溶液,搅拌下用甘氨酸溶液溶解I中的白色沉淀。
III.过滤,转移液体于烧杯中。经一系列操作后,过滤、洗涤、干燥,得到针状白色晶体1.92 g。
请回答下列问题:
(1)①步骤I中所使用的玻璃仪器除烧杯、量筒外,还有___________ 。
②步骤I中若氨水过量较多、浓度较大,产率会明显降低,原因是___________ 。
③步骤I中洗涤除去的离子是___________ 。
(2)步骤II中发生的化学方程式为___________ 。
(3)步骤III中“一系列操作”是指___________ 、___________ 。
(4)产率为___________ 。
(5)直接法制备二甘氨酸合锌的方法是:用硫酸锌与甘氨酸直接反应,经实验步骤III得到晶体。本实验方法与直接法相比较,优点与缺点分别为___________ 、___________ 。
 ,针状白色晶体,可溶于水。制备过程如下:
,针状白色晶体,可溶于水。制备过程如下:I.称取3.00 g
 固体溶于25 mL水,滴加氨水产生大量白色沉淀,过滤,洗涤。
固体溶于25 mL水,滴加氨水产生大量白色沉淀,过滤,洗涤。II.称取1.50 g甘氨酸,溶于40 mL水形成甘氨酸溶液,搅拌下用甘氨酸溶液溶解I中的白色沉淀。
III.过滤,转移液体于烧杯中。经一系列操作后,过滤、洗涤、干燥,得到针状白色晶体1.92 g。
请回答下列问题:
(1)①步骤I中所使用的玻璃仪器除烧杯、量筒外,还有
②步骤I中若氨水过量较多、浓度较大,产率会明显降低,原因是
③步骤I中洗涤除去的离子是
(2)步骤II中发生的化学方程式为
(3)步骤III中“一系列操作”是指
(4)产率为
(5)直接法制备二甘氨酸合锌的方法是:用硫酸锌与甘氨酸直接反应,经实验步骤III得到晶体。本实验方法与直接法相比较,优点与缺点分别为
您最近一年使用:0次
名校
解题方法
6 . 物质的结构决定其性质,下列实例与解释不 相符的是
| 选项 | 实例 | 解释 |
| A | 邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点 | 分子间氢键使熔沸点升高,分子内氢键使熔沸点降低 |
| B |  与 与 形成配合物 形成配合物 |  中的 中的 有空轨道,可接受 有空轨道,可接受 中 中 的孤电子对 的孤电子对 |
| C |  的沸点高于 的沸点高于 |  原子半径小, 原子半径小, 键能大 键能大 |
| D | 超分子冠醚(18-冠-6)如图所示,其空穴与 尺寸适配 尺寸适配
| 两者能通过弱相互作用(非化学键)形成超分子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . NA为阿伏加德罗常数的值,下列说法正确的是
| A.常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA |
B.含0.5molCr2O 的酸性溶液与足量H2O2反应生成 的酸性溶液与足量H2O2反应生成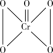 ,转移电子数4NA ,转移电子数4NA |
| C.1molXeF4中氙的价层电子对数为4NA |
| D.标准状况下,22.4LCH4和44.8LCl2在光照下充分反应后的分子数为3NA |
您最近一年使用:0次
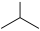
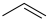
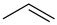
8 . 异丁烯(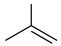 )是重要的化工生产原料,可由异丁烷(
)是重要的化工生产原料,可由异丁烷(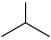 )催化脱氢制备,反应如下:
)催化脱氢制备,反应如下:
主反应:
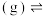

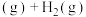
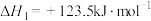
副反应:
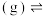
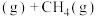

 纯物质的热效应被称为该物质的摩尔生成焓。上述物质的摩尔生成焓如下表:
纯物质的热效应被称为该物质的摩尔生成焓。上述物质的摩尔生成焓如下表:| 气态物质 |
|
| C2H4 | CH4 |
摩尔生成焓 | -134.5 | 20.4 | 52.3 | -74.8 |
(1)


(2)有利于提高异丁烷平衡转化率的条件是
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)其他条件相同,在恒压
 密闭容器中充入异丁烷和
密闭容器中充入异丁烷和 各
各 (
( 作惰性气体),经过相同时间测得相关数据如图1和图2所示。[
作惰性气体),经过相同时间测得相关数据如图1和图2所示。[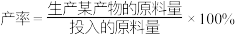 空速(GHSV)表示单位时间通过单位体积催化剂的气体量](不考虑温度对催化剂活性的影响,异丁烷分子在催化剂表面能较快吸附)
空速(GHSV)表示单位时间通过单位体积催化剂的气体量](不考虑温度对催化剂活性的影响,异丁烷分子在催化剂表面能较快吸附)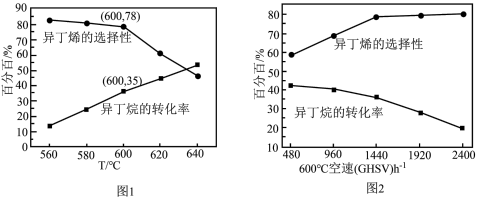
 时异丁烯产率为
时异丁烯产率为②下列说法错误的是
A.由图1可知,温度越高,异丁烷的转化率越大,丙烯的产率越小
B.混入
 的目的之一是减小异丁烷的吸附速率,同时带走催化剂局部多余的热量,从而抑制催化剂的积碳
的目的之一是减小异丁烷的吸附速率,同时带走催化剂局部多余的热量,从而抑制催化剂的积碳C.图2中,空速增加,异丁烷转化率降低的原因可能是原料气在催化剂中停留时间过短
D.图2中,空速增加,异丁烯选择性升高的原因可能是原料气将产物迅速带走,抑制了副反应的发生
③图1中,随着温度升高,异丁烷转化率升高而异丁烯选择性下降的原因可能是
④温度为
 ,反应
,反应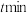 后达到平衡,此时异丁烷的转化率为
后达到平衡,此时异丁烷的转化率为 ,异丁烯的选择性为
,异丁烯的选择性为 ,
, 内,
内, 的分压平均变化率为
的分压平均变化率为 ;该条件下,主反应的平衡常数
;该条件下,主反应的平衡常数
 。
。
您最近一年使用:0次
2024-05-30更新
|
163次组卷
|
3卷引用:江西部分高中2024届高三下学期5月大联考化学试卷
解题方法
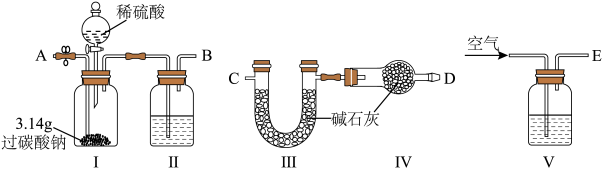
9 .  (过碳酸钠)是一种集洗涤、漂白、杀菌于一体的氧化系漂白剂,是碳酸钠和过氧化氢形成的不稳定加合物,易溶于水,难溶于乙醇。制备相关资料如下。
(过碳酸钠)是一种集洗涤、漂白、杀菌于一体的氧化系漂白剂,是碳酸钠和过氧化氢形成的不稳定加合物,易溶于水,难溶于乙醇。制备相关资料如下。
制备装置:如图所示。
i.按图组装仪器,控制实验温度不超过15℃;
ii.往A中加入25mL的过氧化氢(质量分数为30%)、硫酸镁和硅酸钠各0.1g,控温搅拌至所有试剂完全溶解;
iii.冷却至一定温度,加入100mL饱和碳酸钠溶液,搅拌反应30min,静置结晶;
iv.利用真空泵抽滤,滤饼用无水乙醇洗涤2~3次,通风橱风干得到产品过碳酸钠,滤液回收利用。
回答下列问题:
(1)仪器A的名称为___________ 。
(2)制备过程中,为了避免温度升高,导致产率下降,“加入100mL饱和碳酸钠溶液”的正确方法是___________ 。
(3)步骤iv用无水乙醇洗涤的原因是___________ 。
(4)下列有关过碳酸钠说法错误的是___________。
(5)采用下列装置验证过碳酸钠中碳酸钠和过氧化氢的物质的量之比是2∶3(不考虑过碳酸钠含有杂质)。 中的试剂为
中的试剂为___________ 。
②装置接口的连接顺序为___________ (用ABCDE字母表示)。
③若实验操作准确,则装置 理论上应增重
理论上应增重___________ g。
 (过碳酸钠)是一种集洗涤、漂白、杀菌于一体的氧化系漂白剂,是碳酸钠和过氧化氢形成的不稳定加合物,易溶于水,难溶于乙醇。制备相关资料如下。
(过碳酸钠)是一种集洗涤、漂白、杀菌于一体的氧化系漂白剂,是碳酸钠和过氧化氢形成的不稳定加合物,易溶于水,难溶于乙醇。制备相关资料如下。制备装置:如图所示。
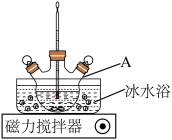
i.按图组装仪器,控制实验温度不超过15℃;
ii.往A中加入25mL的过氧化氢(质量分数为30%)、硫酸镁和硅酸钠各0.1g,控温搅拌至所有试剂完全溶解;
iii.冷却至一定温度,加入100mL饱和碳酸钠溶液,搅拌反应30min,静置结晶;
iv.利用真空泵抽滤,滤饼用无水乙醇洗涤2~3次,通风橱风干得到产品过碳酸钠,滤液回收利用。
回答下列问题:
(1)仪器A的名称为
(2)制备过程中,为了避免温度升高,导致产率下降,“加入100mL饱和碳酸钠溶液”的正确方法是
(3)步骤iv用无水乙醇洗涤的原因是
(4)下列有关过碳酸钠说法错误的是___________。
| A.过碳酸钠是一种混合物 |
| B.过碳酸钠既具有碳酸钠的性质,又具有双氧水性质 |
| C.往酸性高锰酸钾溶液中加入足量过碳酸钠,溶液褪成无色 |
| D.过碳酸钠既可用作绿色漂白剂也可用作鱼塘供氧剂 |
(5)采用下列装置验证过碳酸钠中碳酸钠和过氧化氢的物质的量之比是2∶3(不考虑过碳酸钠含有杂质)。
 中的试剂为
中的试剂为②装置接口的连接顺序为
③若实验操作准确,则装置
 理论上应增重
理论上应增重
您最近一年使用:0次
名校
解题方法
10 . 2024年上海国际碳中和技术博览会以“中和科技、碳素未来”为主题,重点聚焦二氧化碳的捕捉、利用与封存(CCUS)等问题。回答下列问题:
Ⅰ. 是典型的温室气体,Sabatier反应可实现
是典型的温室气体,Sabatier反应可实现 转化为甲烷,实现
转化为甲烷,实现 的资源化利用。合成
的资源化利用。合成 过程中涉及如下反应:
过程中涉及如下反应:
甲烷化反应(主反应):①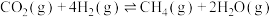

逆变换反应(副反应):②

(1)反应③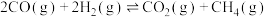

___________ ,该反应在___________ (填“高温”“低温”或“任何温度”)下能自发进行。
(2)下列叙述中能说明反应①达到平衡状态的是___________ (填字母)。
A.断裂4mol 的同时断裂1mol
的同时断裂1mol 
B.恒温恒容条件下,体系压强不再变化
C.恒温恒容条件下,气体的密度不再变化
D.
E.绝热恒容条件下, 不再变化
不再变化
(3)科研小组按 进行投料,下面探究影响
进行投料,下面探究影响 选择性的一些因素。
选择性的一些因素。
①若在恒容容器中进行反应(初始压强为0.1MPa),平衡时各气体的物质的量分数随温度变化的曲线如图所示。图中表示 的物质的量分数随温度变化的曲线是
的物质的量分数随温度变化的曲线是___________ (填“曲线1”“曲线2”或“曲线3”)。曲线1和曲线3交叉点处 的平衡分压为
的平衡分压为___________ MPa(该空忽略副反应逆变换反应)。
反应a:

反应b: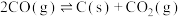

反应c: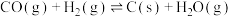

由表中数据可知,积碳反应主要由反应___________ 引起(填“a”“b”或“c”)。
Ⅱ.完成下列问题
(4)一定条件下,向4L恒容密闭容器中充入2mol 和6mol
和6mol  ,发生反应
,发生反应 。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
___________ 。(该反应标准平衡常数的表达式为 ,其中p为分压,分压=总压×物质的量分数,
,其中p为分压,分压=总压×物质的量分数,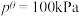 )
)
Ⅰ.
 是典型的温室气体,Sabatier反应可实现
是典型的温室气体,Sabatier反应可实现 转化为甲烷,实现
转化为甲烷,实现 的资源化利用。合成
的资源化利用。合成 过程中涉及如下反应:
过程中涉及如下反应:甲烷化反应(主反应):①
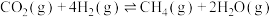

逆变换反应(副反应):②


(1)反应③
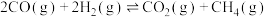

(2)下列叙述中能说明反应①达到平衡状态的是
A.断裂4mol
 的同时断裂1mol
的同时断裂1mol 
B.恒温恒容条件下,体系压强不再变化
C.恒温恒容条件下,气体的密度不再变化
D.

E.绝热恒容条件下,
 不再变化
不再变化(3)科研小组按
 进行投料,下面探究影响
进行投料,下面探究影响 选择性的一些因素。
选择性的一些因素。①若在恒容容器中进行反应(初始压强为0.1MPa),平衡时各气体的物质的量分数随温度变化的曲线如图所示。图中表示
 的物质的量分数随温度变化的曲线是
的物质的量分数随温度变化的曲线是 的平衡分压为
的平衡分压为
| 温度℃ |  |  |  |
| 800 | 21.60 | 0.136 | 0.133 |
| 850 | 33.94 | 0.058 | 0.067 |
| 900 | 51.38 | 0.027 | 0.036 |


反应b:
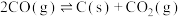

反应c:
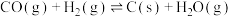

由表中数据可知,积碳反应主要由反应
Ⅱ.完成下列问题
(4)一定条件下,向4L恒容密闭容器中充入2mol
 和6mol
和6mol  ,发生反应
,发生反应 。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
 ,其中p为分压,分压=总压×物质的量分数,
,其中p为分压,分压=总压×物质的量分数,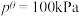 )
)
您最近一年使用:0次
2024-05-27更新
|
214次组卷
|
3卷引用:2024届南昌市第十九中学高三下学期模拟预测化学试题