名校
1 . 三氯甲硅烷((SiHCl₃)是制取高纯硅的重要原料,常温下为无色液体,沸点为31.8℃,熔点为-126.5℃,易水解。实验室根据反应 ,利用如下装置制备
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:

(1)制备 时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入HCl,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为
时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入HCl,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为______ ;判断制备反应结束的实验现象是______ 。图示装置存在的两处缺陷,请提出相应改进建议______ 。
(2)已知电负性Cl>H>Si, 在浓NaOH溶液中发生反应的化学方程式为
在浓NaOH溶液中发生反应的化学方程式为______ 。
(3)采用如下方法测定溶有少量HCl的 纯度。
纯度。
 g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①______ ,②______ (填操作名称),③称量等操作,测得所得固体氧化物质量为 g,从下列仪器中选出①、②中需使用的仪器,依次为
g,从下列仪器中选出①、②中需使用的仪器,依次为______ (填标号)。测得样品纯度为______ (用含 、
、 的代数式表示)。
的代数式表示)。

 ,利用如下装置制备
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:
(1)制备
 时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入HCl,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为
时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入HCl,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为(2)已知电负性Cl>H>Si,
 在浓NaOH溶液中发生反应的化学方程式为
在浓NaOH溶液中发生反应的化学方程式为(3)采用如下方法测定溶有少量HCl的
 纯度。
纯度。 g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:① g,从下列仪器中选出①、②中需使用的仪器,依次为
g,从下列仪器中选出①、②中需使用的仪器,依次为 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
2 . 铜及其化合物具有广泛的应用。请回答:
(1)Cu元素位于周期表___________ 区。
(2)下列说法不正确 的是___________。
(3)高温下固体中 比
比 稳定,常温下水溶液中
稳定,常温下水溶液中 离子比
离子比 离子稳定(水溶液中
离子稳定(水溶液中 易发生歧化反应生成
易发生歧化反应生成 ),原因是
),原因是___________ 。(已知:金属阳离子在水溶液中易与水分子发生络合形成水合离子,对应的热效应称为水合能, 的水合能为
的水合能为 ,
, 的水合能为
的水合能为 ,Cu的第二电离能为
,Cu的第二电离能为 。)
。)
(4) 可与某有机多齿配体形成具有较强荧光性能的配合物,其结构如图所示。已知:吡啶(
可与某有机多齿配体形成具有较强荧光性能的配合物,其结构如图所示。已知:吡啶( )、苯酚(
)、苯酚( )含有与苯类似的
)含有与苯类似的 、
、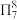 大π键,所有原子共平面。有机多齿配体中p轨道能提供一对电子的原子是
大π键,所有原子共平面。有机多齿配体中p轨道能提供一对电子的原子是___________ (填标号);1mol配合物中含配位键个数为___________ 。___________ 个。
②该晶胞中距离最近的Cu原子的核间距为apm,则该晶胞的密度为___________  (用含a、
(用含a、 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值,
表示阿伏加德罗常数的值, )。
)。
(1)Cu元素位于周期表
(2)下列说法
| A.基态铜原子的核外电子有29种不同的空间运动状态 |
B.铜催化烯烃硝化反应时会产生 , , 的键角比 的键角比 大 大 |
C. 中非金属元素电负性: 中非金属元素电负性: |
D.配位键的强度: 大于 大于 |
(3)高温下固体中
 比
比 稳定,常温下水溶液中
稳定,常温下水溶液中 离子比
离子比 离子稳定(水溶液中
离子稳定(水溶液中 易发生歧化反应生成
易发生歧化反应生成 ),原因是
),原因是 的水合能为
的水合能为 ,
, 的水合能为
的水合能为 ,Cu的第二电离能为
,Cu的第二电离能为 。)
。)(4)
 可与某有机多齿配体形成具有较强荧光性能的配合物,其结构如图所示。已知:吡啶(
可与某有机多齿配体形成具有较强荧光性能的配合物,其结构如图所示。已知:吡啶( )、苯酚(
)、苯酚( )含有与苯类似的
)含有与苯类似的 、
、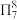 大π键,所有原子共平面。有机多齿配体中p轨道能提供一对电子的原子是
大π键,所有原子共平面。有机多齿配体中p轨道能提供一对电子的原子是
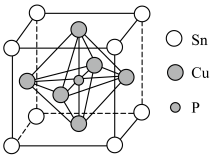
②该晶胞中距离最近的Cu原子的核间距为apm,则该晶胞的密度为
 (用含a、
(用含a、 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值,
表示阿伏加德罗常数的值, )。
)。
您最近一年使用:0次
2023-11-26更新
|
356次组卷
|
4卷引用:江西省上饶市婺源县天佑中学2023-2024学年高三上学期期中考试化学试卷
江西省上饶市婺源县天佑中学2023-2024学年高三上学期期中考试化学试卷浙江省9+1高中联盟2023-2024学年高三上学期期中考试化学试题 (已下线)专题04 物质结构与性质(2大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)(已下线)压轴题10 物质结构与性质综合题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
3 . 化合物M由两种短周期主族元素组成,在一定条件下可以发生下列转化:
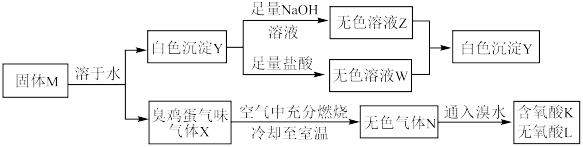
请回答下列问题:
(1)固体M的化学式为___________ 。
(2)无氧酸L中阴离子对应元素在元素周期表中的位置为___________ ,其基态原子中电子的空间运动状态有___________ 种。
(3)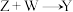 的化学方程式为
的化学方程式为___________ 。
(4)上述流程的反应中涉及的短周期非金属元素的电负性由大到小的顺序为___________ 。
(5)如图所示,在室温下向甲、乙两相同密闭容器中,分别充入等物质的量气体X和气体N。
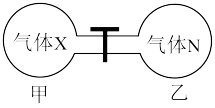
①反应前两容器中的气体密度: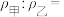
___________ 。
②打开活塞,使气体充分反应,则反应前后的压强: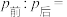
___________ 。
(6)将无色气体N通入到浓硝酸中,有红棕色气体冒出,在反应中n(氧化剂):n(还原剂)=___________ 。

请回答下列问题:
(1)固体M的化学式为
(2)无氧酸L中阴离子对应元素在元素周期表中的位置为
(3)
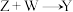 的化学方程式为
的化学方程式为(4)上述流程的反应中涉及的短周期非金属元素的电负性由大到小的顺序为
(5)如图所示,在室温下向甲、乙两相同密闭容器中,分别充入等物质的量气体X和气体N。

①反应前两容器中的气体密度:
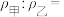
②打开活塞,使气体充分反应,则反应前后的压强:
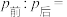
(6)将无色气体N通入到浓硝酸中,有红棕色气体冒出,在反应中n(氧化剂):n(还原剂)=
您最近一年使用:0次
2023-11-22更新
|
88次组卷
|
2卷引用:江西省2024届高三上学期11 月一轮总复习调研测试化学试题
解题方法
4 . 将氟气通入氢氧化钠溶液中,可得OF2.OF2是一种无色、几乎无味的剧毒气体,主要用于氧化氟化反应、火箭工程助燃剂等。请回答下列问题:
(1)OF2中O的化合价为_______ ,OF2中O原子的杂化轨道类型是_______ ,OF2分子的空间构型为_______ 。
(2)与H2O分子相比,OF2分子的键角更_______ (填“大”或“小”)。
(3)与H2O分子相比,OF2分子的极性更_______ (填“大” 或“小”),原因是_______ ;
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)_______ 。
(1)OF2中O的化合价为
(2)与H2O分子相比,OF2分子的键角更
(3)与H2O分子相比,OF2分子的极性更
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)
您最近一年使用:0次
2023-11-22更新
|
350次组卷
|
2卷引用:江西省赣州市厚德外国语学校2023-2024学年高三上学期11月月考化学试卷
名校
解题方法
5 . 很多含巯基(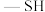 )的有机化合物是重金属元素汞和钛的解毒剂。如图中的解毒剂化合物I可与氧化汞生成化合物Ⅱ,化合物Ⅲ也是一种汞解毒剂,化合物Ⅳ是一种强酸,下列说法正确的是
)的有机化合物是重金属元素汞和钛的解毒剂。如图中的解毒剂化合物I可与氧化汞生成化合物Ⅱ,化合物Ⅲ也是一种汞解毒剂,化合物Ⅳ是一种强酸,下列说法正确的是
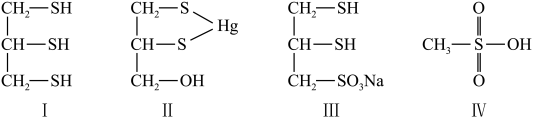
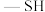 )的有机化合物是重金属元素汞和钛的解毒剂。如图中的解毒剂化合物I可与氧化汞生成化合物Ⅱ,化合物Ⅲ也是一种汞解毒剂,化合物Ⅳ是一种强酸,下列说法正确的是
)的有机化合物是重金属元素汞和钛的解毒剂。如图中的解毒剂化合物I可与氧化汞生成化合物Ⅱ,化合物Ⅲ也是一种汞解毒剂,化合物Ⅳ是一种强酸,下列说法正确的是
| A.Ⅲ比I的熔沸点高 | B.在II中S元素的电负性最大 |
C.在Ⅲ中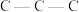 键角是 键角是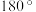 | D.在IV中硫氧键的键能均相等 |
您最近一年使用:0次
2023-11-21更新
|
59次组卷
|
2卷引用:江西省南昌市外国语学校2023-2024学年高三上学期10月月考化学试题
名校
6 . 第ⅢA和第ⅤA元素可形成多种化合物。请回答:
(1)基态B原子核外电子占据的最高能级符号是___________ ,基态As原子的价层电子排布式是___________ 。
(2)①固体储氢材料氨硼烷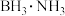 ,其结构和乙烷相似,下列有关说法正确的是
,其结构和乙烷相似,下列有关说法正确的是______ 。
A.氨硼烷中B原子的杂化方式为
B.相同条件下在水中的溶解度:氨硼烷>乙烷
C.元素B、N的第一电离能均高于相邻元素 形成的化合物中配位键的强度:
形成的化合物中配位键的强度:
________ 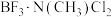 (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是________ 。
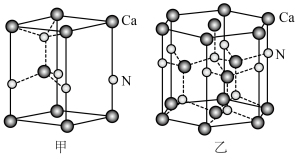
(3)一种含Ga化合物晶胞如图甲,三个晶胞围成一个六棱柱,如图乙,该化合物的化学式为___________ ,每个N原子周围距离最近的N原子数目为________ 。
(1)基态B原子核外电子占据的最高能级符号是
(2)①固体储氢材料氨硼烷
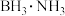 ,其结构和乙烷相似,下列有关说法正确的是
,其结构和乙烷相似,下列有关说法正确的是A.氨硼烷中B原子的杂化方式为

B.相同条件下在水中的溶解度:氨硼烷>乙烷
C.元素B、N的第一电离能均高于相邻元素
D. 是硼原子能量最低的激发态
是硼原子能量最低的激发态
 形成的化合物中配位键的强度:
形成的化合物中配位键的强度:
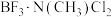 (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是(3)一种含Ga化合物晶胞如图甲,三个晶胞围成一个六棱柱,如图乙,该化合物的化学式为
您最近一年使用:0次
2023-11-15更新
|
607次组卷
|
4卷引用:江西省抚州市黎川县第二中学2023-2024学年高三上学期11月期中化学试题
江西省抚州市黎川县第二中学2023-2024学年高三上学期11月期中化学试题浙江省宁波市2023-2024学年高三上学期选考模拟考试化学试题(已下线)专题04 物质结构与性质(2大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)(已下线)压轴题10 物质结构与性质综合题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
解题方法
7 . 四种短周期主族元素在元素周期表中的相对位置如图所示,且X、Y、Z和Q四种元素的p轨道电子总数为24。化学家鲍林以Y的电负性作为参照标准,得出了各元素的电负性。下列叙述错误的是
| X | Y | |||
| Z | Q |
| A.最简单氢化物的稳定性:Y>Q>Z |
B. 分子中每个原子最外层都达到8电子稳定结构 分子中每个原子最外层都达到8电子稳定结构 |
| C.最高价氧化物对应水化物的酸性: Z<Q |
D.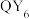 分子呈正八面体形 分子呈正八面体形 |
您最近一年使用:0次
2023-10-28更新
|
341次组卷
|
2卷引用:江西省部分高中学校2023-2024学年高三上学期10月联考化学试题
解题方法
8 . CrO2Cl2可作化工生产的氧化剂或氯化剂。制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。下列说法正确的是
| A.CCl4为极性分子 | B.熔点:KCl>COCl2 |
| C.电负性:C>Cl | D.KCl含有非极性键 |
您最近一年使用:0次
2023-09-24更新
|
45次组卷
|
2卷引用:江西红色十校2024届高三上学期9月联考化学试题
名校
9 .  晶体具有优良的光学和物理学特性,被广泛应用于一些高科技领域。下列说法正确的是
晶体具有优良的光学和物理学特性,被广泛应用于一些高科技领域。下列说法正确的是
 晶体具有优良的光学和物理学特性,被广泛应用于一些高科技领域。下列说法正确的是
晶体具有优良的光学和物理学特性,被广泛应用于一些高科技领域。下列说法正确的是A.基态原子未成对电子数: |
B.电负性: |
C. 存在非极性键 存在非极性键 |
D.基态 原子核外电子的运动状态有5种 原子核外电子的运动状态有5种 |
您最近一年使用:0次
2023-09-10更新
|
107次组卷
|
2卷引用:江西省南昌市2023-2024学年高三上学期开学考试化学试题
解题方法
10 . 离子键的百分数是依据电负性的差值计算出来的,差值越大,离子键的百分数越大,下列几种化合物的化学键中离子键的百分数最大的是
| A.LiF | B.AlCl3 | C.MgO | D.SO3 |
您最近一年使用:0次
2023-09-09更新
|
110次组卷
|
3卷引用:江西省部分高中学校2024届高三上学期9月第一次联考化学试题



