解题方法
1 . 我国科学家在寻找“点击反应”的砌块过程中,发现一种新的化合物,结构如下图所示,X、Y、Z、W是原子序数依次增大的短周期主族元素,已知Z的原子序数是Y的2倍,基态X原子有3个未成对电子,下列说法正确的是
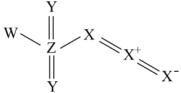
| A.单质的沸点:Z>W | B.电负性:Z>X |
| C.第一电离能:Y>X | D.原子半径:W>Z>Y>X |
您最近一年使用:0次
名校
解题方法
2 . 在光照下,螺吡喃发生开、闭环转换而变色,过程如图。下列关于开、闭环螺吡哺说法正确的是
| A.闭环螺吡喃中含有2种官能团 | B.闭环螺吡喃的分子式为 |
| C.均有手性碳原子 | D.闭环螺吡喃亲水性更好 |
您最近一年使用:0次
真题
名校
3 . X、Y、Z、W四种短周期主族元素,原子序数依次增大。X、Y与Z位于同一周期,且只有X、 Y元素相邻。X基态原子核外有2个未成对电子,W原子在同周期中原子半径最大。下列说法不正确 的是
A.第一电离能: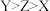 |
B.电负性: |
C.Z、W原子形成稀有气体电子构型的简单离子的半径: |
D. 与水反应生成产物之一是非极性分子 与水反应生成产物之一是非极性分子 |
您最近一年使用:0次
2023-06-21更新
|
8582次组卷
|
16卷引用:天津市南开中学2023-2024学年高二下学期期中考试化学试卷
天津市南开中学2023-2024学年高二下学期期中考试化学试卷2023年高考浙江卷化学真题(6月)(已下线)2023年高考浙江卷化学真题(6月)变式题(选择题11-16)(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第19讲元素周期律与元素周期表(已下线)专题12 物质结构与性质(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)(已下线)考点41 原子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)天津市武清区城关中学2023-2024学年高三上学期第二次阶段性练习化学试题 浙江省绍兴市诸暨市2023-2024学年高二上学期期末检测化学试题江苏省扬州中学2023-2024学年高二下学期3月考试化学试题江西省宜春市百树学校2023-2024学年高三上学期11月期中考试化学试卷江苏省常州市联盟校2023-2024学年高二下学期3月阶段调研化学试题
4 . N,N-二甲基甲甲酰胺[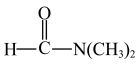 ]是良好的溶剂。下列说法不正确的是
]是良好的溶剂。下列说法不正确的是
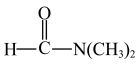 ]是良好的溶剂。下列说法不正确的是
]是良好的溶剂。下列说法不正确的是| A.原子半径:C<N | B.元素的电负性:N<O |
| C.该分子中的碳原子有sp2、sp3两种杂化方式 | D.该物质分子间存在范德华力 |
您最近一年使用:0次
名校
解题方法
5 . 氢能是一种极具发展潜力的清洁能源,下列物质都是具有广阔应用前景的储氢材料。回答下列问题:
(1)氢化钠(NaH)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原产物为_____ 。
(2)Ti-Fe合金室温下吸、放氢的速率快,Ti元素在周期表中的位置是____ 。
(3) (氨硼烷)具有很高的储氢容量及相对低的放氢温度(<350℃),是颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(<350℃),是颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成。
进行合成。
① 中涉及的元素H、B、N电负性最大的是
中涉及的元素H、B、N电负性最大的是______ 。
②键角:
_____  (填“>”、“<”或“=”),原因是
(填“>”、“<”或“=”),原因是_______ 。
(4)Fe-Mg合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
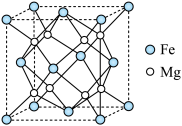
①距离Mg原子最近的Fe原子个数是___________ 。
②若该晶胞的棱长为anm,阿伏加德罗常数的值为 ,则该合金的密度为
,则该合金的密度为___________  。
。
③若该晶体储氢时, 分子在晶胞的体心和棱心位置,则含Mg48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg48g的该储氢合金可储存标准状况下 的体积约为
的体积约为___________ L。
(1)氢化钠(NaH)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原产物为
(2)Ti-Fe合金室温下吸、放氢的速率快,Ti元素在周期表中的位置是
(3)
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度(<350℃),是颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(<350℃),是颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成。
进行合成。①
 中涉及的元素H、B、N电负性最大的是
中涉及的元素H、B、N电负性最大的是②键角:

 (填“>”、“<”或“=”),原因是
(填“>”、“<”或“=”),原因是(4)Fe-Mg合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

①距离Mg原子最近的Fe原子个数是
②若该晶胞的棱长为anm,阿伏加德罗常数的值为
 ,则该合金的密度为
,则该合金的密度为 。
。③若该晶体储氢时,
 分子在晶胞的体心和棱心位置,则含Mg48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg48g的该储氢合金可储存标准状况下 的体积约为
的体积约为
您最近一年使用:0次
2023-03-30更新
|
830次组卷
|
2卷引用:天津市南开区2022-2023学年高三下学期质量检测(一)化学试题
6 . W、X、Y、Z、R是五种短周期主族元素,原子序数依次增大。W元素的一种离子与Li+具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为3:2,X与Z同主族,Z的价电子排布式为3s23p4。下列说法不正确的是
| A.气态氢化物的热稳定性:Z>Y | B.第一电离能:R>Z>Y |
| C.原子半径:R>X>W | D.电负性:Z>R>X |
您最近一年使用:0次
2023-03-22更新
|
393次组卷
|
2卷引用:天津市南开中学2023-2024学年高三下学期第四次月考化学试卷
名校
7 . 如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法中,正确的是
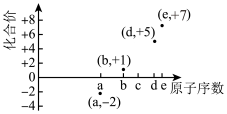

A.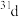 和 和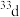 属于同种核素 属于同种核素 | B.第一电离能: ,电负性: ,电负性: |
C.最简单气态氢化物的稳定性: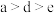 | D.a和b形成的化合物可能含共价键 |
您最近一年使用:0次
名校
解题方法
8 . 短周期主族元素X、Y、Z、W、M、N 的原子序数依次增大,X 核外电子只有 1 种运动状态,Y、W 的 2p 轨道均含有 2 个未成对电子,M 是与X 不同主族的金属元素,N 的氢氧化物具有两性,下列说法正确的是
| A.电负性:Z<Y<W |
| B.Y 的氢化物沸点不一定低于W 的氢化物 |
| C.第一电离能:M<N |
| D.N 的单质可以在高温下还原 M 的氧化物 |
您最近一年使用:0次
2023-01-06更新
|
619次组卷
|
5卷引用:天津市南开中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
9 . 现有部分前四周期元素的性质或原子结构如表,则:
| 元素编号 | 元素性质或原子结构 |
| A | 第三周期中的半导体材料 |
| B | L层s电子数比p电子数少1 |
| C | 第三周期主族元素中其第一电离能最大 |
| D | 前四周期中其未成对电子数最多 |
| A.B单质分子中,含有3个σ键,元素B的气态氢化物的空间构型为正四面体形 |
| B.C的最高价含氧酸根离子中C原子轨道杂化方式是sp2杂化 |
| C.元素D基态原子的核外电子排布式:1s22s22p63s23p63d54s1 |
| D.A,B,C三元素的电负性由大到小的顺序为:A>B>C |
您最近一年使用:0次
2022-10-08更新
|
115次组卷
|
3卷引用:天津市崇化中学2022-2023学年高三上学期期末检测化学试题
解题方法
10 . 铁、铜和镁是生命必需的元素,也是人类使用广泛的金属,铁和铜及其重要化合物在生产中有着重要的应用。回答下列问题:
(1)某元素X与铜同周期,基态X原子是该周期基态原子中未成对电子最多的,其原子结构示意图为_______ 。
(2)Fe2+变为基态铁原子时所得的电子填充到_______ 能级。
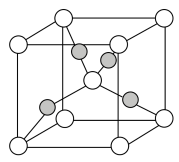
(3)新制备的Cu(OH)2可将乙醛氧化成乙酸(CH3COOH),而自身还原成Cu2O。1个乙酸分子中共平面的原子最多为_______ 个。图所示的Cu2O晶胞中,铜周围紧邻且等距的氧有_______ 个,已知其晶胞密度为bg/cm3,则该晶胞棱长为_______ pm(设NA为阿伏加德罗常数的值)。
(4)叶绿素的结构示意如图所示。
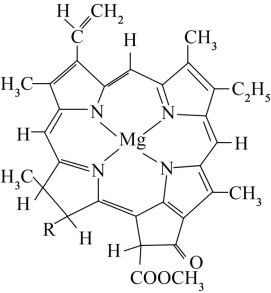
①该结构中包含的作用力有_______ (用字母填空)。
a.离子键 b.σ键 c.π键 d.分子间作用力
②其中碳原子的杂化类型为_______ ,碳、氮、氧三种元素的电负性由大到小的顺序是_______ 。元素As与N同族预测As的简单氢化物的VSEPR模型为_______ ,其键角_______ 109º28´(填“大于”、“小于”或“等于”)原因是_______ 。
(1)某元素X与铜同周期,基态X原子是该周期基态原子中未成对电子最多的,其原子结构示意图为
(2)Fe2+变为基态铁原子时所得的电子填充到
(3)新制备的Cu(OH)2可将乙醛氧化成乙酸(CH3COOH),而自身还原成Cu2O。1个乙酸分子中共平面的原子最多为

(4)叶绿素的结构示意如图所示。

①该结构中包含的作用力有
a.离子键 b.σ键 c.π键 d.分子间作用力
②其中碳原子的杂化类型为
您最近一年使用:0次



