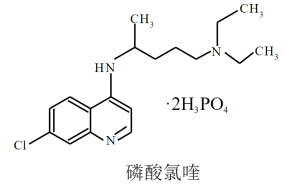
| A.磷酸氯喹既能与强酸、又能与强碱反应 |
| B.磷酸氯喹中C、N、O元素的电负性大小顺序是:N>O>C |
| C.磷酸氯喹中的N—H键的键能大于C—H键的键能 |
| D.磷酸氯喹结构中存在σ键、大π键等 |
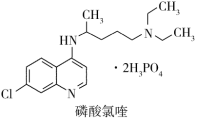
| A.磷酸氯喹中N、O、P元素的电负性:N>O>P |
| B.磷酸氯喹中N的杂化方式sp2、sp3 |
| C.磷酸氯喹中的N-H键的键能大于C-H键的键能 |
| D.磷酸氯喹结构中存在σ键、大π键等 |
(1)基态钙原子核外有
(2)奥地利物理学家薛定谔提出了描述微观粒子运动规律的波动方程——薛定谔方程。在结构化学中,用四个量子数表示基态原子核外电子运动状态,有关信息如下:
| 名称 | 符号 | 含义 | 取值范围 |
| 主量子数 | n | 确定电子能级的主要量子数,表示能层序数 | n=1,2,3,4,… |
| 角量子数 | l | 确定原子轨道或电子云的形状,表示亚层 | l=0,1,2,3,… |
| 磁量子数 | m | 确定原子轨道或电子云在空间的取向 | m=0,±1,±2… |
| 自旋量子数 | ms | 确定原子轨道中电子自旋方向 | ms=± |
A.n=4,l=0,m=0,ms=+ ;n=4,l=0,m=0,ms=+ ;n=4,l=0,m=0,ms=+ |
B.n=4,l=0,m=0,ms=+ ;n=4,l=0,m=0,ms=- ;n=4,l=0,m=0,ms=- |
C.n=4,l=0,m=1,ms=+ ;n=4,l=0,m=0,ms=- ;n=4,l=0,m=0,ms=- |
D.n=4,l=2,m=0,ms=+ ;n=4,l=0,m=1,ms=- ;n=4,l=0,m=1,ms=- |

①磷酸易溶于水,其主要原因是
②脱氧核糖分子中碳原子的杂化类型是
(4)我国科学家利用富勒烯(C60)合成单层聚合C60(如图所示)。


1 mol富勒烯中含有
(5)钙晶体有三种晶胞,如图所示:

①甲、乙、丙中,钙原子个数之比为
②设NA为阿伏加德罗常数的值。已知丙中底面边长为apm,高为b pm,则它的密度为
(1)在化合物
 中中心原子的VSEPR模型为
中中心原子的VSEPR模型为 的离子半径由小到大的顺序为
的离子半径由小到大的顺序为(2)基态X原子的价层电子排布式为
 是一种火箭燃料的成分,
是一种火箭燃料的成分, 分子中X原子轨道的杂化类型是
分子中X原子轨道的杂化类型是(3)R、W两元素电负性较强的是(写元素符号)
(4)W的含氧酸有多种,写出其中两种的分子式:
(1)如图所示为元素周期表中氮元素部分信息,数据“14.01”表示的是

(2)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是
a.NH3比PH3稳定性强 b.电负性数据:N3.0、P2.1
c.硝酸显强氧化性,磷酸不显强氧化性 d.氮气常温是气体,磷单质是固体
(3)2020年12月17日,我国“嫦娥五号”返回器携月壤成功着陆。研究发现,月壤中存在天然的铁、金、银、铅、锌、铜、锑、铼等矿物颗粒。
①要证明月壤中含有这些元素,可采用的方法是
②写出铜的基态原子的电子排布式
③周期表中,与铜位于同一周期的元素原子中最外层电子数与铜原子的相同的元素有
(1)碳原子的价电子排布图为
(2)碳可以形成多种有机化合物,如图所示是一种吡啶的结构,分子中所有原子都在一个平面上。
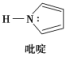
①吡啶中所有元素的电负性由大到小的顺序
②吡啶结构中N原子的杂化方式
③分子中的大π键可以用符号Π
 表示,其中m代表参与形成大π键的原子数, n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数, n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π )。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为
)。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为(3)碳可形成CO、CO2等多种无机化合物。
①在反应CO转化成CO2的过程中,下列说法正确的是
A.每个分子中孤对电子数不变
B.分子极性变化
C.原子间成键方式改变
D.分子间作用力减弱
②干冰和冰是常见的分子晶体,晶体中的空间利用率:干冰
(4)在2017年,中外科学家团队共同合成了碳的一种新型同素异形体:T-碳。T-碳的结构是:将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,形成碳的一种新型三维立方晶体结构,如图。已知T-碳晶胞参数为a pm,阿伏加德罗常数为NA,则T-碳的密度的表达式为
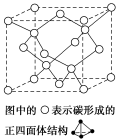
(5)碳酸盐在一定温度下会发生分解,实验证明:碳酸盐的阳离子不同、分解温度不同,如表所示:
| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1 172 | 1 360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高
| A | 基态原子核外有2个未成对电子 |
| B | 同周期中,占据的能级数最多,但所用的电子数最少 |
| C | 基态原子核外有2个未成对电子 |
| D | 同周期元素中,原子半径最大(不考虑稀有气体) |
| E | C、E、F三种元素的价电子数相同 |
| F | 同周期元素中,基态原子的未成对电子数最多 |
(1)C元素基态原子核外电子有
(2)C和D可形成一种既含有共价键又含有离子键的化合物,该化合物的电子式为
(3)A、B、C、D四种元素电负性由大到小的顺序为
(4)写出一个化学方程式证明元素C和E的非金属性强弱:
(5)检验某物质或某溶液中是否含D元素的方法是
8 . 根据信息回答下列问题:
(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
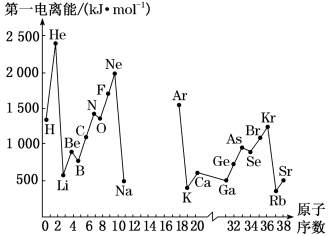
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为
②图中Ge元素中未成对电子有
(2)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出部分元素的电负性:
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。
①根据表中给出的数据,可推知元素的电负性具有的变化规律
②通过分析电负性值变化规律,确定Al元素电负性值的最小范围
③判断下列物质是离子化合物还是共价化合物:
A Li3N B PCl3 C MgCl2 D SiC
Ⅰ.属于离子化合物的是
Ⅱ.属于共价化合物的是
请设计一个实验方案证明上述所得到的结论
(1)铜在元素周期表中的位置
(2)氯与硫相比,非金属性较强的是
a.常温下氯的单质呈气态,硫的单质呈固态
b.稳定性:HCl>H2S
c.酸性:HClO4>H2SO4
d.氯的电负性大于硫的电负性
(3)含氮化合物(CH3)3N与盐酸反应,离子方程式为:(CH3)3N+H+=[(CH3)3NH]+,该反应过程中新生成的化学键为
a.离子键 b.配位键 c.氢键 d.非极性共价键
若化合物(CH3)3N能溶于水,其可能的原因是
(4)Cu与H元素形成某种晶体的结构如图所示,则该晶体的化学式为

(1)量子力学把电子在原子核外的一个空间运动状态称为一个
(2)写出
 原子的外围电子排布式:
原子的外围电子排布式: 同周期的所有副族元素的基态原子中,最外层电子数与
同周期的所有副族元素的基态原子中,最外层电子数与 相同的元素有
相同的元素有(3)下列
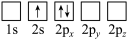
 原子电子排布图表示的状态中,能量最低和最高的分别为
原子电子排布图表示的状态中,能量最低和最高的分别为A
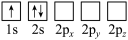 B
B 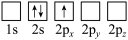
C
 D
D 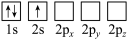
Ⅱ.有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层
 能级的电子数等于次外层的电子总数, B元素可分别与A、C、D生成
能级的电子数等于次外层的电子总数, B元素可分别与A、C、D生成 型化合物,并知在
型化合物,并知在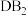 中,
中, 与
与 的质量比为
的质量比为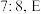 原子的价电子排布式为
原子的价电子排布式为 。根据以上条件,回答下列问题:
。根据以上条件,回答下列问题:(1)C的基态原子的电子占据最高能层的符号为
 原子的价电子排布图
原子的价电子排布图(2)A、B、C三种元素的第一电离能由大到小的顺序
(3)元素B和D的电负性由大到小的顺序
(4)写出E的元素符号



