1 . 过渡元素镍钛在分子捕捉、量子材料等方向日益重要。回答下列问题:
(1)某Ni离子与 、
、 形成的晶体能捕捉苯分子,结构如图甲所示。该晶体中非金属元素电负性由大到小的顺序为
形成的晶体能捕捉苯分子,结构如图甲所示。该晶体中非金属元素电负性由大到小的顺序为______ ,Ni的化合价为______ ,杂化轨道数为______ 。 与Ni离子形成配位键时的配位原子为
与Ni离子形成配位键时的配位原子为______ ,键角∠H-N-H______ (填“>”或“<”)107.3°。
(2)部分钛酸锶晶胞结构如图乙。晶体Ⅰ的化学式为Ⅰ_____ ,该系列晶体的化学式可表示为_____ (用含n的式子表示,n为Ti原子个数),当 时,晶体化学式为
时,晶体化学式为______ 。
(1)某Ni离子与
 、
、 形成的晶体能捕捉苯分子,结构如图甲所示。该晶体中非金属元素电负性由大到小的顺序为
形成的晶体能捕捉苯分子,结构如图甲所示。该晶体中非金属元素电负性由大到小的顺序为 与Ni离子形成配位键时的配位原子为
与Ni离子形成配位键时的配位原子为(2)部分钛酸锶晶胞结构如图乙。晶体Ⅰ的化学式为Ⅰ
 时,晶体化学式为
时,晶体化学式为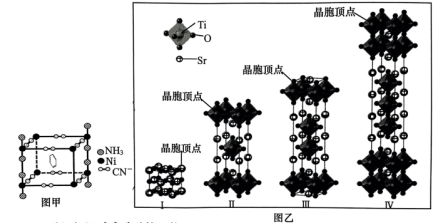
您最近一年使用:0次
解题方法
2 .  是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
(1) 与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为
与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为___________ 。
(2) 可形成
可形成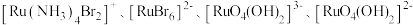 四种配离子且配离子中不存在非极性键,其中
四种配离子且配离子中不存在非极性键,其中 离子半径最小的配离子是
离子半径最小的配离子是___________ ,具有对称结构的 中
中 为
为___________ 。图1中通过螯合作用形成配位键的N原子的杂化方式为___________ , 离子配体中N原子与中心
离子配体中N原子与中心 离子配位的原因是
离子配位的原因是___________ 。

(3) 的晶体结构如图2所示。
的晶体结构如图2所示。
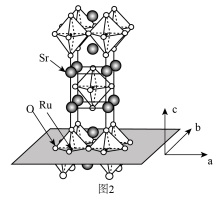
① 和
和 的电负性:
的电负性:
___________  (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为
(填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为___________ 形。
②用 表示阿伏伽德罗常数的值,晶胞参数为
表示阿伏伽德罗常数的值,晶胞参数为 ,
, ,则其密度为
,则其密度为___________  (列出计算式即可)。
(列出计算式即可)。
 是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:(1)
 与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为
与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为(2)
 可形成
可形成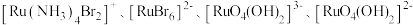 四种配离子且配离子中不存在非极性键,其中
四种配离子且配离子中不存在非极性键,其中 离子半径最小的配离子是
离子半径最小的配离子是 中
中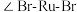 为
为 离子配体中N原子与中心
离子配体中N原子与中心 离子配位的原因是
离子配位的原因是
(3)
 的晶体结构如图2所示。
的晶体结构如图2所示。
①
 和
和 的电负性:
的电负性:
 (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为
(填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为②用
 表示阿伏伽德罗常数的值,晶胞参数为
表示阿伏伽德罗常数的值,晶胞参数为 ,
, ,则其密度为
,则其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
名校
解题方法
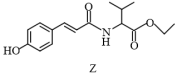
3 . 抗氧化剂香豆酰缬氨酸乙酯(Z)可由图中反应制得。
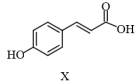 +
+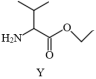
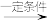
下列关于化合物X、Y、Z说法不正确的是
 +
+
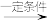

下列关于化合物X、Y、Z说法不正确的是
| A.化合物X中所有原子一定共平面 |
| B.化合物Y中所含元素的电负性:O>N>C>H |
| C.化合物Z中的含氧官能团有:酯基、酰胺基、羟基 |
| D.化合物Z的分子式为C16H21O4N |
您最近一年使用:0次
2022-06-15更新
|
361次组卷
|
2卷引用:山东省青岛市2022届高三下学期五月模拟考试化学试题
名校
解题方法
4 . 二氯异氰尿酸钠是中国疾控中心研发的“-18℃低温消毒剂”主要成分之一,其合成方法如下图。下列说法错误的是
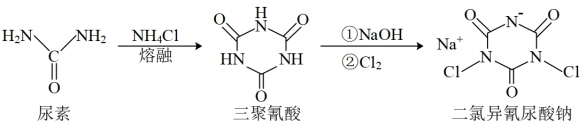

| A.尿素和氯化铵中N原子杂化方式相同 |
| B.二氯异氰尿酸钠所含元素中电负性最大的是氧 |
| C.二氯异氰尿酸钠晶体中存在离子键、共价键和配位键 |
D.三聚氰酸具有与苯环类似的结构,可推知三聚氰酸分子中存在大 键 键 |
您最近一年使用:0次
2022-04-08更新
|
673次组卷
|
5卷引用:山东省青岛市2022高考一模化学试题
名校
解题方法
5 . 近日,科学家研究利用CaF2晶体释放出的Ca2+和F-脱除硅烷,拓展了金属氟化物材料的生物医学功能。下列说法错误的是


| A.F、Si和Ca 电负性依次减小,原子半径依次增大 |
| B.OF2与 SiO2中含有化学键类型和氧原子杂化方式均相同 |
C.图中A处原子分数坐标为(0,0,0),则B 处原子分数坐标为 |
D.脱除硅烷反应速率依赖于晶体提供自由氟离子的能力,脱硅能力 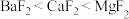 |
您最近一年使用:0次
2021-03-18更新
|
1472次组卷
|
12卷引用:山东省青岛市2021届高三3月统一质量检测化学试题
山东省青岛市2021届高三3月统一质量检测化学试题(已下线)押山东卷第04题 物质结构与性质选择题-备战2021年高考化学临考题号押题(山东卷)辽宁省协作体2021-2022学年下学期高三第一次模拟考试化学试题辽宁省阜新市实验中学2021-2022学年高三下学期第一次模拟考试化学试题山东省临沂市第一中学2020-2021学年高二下学期6月月考化学试题(已下线)专题讲座(十二) 晶胞参数、坐标参数的分析与应用(精练)-2022年一轮复习讲练测(已下线)专题13 物质结构与性质基础-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省泰安第四中学2020-2021学年高二下学期4月月考化学试题(已下线)押新高考卷08题 物质结构与性质-备战2022年高考化学临考题号押题(新高考通版)湖南省常德市第一中学2022-2023学年高三下学期第六次月考化学试题湖南省株洲市醴陵市第一中学2023届高三月考(五)化学试题湖南省长沙市第一中学2023-2024学年高三上学期月考卷(四)化学试题
名校
解题方法
6 . 我国科研人员发现了一种新型超导体 ,由
,由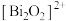 和
和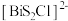 交替堆叠构成。已知
交替堆叠构成。已知 位于第六周期VA族,下列有关说法错误的是
位于第六周期VA族,下列有关说法错误的是
 ,由
,由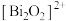 和
和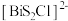 交替堆叠构成。已知
交替堆叠构成。已知 位于第六周期VA族,下列有关说法错误的是
位于第六周期VA族,下列有关说法错误的是A. 的价电子排布式为 的价电子排布式为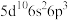 |
B.有关元素的电负性: |
C. 属于含共价键的离子化合物 属于含共价键的离子化合物 |
| D.该新型超导体的组成元素全部位于元素周期表p区 |
您最近一年使用:0次
2020-05-12更新
|
830次组卷
|
16卷引用:山东省青岛市2020届高三4月统一质量检测(一模)化学试题
山东省青岛市2020届高三4月统一质量检测(一模)化学试题(已下线)2021年高考化学押题预测卷(湖北卷)03(含考试版、答题卡、参考答案、全解全析)山东省青岛市即墨区第一中学2022-2023学年高三上学期10月月考化学试题山东省烟台市中英文学校2021届高三上学期期末考试化学试题福建省泉州实验中学2021届高三3月测试(二)化学试题山东省潍坊第四中学2022届高三上学期第一次过程检测化学试题河北省石家庄市第二十三中学2021-2022学年高二下学期期中考试化学试题专题1~2 综合检测(提升卷)第二节综合拔高练山西省临汾市尧都区山西师范大学实验中学2021-2022学年高二下学期第一次月考化学考试试题山东省济宁市育才中学2022-2023学年高二上学期第二次学情检测化学试题广东省深圳市盐田高级中学2021-2022学年高二下学期4月考试化学试题广东省潮阳一中、宝安中学等七校联考2022-2023学年高三上学期第二次(11月)联考化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五高级中学(前郭五中)2023-2024学年高三上学期第三次考试 化学试卷 河南省郑州市宇华实验学校2023-2024学年高三上学期1月期末化学试题新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高二下学期第一次月考化学试卷
解题方法
7 . 氧、硫形成的化合物种类繁多,日常生活中应用广泛。如硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应的化学方程式如下:AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr。回答下列问题:
(1)已知银(Ag)位于元素周期表第五周期,与Cu同族,则基态Ag的价电子排布式为____________ 。
(2)下列关于物质结构与性质的说法,正确的是_________
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.Br、S、O三种元素的电负性顺序为 O>Br>S
C.Na 的第一电离能小于 Mg,但其第二电离能却远大于 Mg
D.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S
(3)依据VSEPR理论推测S2O32-的空间构型为_______________________ ,中心原子S的杂化方式为_____ ,[Ag(S2O3)2]3-中存在的化学键有______________ (填字母序号)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键
(4)第一电子亲和能(E1)是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ·mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如下表:
表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因__________ 。
(5)某种离子型铁的氧化物晶胞如下图所示,它由A、B组成。则该氧化物的化学式为:________ ,已知该晶体的晶胞参数为anm,阿伏伽德罗常数的值为NA,则密度ρ为____________ g·cm-3(用含a和NA 的代数式表示)。

(1)已知银(Ag)位于元素周期表第五周期,与Cu同族,则基态Ag的价电子排布式为
(2)下列关于物质结构与性质的说法,正确的是
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.Br、S、O三种元素的电负性顺序为 O>Br>S
C.Na 的第一电离能小于 Mg,但其第二电离能却远大于 Mg
D.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S
(3)依据VSEPR理论推测S2O32-的空间构型为
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键
(4)第一电子亲和能(E1)是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ·mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如下表:
| 元素 | Al | Si | P | S | Cl |
| E1(kJ·mol-1) | 42.5 | 134 | 72.0 | 200 | 349 |
表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因
(5)某种离子型铁的氧化物晶胞如下图所示,它由A、B组成。则该氧化物的化学式为:

您最近一年使用:0次



