解题方法
1 . 某天然矿石的晶体由原子序数依次增大的三种前四周期元素X、Y、Z组成,该晶体结构如图所示。其中Y元素的一种氧化物具有磁性,Z元素只有一个4s电子。下列说法正确的是
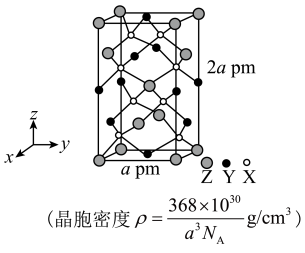
| A.Y、Z均位于元素周期表的ds区 |
| B.晶胞中各原子的配位数不相同 |
| C.该天然矿石的化学式ZYX₂ |
| D.电负性:Y>X |
您最近一年使用:0次
2 . 物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
| 选项 | 性质差异 | 结构因素 |
| A | 正戊烷的沸点高于新戊烷 | 正戊烷分子极性大于新戊烷,范德华力强 |
| B | 金刚石的熔点高于 | 金刚石为共价晶体, 为分子晶体 为分子晶体 |
| C | 三氟乙酸的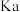 大于三氯乙酸的 大于三氯乙酸的 |  电负性大于 电负性大于 ,三氟乙酸 ,三氟乙酸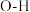 键极性强 键极性强 |
| D |  在水中的溶解度大于CO 在水中的溶解度大于CO |  为非极性分子, 为非极性分子, 为极性分子 为极性分子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
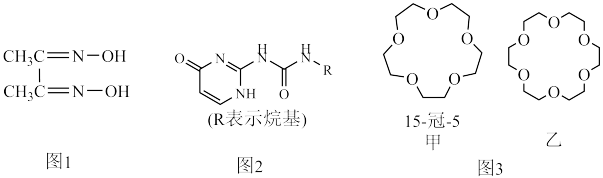
3 . 配合物和超分子广泛应用于新材料合成、物质的鉴别和分离。如丁二酮肟(如图1)可用于鉴别 Ni2+,嘧啶衍生物(如图2)是形成高韧性超分子的单体,冠醚(如图3)是皇冠状分子,可有大小不同的空穴适配不同大小的碱金属离子。
(1)基态 Ni2+核外未成对电子的数目为______ 。
(2)丁二酮肟与 Ni²⁺生成血红色配合物的结构为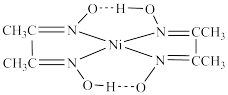 ,相同压强下,该配合物的沸点低于干二酮肟的原因为
,相同压强下,该配合物的沸点低于干二酮肟的原因为_______ 。
(3)Ni在一定条件下可与CO形成 Ni(CO)x,分子中每个Ni原子的价电子数及其周围CO提供的成键电子数之和为18,则x=_______ 。
(4)图2所示分子所含元素电负性由小到大的顺序为______ 。
(5)冠醚是状如皇冠的一类醚,分子中存在空穴,图3中甲、乙两种冠醚可分别识别 Na+、K+,其主要原因为________ ;乙的名称为______ 。
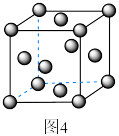
(6)金属Ni的立方晶胞结构如图4所示,则Ni的空间利用率为________ (用含π的代式表示)。
(1)基态 Ni2+核外未成对电子的数目为
(2)丁二酮肟与 Ni²⁺生成血红色配合物的结构为
 ,相同压强下,该配合物的沸点低于干二酮肟的原因为
,相同压强下,该配合物的沸点低于干二酮肟的原因为(3)Ni在一定条件下可与CO形成 Ni(CO)x,分子中每个Ni原子的价电子数及其周围CO提供的成键电子数之和为18,则x=
(4)图2所示分子所含元素电负性由小到大的顺序为
(5)冠醚是状如皇冠的一类醚,分子中存在空穴,图3中甲、乙两种冠醚可分别识别 Na+、K+,其主要原因为
(6)金属Ni的立方晶胞结构如图4所示,则Ni的空间利用率为
您最近一年使用:0次
名校
解题方法
4 . FeSO4·7H2O的结构如图,下列说法错误的是

| A.键角:①>② | B.H2O与Fe2+、H2O与 的作用力类型相同 的作用力类型相同 |
| C.Fe2+的配位数是6 | D.电负性:O>S>H |
您最近一年使用:0次
解题方法
5 . 某离子化合物中的阳离子结构模型如图。已知X、Y、Z为原子序数依次增大的短周期元素,Z的核外成对电子数与未成对电子数之比为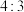 。下列说法错误的是
。下列说法错误的是
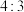 。下列说法错误的是
。下列说法错误的是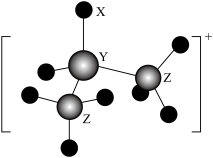
A.电负性: |
B. 该阳离子中含有 该阳离子中含有 配位键 配位键 |
| C.同周期第一电离能在Y与Z之间的元素有3种 |
| D.X与Y、Z均能形成正四面体形的离子 |
您最近一年使用:0次
名校
解题方法
6 . 下列化合物中碳原子的电负性最大的是
| A.乙烷 | B.乙炔 | C.乙烯 | D.甲烷 |
您最近一年使用:0次
名校
解题方法
7 . 元素B、Al、Ga位于周期表中IIIA族。下列说法正确的是
A.原子半径: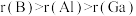 |
B.第一电离能: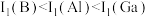 |
C.BN、 、 、 均为共价晶体 均为共价晶体 |
| D.可在周期表中元素Al附近寻找既能和酸又能和碱反应的金属 |
您最近一年使用:0次
2023-12-04更新
|
274次组卷
|
3卷引用:山东省泰安市宁阳四中2023-2024学年高二上学期期末化学模拟试卷
8 . 依据原子结构知识回答下列问题。
(1)下列说法错误的是_______ 。
A.电负性:Si<H<C<N
B.离子半径: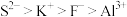
C.原子的未成对电子数: Cr>Mn>Si>Br
D.第二周期中元素原子的第一电离能介于B和N之间的元素有2种
E.前四周期元素中,基态原子中价电子数与其所在周期数相同的元素有4种
(2)基态S原子的价电子轨道表示式为_______ ,其电子占据的最高能层符号为_______ ,其价电子中两种自旋状态的电子数之比为_______ 。
(3)基态F原子核外电子的空间运动状态有_______ 种。下列属于F原子激发态的电子排布式是_______ (填标号,下同),其中能量较高的是_______ 。
A.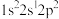 b.
b. c.
c. d.
d.
(4)Cr元素位于元素周期表_______ 区。Cr与Mn相比,第二电离能与第一电离能差值更大的是_______ ,原因是_______ 。
(1)下列说法错误的是
A.电负性:Si<H<C<N
B.离子半径:
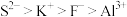
C.原子的未成对电子数: Cr>Mn>Si>Br
D.第二周期中元素原子的第一电离能介于B和N之间的元素有2种
E.前四周期元素中,基态原子中价电子数与其所在周期数相同的元素有4种
(2)基态S原子的价电子轨道表示式为
(3)基态F原子核外电子的空间运动状态有
A.
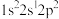 b.
b. c.
c. d.
d.
(4)Cr元素位于元素周期表
您最近一年使用:0次
2023-02-11更新
|
412次组卷
|
2卷引用:山东省泰安市新泰第一中学老校区2023-2024学年高二上学期第三次月考化学试题
名校
9 . 某物质M是制造染料的中间体,它的球棍模型如图所示,由短周期X、Y、Z、W四种元素组成,X元素原子半径最小,W的 轨道有一个未成对电子,Y、Z同主族.下列说法正确的是
轨道有一个未成对电子,Y、Z同主族.下列说法正确的是

 轨道有一个未成对电子,Y、Z同主族.下列说法正确的是
轨道有一个未成对电子,Y、Z同主族.下列说法正确的是
A.电负性: | B.最简单氢化物沸点: |
C. 是极性分子 是极性分子 | D.Z最高价氧化物对应水化物的空间构型为三角锥 |
您最近一年使用:0次
2021-05-21更新
|
1282次组卷
|
4卷引用:山东省泰安市新泰第一中学老校区(新泰中学)2023-2024学年高二下学期第一次月考化学试题



